心臟外科Ⅰ類切口預防用抗菌藥物路徑式專項管理效果研究
石秀錦,秦 英,方振威,鄭青敏,劉治軍,王海燕,魏娟娟,徐曉宇,林 陽(首都醫科大學附屬北京安貞醫院藥事部,北京 100029)
外科手術預防使用抗菌藥物一直是醫院管理中的一個難題,衛生部相繼制定了一系列相關文件旨在促進臨床合理使用抗菌藥物。心臟手術由于具有特殊性,如體外循環降低機體抵抗力,手術時間通常較長,瓣膜、血管等異物植入,術后都會留置中心動/靜脈插管、胸/心腔引流管、呼吸道插管、泌尿道插管等,因此與其他清潔手術相比手術部位感染發生率較高[1]。而一旦發生感染,即便是淺表傷口感染,也會延長患者住院時間,增加其經濟負擔。更為嚴重的胸骨感染和縱膈感染等,則會顯著增加死亡率,降低長期存活率[2-3]。由于心臟手術的高風險和臨床醫生的顧慮等多種因素,我院心外科Ⅰ類切口手術預防用抗菌藥物存在使用品種級別高、療程長、單次使用劑量大等諸多問題。2017年12月我院藥事部聯合其他部門進行了心臟外科Ⅰ類切口手術預防用抗菌藥物路徑式專項管理,實施了全程環節質量控制,以規范我院心臟外科手術預防性抗菌藥物的使用,保證預防性抗菌藥物使用的有效性、安全性和經濟性。由于心臟移植手術、全腹主動脈替換和孫氏手術的感染風險高,以上三種手術不被納入此次管理范圍。此外,感染性心內膜炎由于術前即存在感染,也不納入此次路徑式管理。本文對圍手術期預防用抗菌藥物管理后成效進行了回顧、統計和分析,旨在探索路徑式管理在抗菌藥物管理中的應用成效,為醫院加強圍手術期預防性抗菌藥物管理提供參考。
1 資料與方法
1.1 資料來源
住院患者抗菌藥物使用情況分析的資料來源于醫院HIS系統中提取的我院心臟外科七個病房路徑式管理前(2016年12月、2017年11月)和路徑式管理后(2017年12月)住院患者抗菌藥物數據,包括抗菌藥物名稱、劑型、規格、用量、金額等數據。術后感染率的比較,選取七個病房中某病房2016年12月1日-2017年1月15日期間進行手術的所有患者作為路徑式管理前組,2017年12月1日- 2018年1月15日期間進行手術的所有患者作為路徑式管理后組,排除接受心臟移植術、全腹主動脈替換術、孫氏手術的患者和術前即存在感染的患者。
1.2 路徑式管理措施
路徑式管理措施包括:藥事部聯合醫務部、感染科、院感辦、心臟外科共同制定本院《心臟外科Ⅰ類切口預防用抗菌藥物專項管理辦法》和《心臟外科Ⅰ類切口手術預防用抗菌藥物管理規范實施細則》,主要規范預防用藥品種、時機、術中追加和療程,并成立抗菌藥物使用合理性評判專家組,針對心外科手術抗菌藥物使用涉及的每一個環節,包括麻醉科、ICU和心外科室均制定抗菌藥物使用的點評標準;路徑式管理正式實施前,上述幾個部門聯合對各心臟外科醫護人員針對心外科手術抗菌藥物使用涉及的每一個環節進行抗菌藥物合理使用及以上院內規章制度的培訓,同時將審核評價標準(見表1)與臨床醫師進行溝通確認;路徑式管理實施期間,臨床藥師每日下臨床實時審核各心臟外科所有抗菌藥物醫囑,每位臨床藥師負責一個心外科室;臨床藥師發現的不合理醫囑,當日由專人進行匯總并提交專家組討論,經專家組討論確定為不合理的醫囑進行公示及處罰。
1.3 住院患者抗菌藥物使用情況的分析
提取路徑式管理前和管理后抗菌藥物的使用數據,并分別計算各個時間段內抗菌藥物使用金額、抗菌藥物使用率、抗菌藥物用藥頻度(defined daily doses,DDDs)和抗菌藥物使用強度(antimicrobial use density,AUD)。DDDs=藥品消耗的總量/相應的限定日劑量(defined daily dose,DDD)。AUD=(DDDs/同期收治患者總人天數)×100。
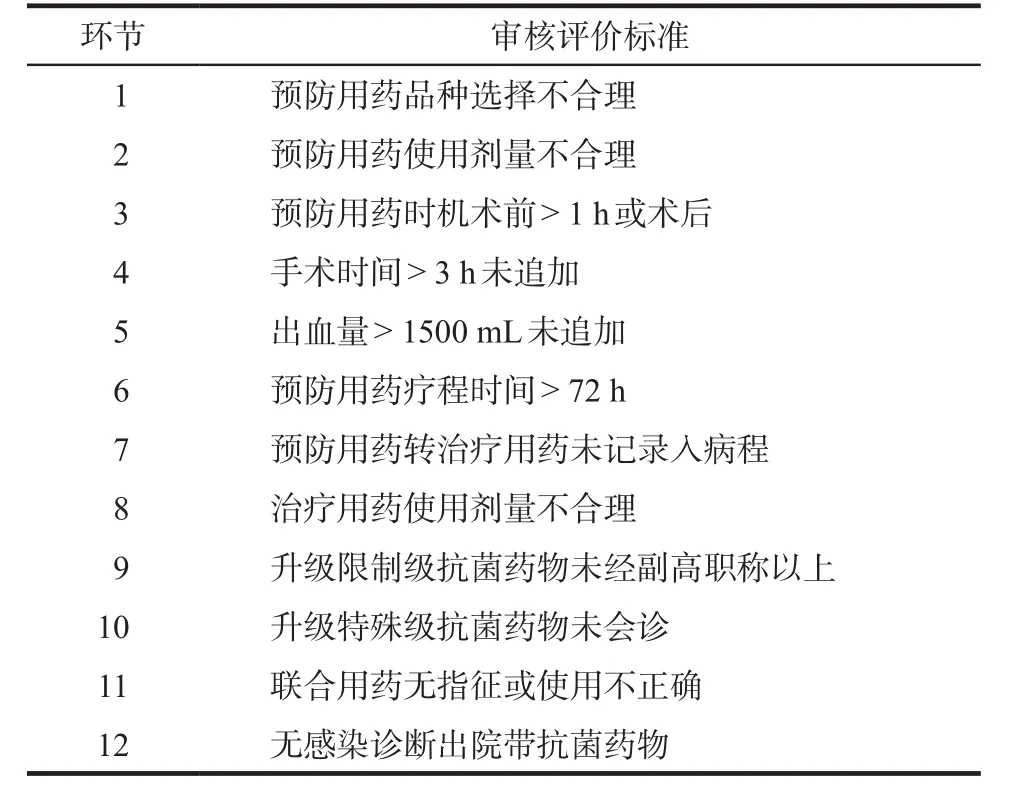
表1 Ⅰ類切口清潔手術預防用抗菌藥物合理性評價標準Tab 1 Evaluation criteria for rationality of prophylactic antibiotics for typeⅠ incision operation
1.4 術后切口感染判斷標準及術后感染率的比較
依據衛生部醫政司制定的診斷標準,凡切口局部紅、腫、熱、痛,筋膜組織以上有膿性滲出物,或拆線后局部有膿液滲出,無論有無細菌學證據,均屬切口感染[4-5]。在感染與否無法界定時按感染對待。本研究采用回顧性的方法,分別調查路徑式管理前后患者一般情況(性別、年齡、診斷等)、手術情況(手術名稱、手術時間、是否體外循環、體外循環時間、出血量等)、術后感染情況(感染部位、病原菌等)及預后。使用SPSS 19.0軟件進行統計學分析,計數資料采用χ2檢驗,P < 0.05為差異具有統計學意義。
2 結果
2.1 路徑式管理前后住院患者抗菌藥物使用強度的變化
路徑式管理前2016年12月和2017年11月的抗菌藥物使用強度分別為85.62和80.14,路徑式管理后2017年12月的抗菌藥物使用強度為56.85,與2016年12月相比同比下降33.60%(28.77/85.62),與2017年11月相比環比下降29.06%(23.29/80.14),詳見表2。
2.2 路徑式管理前后住院患者抗菌藥物用藥頻度的變化
路徑式管理前2016年12月和2017年11月的抗菌藥物用藥頻度分別為10 680和9721,路徑式管理后2017年12月的用藥頻度為6355,與2016年12月相比同比下降40.49%(4325/10 680),與2017年11月相比環比下降34.62%(3366/9721),詳見表2。
2.3 路徑式管理前后住院患者抗菌藥物使用金額的變化
路徑式管理前2016年12月和2017年11月的抗菌藥物使用金額分別為281.30萬元和201.22萬元,路徑式管理后2017年12月的使用金額減少為95.58萬元,與2016年12月相比同比下降66.02%(185.72/281.30),與2017年11月相比環比下降52.49%(105.64/201.22),詳見表2。
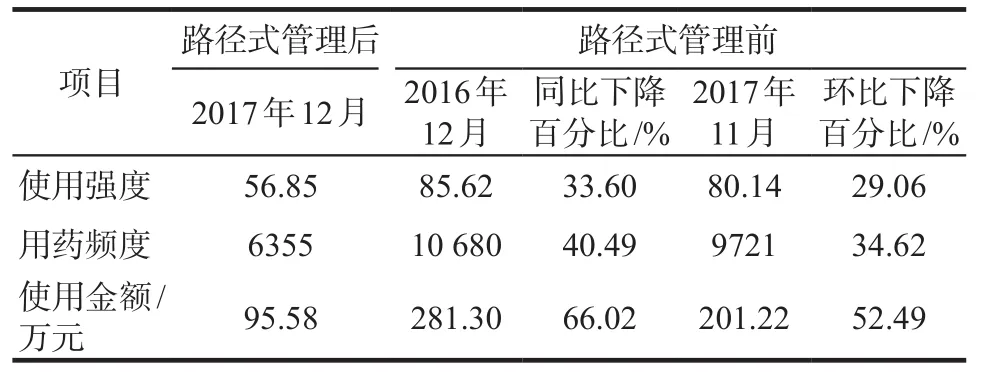
表2 管理前后抗菌藥物使用強度、用藥頻度及使用金額的變化情況Tab 2 Effects of the path special management on AUD, DDDs and consumption fee of antimicrobials
2.4 路徑式管理前后心外科住院患者常用抗菌藥物品種的變化
路徑式管理前(2016年12月)DDDs排名前10位的抗菌藥物見表3,除注射用頭孢呋辛鈉的DDDs升高,其他9種藥品的DDDs均有所下降,其中注射用頭孢噻肟舒巴坦、注射用頭孢米諾、注射用頭孢哌酮舒巴坦鈉、注射用頭孢噻利、注射用磺芐西林鈉,到2017年12月用藥頻度大幅下降,降幅分別為80.0%、96.0%、36.0%、92.0%、99.8%。路徑式管理后(2017年12月),注射用頭孢呋辛鈉作為主要的手術預防用藥,用藥頻度由2016年12月的921升高到3725,升高304%,增加4倍,排在第1位。
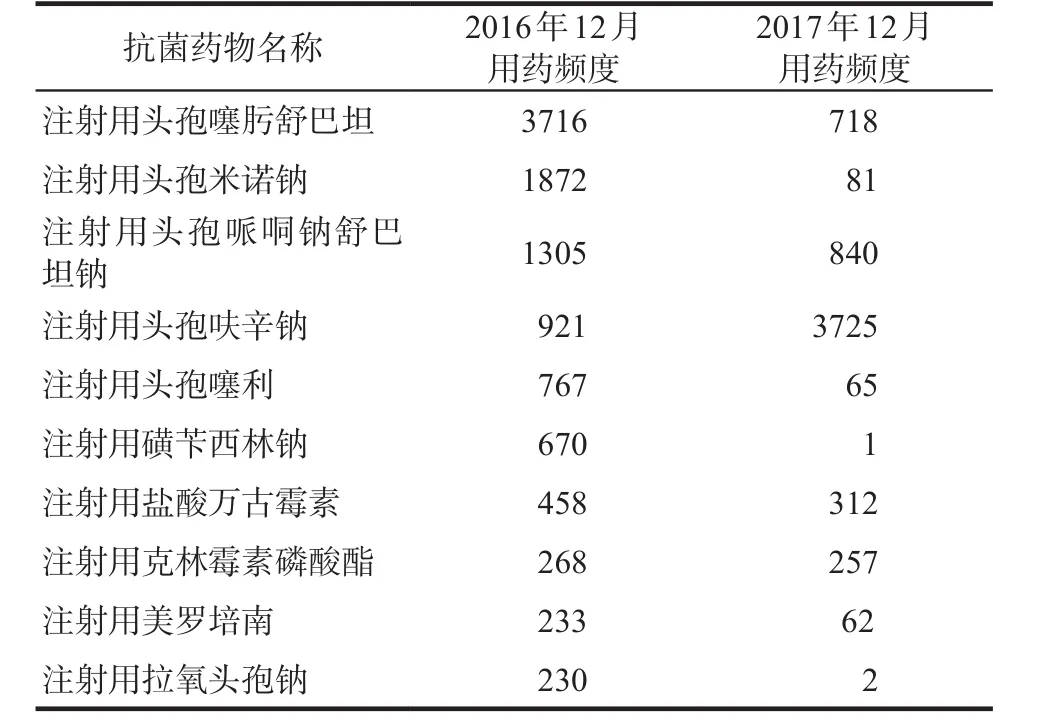
表3 路徑式管理前用藥頻度排名前十位抗菌藥物Tab 3 The top 10 antimicrobial agents in DDDs before the path special management
2.5 路徑式管理前后術后感染率的比較
2016年12月1日- 2017年1月15日期間選取7個病房中某病房進行手術的患者共137例,排除接受心臟移植的患者3例和因感染性心內膜炎進行手術的患者1例,路徑式管理前組共納入患者133例。2017年12月1日- 2018年1月15日期間該病房進行手術的患者共148例,排除接受心臟移植的患者4例和因感染性心內膜炎進行手術的患者6例,路徑式管理后組共納入患者138例。
路徑式管理前組133例患者中,6例患者術后發生感染,其中3例患者發生多部位感染,感染例數為10例,感染率為7.52%。路徑式管理后組138例患者中,5例患者術后發生感染,其中2例患者發生多部位感染,感染例數為7例,感染率為5.07%。具體到感染部位,路徑式管理前后兩組發生肺部感染的例數分別為4例和3例,感染率分別為3.01%和2.17%;發生傷口感染的例數均為2例,感染率分別為1.50%和1.45%;發生血流感染的例數均為2例,感染率分別為1.50%和1.45%。此外,路徑式管理前組發生感染性心內膜炎和胸骨感染1例,感染率為0.75%,路徑式管理后組無感染性心內膜炎和胸骨感染發生。路徑式管理前后兩組總的感染率及各部位的感染率均無統計學差異(P > 0.05)。

表4 路徑式管理前后術后感染情況Tab 4 The postoperative infection rates before and after the path special management
3 討論
本研究對我院多部門聯合出臺的心臟外科Ⅰ類切口手術預防用抗菌藥物路徑式管理前后心臟外科病房的住院患者抗菌藥物使用強度、使用金額、用藥頻度、常用抗菌藥物品種和術后感染率的變化進行比較,結果顯示,通過心臟外科Ⅰ類切口手術預防用抗菌藥物路徑式管理一系列行政干預和藥學干預措施實施后,預防用抗菌藥物的合理性得到了顯著提高,抗菌藥物選擇品種趨于合理,住院患者抗菌藥物使用強度、使用金額和用藥頻度均大幅下降,表明抗菌藥物的消耗量顯著降低,這主要是源于路徑式管理后預防用藥療程的縮短,其次不必要的聯合用藥和不合理的用法用量的改善對于抗菌藥物消耗量的降低也有所幫助。
3.1 預防用抗菌藥物品種選擇
路徑式管理前后我院心臟外科病房住院患者常用抗菌藥物品種發生了較大變化。心臟外科手術部位感染的主要致病菌是革蘭陽性菌,包括金黃色葡萄球菌和凝固酶陰性葡萄球菌,預防用藥首選第一、二代頭孢菌素[6]。對β-內酰胺類抗生素過敏的患者,可選用萬古霉素或克林霉素。對于已知耐甲氧西林金黃色葡萄球菌定植患者,應使用萬古霉素。統計數據顯示,管理前用藥頻度排名前三位的抗菌藥物分別是注射用頭孢噻肟舒巴坦、注射用頭孢米諾鈉和注射用頭孢哌酮鈉舒巴坦鈉,均為廣譜抗菌藥物,均對革蘭陽性球菌活性比第一、二代頭孢菌素類藥物弱,廣泛用于手術預防用藥可能會導致耐藥菌株的產生,其中注射用頭孢米諾鈉為頭霉素類藥物,對厭氧菌和革蘭陰性桿菌有較強活性,以上均不宜用于心臟手術部位感染的預防。排名靠前的四代頭孢藥物頭孢噻利亦為廣譜抗菌藥物,以及磺芐西林作為對銅綠假單胞菌有活性的青霉素類藥物,主要用于懷疑有銅綠假單胞菌感染時,用于心臟手術預防用藥也是不合理的。路徑式管理后,以上五種藥物的用藥頻度分別降低80.0%、96.0%、36.0%、92.0%、99.8%。第二代頭孢菌素注射用頭孢呋辛鈉是路徑式管理后預防用藥最主要的品種,其用藥頻度與去年同期相比增加4倍,為主要的手術預防用藥,預防用藥品種趨于合理。
3.2 預防用抗菌藥物療程
心臟外科手術預防用抗菌藥物療程,是一個具有較大爭議的話題,感染率的降低需要與抗菌藥物帶來的潛在風險如耐藥菌株的產生和繼發感染等進行權衡。各指南的推薦意見也有一定差異(從術前單劑量到術后48 h)。我國的《抗菌藥物臨床應用指導原則(2015年版)》規定,清潔手術的預防用藥時間不超過24 h,心臟手術可視情況延長至48 h[7]。然而,由于心臟外科醫師對術后并發感染的擔心,包括我國在內的許多國家心臟外科預防用藥療程均偏長[8],有專家認為,心臟外科手術后,抗菌藥物必須進入手術操作所留下的縫線和人工植入物與其密切結合的纖維組織中,方能起到預防感染的作用,而這些纖維組織在術后數日內才能形成,因此術后抗菌藥物要應用約1周[9-10]。一項關于澳大利亞心臟外科手術預防性抗菌藥物使用情況的調查顯示,僅有10%左右醫院在預防用藥療程方面符合《澳大利亞抗生素治療指南》[11]。Kendall等[12]調查了英國36個成人心臟外科中心感染控制方法,結果顯示17%中心預防用藥療程超過48 h,通常心臟瓣膜手術用藥持續時間較長。國外學者Paul等[13]的研究表明,延長給藥時間并未使深部切口感染的發生率明顯降低。國內的研究顯示,規范化的短程用藥方案,在預防手術感染部位上與長期用藥方案無顯著差異[14]。在此次管理實施過程中,心臟外科病房對部分感染風險較低的患者做到了術后24 h停藥,除非患者的癥狀、體征或者輔助檢查提示感染性改變,或部分感染風險較高的瓣膜手術患者用藥時間超過72 h。通過管理,心外科醫生反映許多觀念已改變,之前預防用藥療程結束后不敢停藥,擔心患者感染,但發現規范停藥后,患者更安全。
3.3 術后感染率
本研究結果顯示,路徑式管理后,一方面抗菌藥物的使用量顯著下降,另一方面,術后感染率較管理前并未增加。諸多研究表明,預防性抗菌藥物的使用可以顯著降低心臟外科手術部位感染的發生率。預防的有效性受到多種因素的影響。首先是預防用藥品種的選擇,頭孢菌素類藥物是目前研究最多證據最為充分的心臟外科手術預防用藥品種,第一代頭孢菌素(頭孢唑啉)、第二代頭孢菌素(頭孢孟多和頭孢呋辛)以及第三代頭孢菌素(頭孢噻肟)在減少心臟外科手術部位感染方面療效相當[15]。其次,確保整個手術期間具有足夠的抗菌藥物血清和組織濃度非常重要。這就需要在皮膚黏膜切開前30 ~ 60 min內或麻醉開始時給藥,在輸注完畢后開始手術,研究顯示過早或過晚給予預防用藥均會降低預防的有效性,增加感染的風險[16-17]。此外,如果手術時間超3 h或超過所用藥物半衰期2倍以上,或成人出血量超過1500 mL,術中應補充一個劑量,必要時可追加第三劑。通過路徑式管理,麻醉科醫生對預防用藥起始時間,需要追加藥物的時間點高度關注,患者安全有了整體提升。本次管理對于預防用藥的品種、劑量、給藥時機、追加情況均進行了規范,從而保證了預防的有效性。
3.4 規范應用抗菌藥物可顯著減輕患者的經濟負擔
國內外的研究[13-14]均證明,短程單藥抗菌藥物預防心血管外科術后感染的效果與長程的抗菌藥物應用相比并無差異,本研究也印證了相似的觀點。另外,本研究還證實,選用價格相對低廉的第一、二代頭孢菌素預防術后感染的效果,不劣于價格較為昂貴的抗菌藥物。且短程用藥和選用價格低廉的藥物可使患者的抗菌藥物費用明顯減少,同時減輕患者的經濟負擔,本研究抗菌藥物的使用金額大幅降低,節約了有限的醫藥資源,從長遠來看,其社會經濟學價值也是顯而易見的。
綜上所述,我院的心臟外科Ⅰ類切口手術預防用抗菌藥物路徑式管理規范了圍手術期抗菌藥物的使用,降低了抗菌藥物的消耗量,管理前后患者感染率無明顯差異。初步證實,規范、合理地預防用抗菌藥物,可有效預防心血管外科手術術后感染、降低抗菌藥物治療費用。今后應進一步加大合理使用抗菌藥物宣教力度,提升臨床藥師藥學服務水平,徹底改變醫師過度依賴抗菌藥物的觀念,提高醫師合理用藥意識,加大職能部門干預力度,建立督導長效機制,將抗菌藥物的合理使用作為一項常規管理工作,促使抗菌藥物的使用更趨于安全、合理、有效。

