晉汾白豬和新山西黑豬TAP1基因多態性和組織表達譜研究
孫奴奴,李步高,曹果清,趙 銀,徐 濤
(1.運城學院生命科學系,山西 運城 044000;2. 山西農業大學動物科技學院,山西 晉中 030801)
抗原處理相關轉運體(TAP)是由TAP1和TAP2兩種分子組成的異二聚體結構,屬于ABC轉運體超家族的B族,通常分布于內質網和高爾基體膜上[1],它的主要作用是把肽類在細胞內經過蛋白酶體一系列降解反應之后,產生的片段輸入到內質網中,然后和MHC I類物質聚合,最終引起T細胞的特異性反應[2]。編碼TAP的基因位于MHCⅡ類區域,有遺傳多態性[3]。鑒于其在抗原遞呈中所起的重要作用,使它成為某些免疫性疾病易感基因的主要候選者,TAP的異常將嚴重影響抗原遞呈,成為病毒感染及腫瘤細胞逃避免疫監視的重要機制,如卵巢癌、肝癌及宮頸癌[4]。TAP的表達可以被某些細胞因子(如IFN-γ,IFN-α,TNF-α)和脂多糖等誘導[5],TAP表達上調與MHCⅠ類分子遞呈和CTL殺傷功能的增強密切相關,因此人們也越來越關注TAP基因表達的調控。
近年來,TAP1基因在長白、大白、杜洛克和皮特蘭等國外豬種[6-7]以及梅山豬、霍壽黑豬、皖南黑豬、安慶六白豬、浦東白豬和蘇太豬等國內地方豬種[8-11]的研究已經取得了一定進展,研究表明TAP1基因多態性在國內外豬種的基因型分布有一定差異,TAP1基因不同基因型對斷奶仔豬F18大腸桿菌的抗性不同,TAP1基因在免疫組織和腸道組織的表達量較高,特別是在受到藍耳病毒、模擬病毒及大腸桿菌感染后[12-13],TAP1基因的表達量顯著升高,因此將TAP1基因作為豬抗病育種的有效遺傳標記之一。晉汾白豬是以馬身豬、太湖豬、長白豬及大白豬為親本經歷6個世代20年于2012年培育成的瘦肉型豬新品種[14]。新山西黑豬是以馬身豬、內江豬、巴克夏豬和國外豬種為親本經歷10年培育的抗病力好、適應性強、肉質鮮美及養殖效益高的培育品種[15]。本研究通過PCR-RFP的方法研究了TAP1基因BSP143I多態位點在晉汾白豬和新山西黑豬的基因型分布,并利用RT-PCR方法檢測了TAP1基因在晉汾白豬和新山西黑豬在免疫系統、消化系統、呼吸系統、神經系統、泌尿生殖系統等18個組織的表達譜,為下一步研究TAP1基因作為抗病育種遺傳標記在晉汾白豬和新山西黑豬的有效利用提供基本素材。
1 材料與方法
1.1 實驗動物與材料
采集來自山西省運城市新龍豐畜牧有限公司健康的晉汾白豬159頭和新山西黑豬57頭的耳組織置于75 %乙醇溶液中,-20 ℃保存備用;分別采集斷奶仔豬晉汾白豬和新山西黑豬的18種組織(心、肝、脾、肺、巨噬細胞、白細胞、腎、淋巴結、子宮、胃、卵巢、皮膚、肌肉、脂肪、大腦、小腦、支氣管、盲腸),液氮速凍并迅速轉移至-80 ℃冰箱。
2×Taq PCR Master Mix,DNA Marker,RNA提取試劑盒,反轉錄試劑盒購自北京華越洋生物科技有限公司。
1.2 DNA、RNA提取及cDNA合成
采用酚/氯仿/異戊醇法抽提耳組織DNA,于-20 ℃保存備用;利用Trizol法提取豬各組織總RNA,用1.5 %瓊脂糖凝膠電泳檢測RNA的完整性,并用ND2000檢測RNA的純度及濃度,于-80 ℃保存備用。cDNA合成:20 μL的反應體系中含dNTP Mix (2.5mM each)4 μL,Primer Mix 2 μL,5-RT Buffer 4 μL,DTT(0.1M),HiFiScript(200 U/μL) 1 μL,Total RNA 300 ng,RNase free ddH2O補足至20 μL。反應條件為42 ℃ 30 min,85 ℃ 5 min。合成的cDNA保存于-20 ℃備用。
1.3 引物的設計與合成
利用primer 5.0軟件,參考GeneBank序列BX323833設計引物,本實驗引物是由英濰捷基(上海)貿易有限公司合成,序列如表1所示。

表1 引物序列及相關信息
1.4 PCR-RFLP分析
PCR擴增反應體系:采用10μL反應體系,即模板DNA 0.5 μL,上下游引物各0.2 μL (10 μmol/L),2×Taq PCR Master Mix 5 μL,補ddH2O至總反應體系為10 μL。PCR反應條件:94 ℃預變性3 min;94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸45 s,共30個循環;72 ℃終延伸5 min;PCR產物經1.5 %瓊脂糖凝膠電泳檢測,有目的條帶的PCR產物經BSP143I內切酶37℃消化4 h,酶切產物經2 %瓊脂糖凝膠電泳檢測,拍照分型。
1.5 RT-PCR
以不同組織cDNA為模板,分別PCR擴增TAP1基因和ACTB基因。采用10 μL反應體系,即cDNA 0.5 μL,上下游引物各0.2 μL(10 μmol/L),2×Taq PCR Master Mix 5 μL,補ddH2O至總反應體系為10 μL。PCR反應條件為:94 ℃預變性3 min;94 ℃變性30 s,退火溫度60 ℃,退火時間30 s,72 ℃延伸30 s,共35個循環;72 ℃終延伸5 min;PCR產物經2 %瓊脂糖凝膠電泳檢測并拍照保存。
1.6 統計分析
基因分型結果利用popgene 32軟件進行群體遺傳學分析,利用SAS8.1軟件進行卡方檢驗。
2 結果與分析
2.1 PCR引物的擴增效果檢測
以豬基因組DNA為模版,進行PCR反應,經1.5%的瓊脂糖凝膠電泳檢測,得到790bp左右的單一條帶,無雜帶污染,結果見圖1。
2.2 PCR-RFLP分析結果
PCR產物經過酶Bsp143I消化后,經過瓊脂糖凝膠電泳檢測,晉汾白豬產生3種條帶,分別為AA(790bp)、AG(651 bp/139 bp,790 bp)和GG( 651 bp/139 bp)型,結果見圖2;新山西黑豬產生2種帶型,分別為AG(651 bp/139 bp,790 bp)和GG( 651 bp/139 bp)型,結果見圖3。
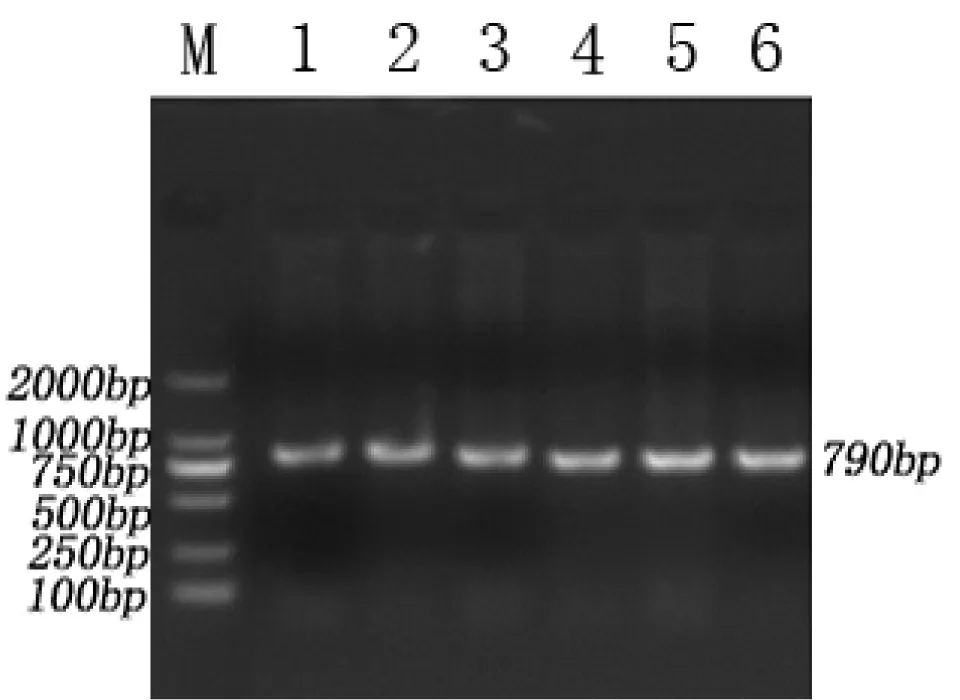
圖1 晉汾白豬和新山西黑豬PCR產物電泳結果
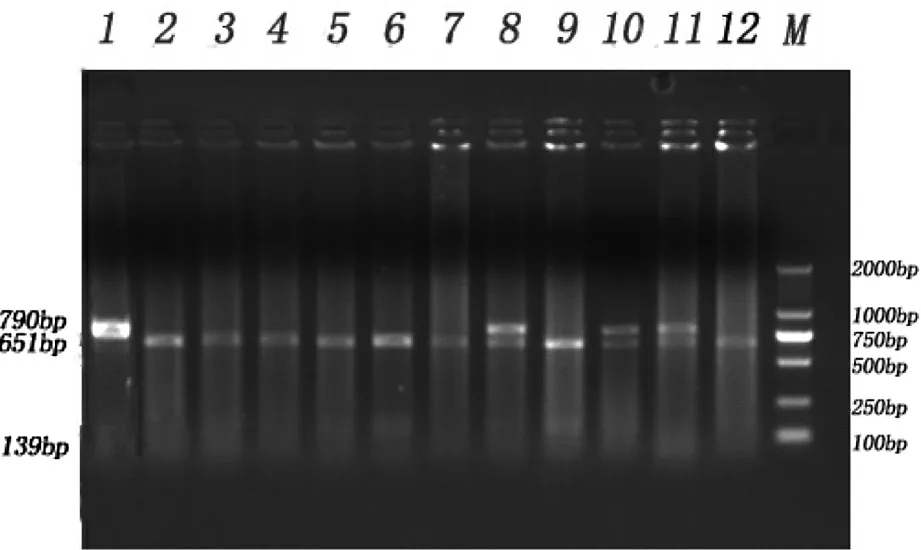
圖2 晉汾白豬PCR-RFLP電泳結果
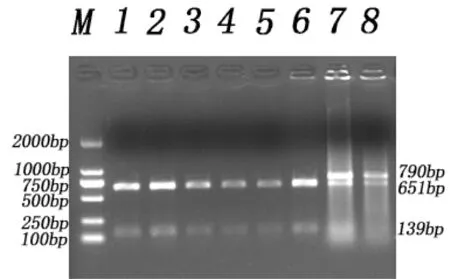
圖3 新山西黑豬PCR-RFLP電泳結果
2.3 不同豬種中TAP1基因第3外顯子基因型及其等位基因頻率分析
基因型分型結果利用PopGen32軟件進行分析,分析結果如表2顯示,晉汾白豬中共檢測出A、G 兩種等位基因和AA、AG、GG 3種基因型,新山西黑豬檢測出A、G 兩種等位基因和AG、GG兩種基因型。卡方適合性檢驗結果表明,晉汾白豬和新山西黑豬在TAP1基因Bsp143I酶切位點基因型符合Hardy-Weinberg平衡狀態(P>0.05)。

2.4 不同豬種TAP1基因外顯子3的遺傳特性分析
對晉汾白豬和新山西黑豬中所檢測到的TAP1基因的多態位點進行群體遺傳學統計分析,如表3所示,晉汾白豬雜合度和香農指數較高,分別為0.3459,0.4797;新山西黑豬雜合度和香農指數較低,分別為0.1228,0.2308,因此晉汾白豬和新山西黑豬表現具有一定的多態性。晉汾白豬 GG基因型數最多,其基因型頻率也最大,AA基因型數最少,晉汾白豬是G等位基因占優勢;新山西黑豬GG基因型數也最多,其基因型頻率同樣也最大,AA基因型數沒有檢測到,可能群體數還不夠大,新山西黑豬是G等位基因占優勢。

表3 晉汾白豬和山西黑豬PCR-RFLP的雜合度、純合度和香農指數
2.5 不同豬種基因型分布差異性分析
對晉汾白豬和新山西黑豬中所檢測到的TAP1基因的多態位點運用SAS8.1統計軟件進行基因型分布的比較分析,檢測結果表明,晉汾白豬和新山西黑豬TAP1基因的多態位點的基因型分布差異極顯著(χ2=182.8165,P<0.01)。

表4 TAP1基因在晉汾白豬和新山西黑豬中的基因型分布差異性檢測
2.6 TAP1在豬不同組織表達的RT-PCR電泳檢測結果
以總RNA反轉錄的cDNA為模板,分別以TAP1和內參基因ACTB為引物進行PCR擴增,PCR產物經2%的瓊脂糖凝膠電泳檢測,結果見圖4、圖5。
TAP1基因在晉汾白豬的18個組織均有表達,其中在心、肝、脾、腎、胃、卵巢、皮膚、肌肉、脂肪、大腦、小腦、支氣管、盲腸表達量較高,在肺、肺泡巨噬細胞、白細胞、淋巴結、子宮表達量較低;在新山西黑豬的18個組織均有表達,而且表達量均較高。
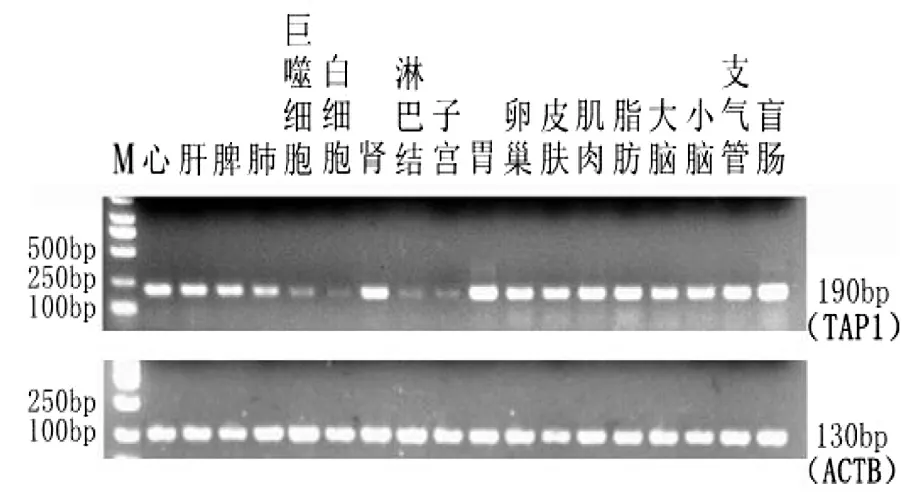
圖4 TAP1,ACTB在晉汾白豬不同組織

圖5 TAP1,ACTB在新山西黑豬不同組織表達的RT-PCR電泳結果
3 討論
不同動物個體疾病抗性的差異是可以遺傳的,抗性基因的單核苷酸突變在一定程度上與動物對疾病的抗性/易感相關,TAP1基因位于SLAⅡ類基因組區域內,編碼的蛋白負責抗原的加工遞呈。本實驗通過PCR-RFLP方法,在159頭晉汾白豬中檢測到3種基因型(AA、AG、GG),在57頭新山西黑豬中檢測到2種基因型(AG、GG),發現GG基因型是晉汾白豬和新山西黑豬的優勢基因型,G為優勢等位基因,并且均符合Hardy-Weinberg平衡,說明TAP1基因在晉汾白豬和新山西黑豬中基本是處于一個自由交配(Hardy-Weinberg平衡)的狀態,也就是群體的選育對TAP1基因沒有造成影響,對現在的選育性狀沒有作用。這與先前在長白、大白、杜洛克、皮特蘭和圣特西的研究結果一致[6-7,12],而在霍壽黑豬、皖南黑豬、安慶六白豬、蘇太豬、浦東白豬和梅山豬等地方豬種的研究發現TAP1基因偏離了Hardy-Weinberg平衡[7-10]。雜合度是衡量群體遺傳變異大小的參數,雜合度越低,群體的遺傳一致性越高;香農指數是衡量群體間分化水平的量度,是隨機交配群體在雜交選育過程中受到遺傳漂變、自然選擇和變異的綜合影響的度量[7]。本研究發現晉汾白豬的雜合度和香農指數高于新山西黑豬的香農指數,并且都高于長白豬的雜合度和香農指數[12],說明中國地方豬種的遺傳多態性比外來引進豬種的豐富[7]。運用SAS8.1統計軟件分析進行卡方檢驗,結果表明晉汾白豬和山西黑豬TAP1基因的多態位點的基因型分布差異性極顯著(P<0.01),一方面可能由于新山西黑豬沒有檢測到AA基因型造成的,另一方面新山西黑豬個體數較少,而且個體之間存在全同胞或半同胞的血緣關系。
TAP蛋白作為抗原肽的運輸載體,在抗原遞呈及免疫應答過程中起著關鍵的作用,因此TAP1基因的表達量會影響其抗原遞呈的功能,當TAP1基因表達量升高時會增強機體抵御細菌或病毒的能力,或者機體在受到病毒或細菌的攻擊時,機體血液或組織中的TAP1基因的mRNA水平會顯著升高[12-13]。本研究分析了TAP1基因在晉汾白豬和新山西黑豬(斷奶仔豬)各18個組織中的表達情況,結果顯示TAP1基因在晉汾白豬的肝、脾(免疫組織),胃、盲腸(消化組織),腎、卵巢(泌尿生殖組織),心、支氣管(循環呼吸組織),大腦、小腦(神經組織)以及皮膚、肌肉、脂肪的表達量均比較高;TAP1基因在新山西黑豬的免疫、消化、泌尿生殖、循環呼吸及神經組織等18個組織均有較高的表達。而先前我們發現成年梅山豬TAP1基因選擇性地在淋巴結、骨髓、肺、脂肪、皮膚、胃、腎、附睪、膀胱、子宮、卵巢表達[12],另有研究發現TAP1基因的表達在35日齡的斷奶豬比8、18日齡的未斷奶的肺、脾、淋巴結、十二指腸和空腸表達量高[16],一方面說明斷奶仔豬一般抗病力和機體免疫能力較弱,幾乎所有的組織都需要TAP1基因的高表達來抵御疾病的侵襲,成年豬對疾病的抵抗力加強,TAP1基因在呼吸、消化、泌尿生殖等組織選擇性地高表達;另一方面提示TAP1基因的高表達與抵御肺部、腸道、腎及子宮等部位的疾病有關。TAP1基因BSP143I多態位點的不同基因型也會影響組織的表達,zhao[11]等研究表明,GG基因型的個體在肝、肺、腎、胸腺、淋巴結、十二指腸和空腸的表達量比AG、AA基因型的個體高,wang[16]等研究發現TAP1基因在FUT1抗性型豬各免疫組織及腸道組織的表達均顯著高于敏感型豬。
4 結論
本實驗通過對晉汾白豬和新山西黑豬TAP1基因在DNA水平及mRNA水平的研究,初步了解了TAP1基因BSP143I多態位點在山西兩個地方豬種的基因型分布及雜合度、香農指數等群體遺傳學分析,以及斷奶仔豬18個組織的表達譜分析,為下一步TAP1基因作為抗病遺傳標記用于山西地方豬種的抗病育種研究提供了基本的理論素材和指導依據。

