肝細胞癌患者血清中SOX 1和VIM啟動子的甲基化檢測及其臨床意義
張良,周進學,肖騰#,向宏市
1鄭州頤和醫院普外科,鄭州450000
2河南省腫瘤醫院普外科,鄭州4500000
肝細胞癌(hepatocellular carcinoma,HCC)占原 發性肝癌的90%以上,是中國較常見的惡性腫瘤之一[1]。早期診斷是HCC治療的先決條件[2]。臨床上,HCC的檢測主要基于血清甲胎蛋白(α-fetoprotein,AFP)、病變活檢及各種成像技術。然而,這些HCC監測和診斷技術仍存在一些限制[3]。因此,新生物標志物的探究對于改善早期HCC的診斷具有十分重要的臨床意義。腫瘤患者血液中循環腫瘤細胞游離DNA(circulating tumor DNA,ctDNA)作為生物標志物,已廣泛用于預測風險、診斷疾病和預測預后。表觀遺傳學的改變在人類腫瘤的發生、進展中起著重要作用。腫瘤中最常見的表觀遺傳變化為基因啟動子區域中的異常DNA甲基化,可導致腫瘤抑制基因的沉默。相關研究證實,DNA甲基化改變可作為腫瘤的生物標志物用于早期檢測包括HCC在內的多種腫瘤。血清性別決定區域Y框蛋白1(sex-determining region Y-box protein 1,SOX1)和波形蛋白(vimentin,VⅠM)基因啟動子甲基化可能是卵巢癌和結直腸癌的潛在預測生物標志物,且已在HCC組織中檢測到SOX1基因和VIM基因的異常甲基化。然而,HCC患者血清中SOX1基因和VIM基因啟動子甲基化作用尚不清楚。因此,本研究對HCC患者血清SOX1基因和VIM基因啟動子甲基化狀態進行評估,以探究其作為生物標志物用于診斷HCC的潛在價值,現報道如下。
1 對象與方法
1.1 研究對象
選取2015年1月至2016年6月于鄭州頤和醫院和河南省腫瘤醫院確診的HCC患者60例作為研究組(HCC組)。所有HCC患者術前均未進行抗腫瘤等其他治療,且均經術后病理學檢查確診為HCC,血清乙型肝炎表面抗原(hepatitis B surface antigen,HbsAg)均呈陽性。其中男性36例,女性24例;年齡30~70歲,平均(49.29±13.71)歲;臨床分期根據《原發性肝癌的臨床診斷與分期標準》[4]:Ⅰ~Ⅱ期24例,Ⅲ~Ⅳ期36例;分化程度:高分化18例,中分化17例,低分化25例;無包膜侵犯32例,有包膜侵犯28例;伴轉移(包括肝門淋巴結轉移、肝外轉移)25例,不伴轉移35例;伴肝硬化41例,不伴肝硬化19例;術前檢測AFP≥20 μg/L記為陽性:陽性42例,陰性18例。選取同期于鄭州頤和醫院和河南省腫瘤醫院治療的乙型肝炎后肝硬化(liver cirrhosis,LC)患者50例(LC組)、慢性乙型病毒性肝炎(chronic viral hepatitis type B,CHB)患者50例(CHB組)作為疾病對照組,診斷均符合2015年版《慢性乙型肝炎防治指南》[5],排除乙型肝炎病毒/丙型肝炎病毒重疊感染和人類免疫缺陷病毒混合感染者。另外,選取同期于鄭州頤和醫院和河南省腫瘤醫院體檢的健康體檢者50例作為健康對照組(Control組),排除患其他肝臟疾病及其他重要軀體疾病的患者。4組研究對象的年齡、性別等基線資料比較,差異均無統計學意義(P>0.05),具有可比性(表1)。本研究經醫院倫理委員會批準通過,所有對象均對本研究知情同意并簽署知情同意書。

表1 4組對象的基線資料
1.2 方法
1.2.1 標本采集和DNA提取 采集所有患者治療前及健康體檢者的清晨空腹外周靜脈血8 ml,置于EDTA抗凝管中,3000 r/min離心10 min后,分離血清。采用血清游離DNA提取試劑盒,根據試劑盒說明書進行相關操作提取DNA,將血清DNA洗脫并于-20℃保存。
1.2.2 DNA亞硫酸鹽修飾 采用EpiTect Bisulfite Kit試劑盒,根據試劑盒說明書對DNA進行相關操作。取血清 DNA 2 μg 加入 4 mol/L NaOH,調整DNA終濃度為0.2 mol/L,于37℃變性10 min。加入30 mol/L NaHSO3,于50℃水浴16 h,經DNA純化試劑盒修飾后,于室溫下加入4 mol/L NaOH,調整DNA終濃度為0.3 mol/L,靜置20 min脫硫。加入1/10體積乙酸鈉和冰乙醇使DNA沉淀,干燥后加入TE(pH=8.0)溶解。將修飾的DNA作為甲基化特異性聚合酶鏈反應(methylmion specific polymerase chain reaction,MSP)模板,于-20℃儲存。
1.2.3 MSPMSP引物序列由上海生工生物工程有限公司合成(表2)。采用25 μl聚合酶鏈反應(polymerase chain reaction,PCR)反應體系:Premix Taq 12.5 μl,ddH2O 10.5 μl,正向引物和反向引物各0.5 μl、亞硫酸鹽修飾的DNA 1 μl。在ABⅠ7500型PCR儀上進行擴增,第一輪PCR反應條件:95℃預變性5 min;95℃變性30 s,58℃退火40 s,72℃引物延伸40 s,共進行40個循環;72℃延伸10 min。將第一輪PCR產物稀釋50倍后,取1 μl進行第二輪PCR反應,PCR反應條件:95℃預變性5 min;95℃變性30 s,65℃退火40 s,72℃引物延伸40 s,共進行40個循環;72℃延伸10 min,產物4℃保存。以人HCC細胞系(HepG2細胞,中科院上海細胞庫)DNA作為陽性對照(PC),以健康者外周血淋巴細胞DNA作為陰性對照(NC),以H2O代替DNA作為空白對照(Blank)。取7 μl PCR擴增產物于2%瓊脂糖凝膠上進行電泳,采用JS-3000凝膠成像系統分析儀采集圖像。

表2 甲基化特異性聚合酶鏈反應引物序列
1.3 判定標準
甲基化引物擴增出條帶,或者甲基化與非甲基化引物均擴增出條帶,則血清SOX1基因或VIM基因啟動子甲基化陽性;甲基化引物未擴增出條帶而非甲基化引物擴增出現條帶,則血清SOX1基因或VIM基因啟動子甲基化陰性。
1.4 統計學分析
采用SPSS 20.0-軟件對數據進行分析。計量資料以均數±標準差(x±s)表示,組間比較采用F檢驗或t檢驗;計數資料以率(%)表示,組間比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 血清中SOX 1、VIM基因啟動子甲基化檢測結果
4組對象的SOX1、VIM基因啟動子甲基化陽性率比較,差異均有統計學意義(P<0.01);其中HCC組患者的血清SOX1、VIM基因啟動子甲基化陽性率均高于LC組、CHB組和Control組,差異均有統計學意義(P<0.05);LC組和CHB組患者的血清SOX1、VIM基因啟動子甲基化陽性率均高于Control組,差異均有統計學意義(P<0.05);LC組患者的血清SOX1、VIM基因啟動子甲基化陽性率均高于CHB組,但差異均無統計學意義(P>0.05)。(表3)

表3 不同組別血清SOX 1、VIM基因啟動子甲基化陽性率的比較[ n(%)]
2.2 SOX 1、VIM基因啟動子甲基化狀態與HCC患者臨床特征的關系
不同包膜侵犯程度、分化程度、TNM分期、遠處轉移情況HCC患者的血清SOX1基因啟動子甲基化狀態比較,差異均有統計學意義(χ2=7.641,P=0.006;χ2=8.871,P=0.012;χ2=7.797,P=0.005;χ2=7.636,P=0.006);但不同年齡、性別、腫瘤直徑、AFP水平、肝硬化、門靜脈癌栓HCC患者的血清SOX1基因啟動子甲基化狀態比較,差異均無統計學意義(P>0.05)。不同分化程度、TNM分期、遠處轉移情況HCC患者的血清VIM基因啟動子甲基化狀態比較,差異均有統計學意義(χ2=12.967,P=0.002;χ2=5.926,P=0.015;χ2=10.080,P=0.001);但不同年齡、性別、腫瘤直徑、AFP水平、肝硬化、門靜脈癌栓、包膜侵犯程度HCC患者的血清VIM基因啟動子甲基化狀態比較,差異均無統計學意義(P>0.05)。(表 4)
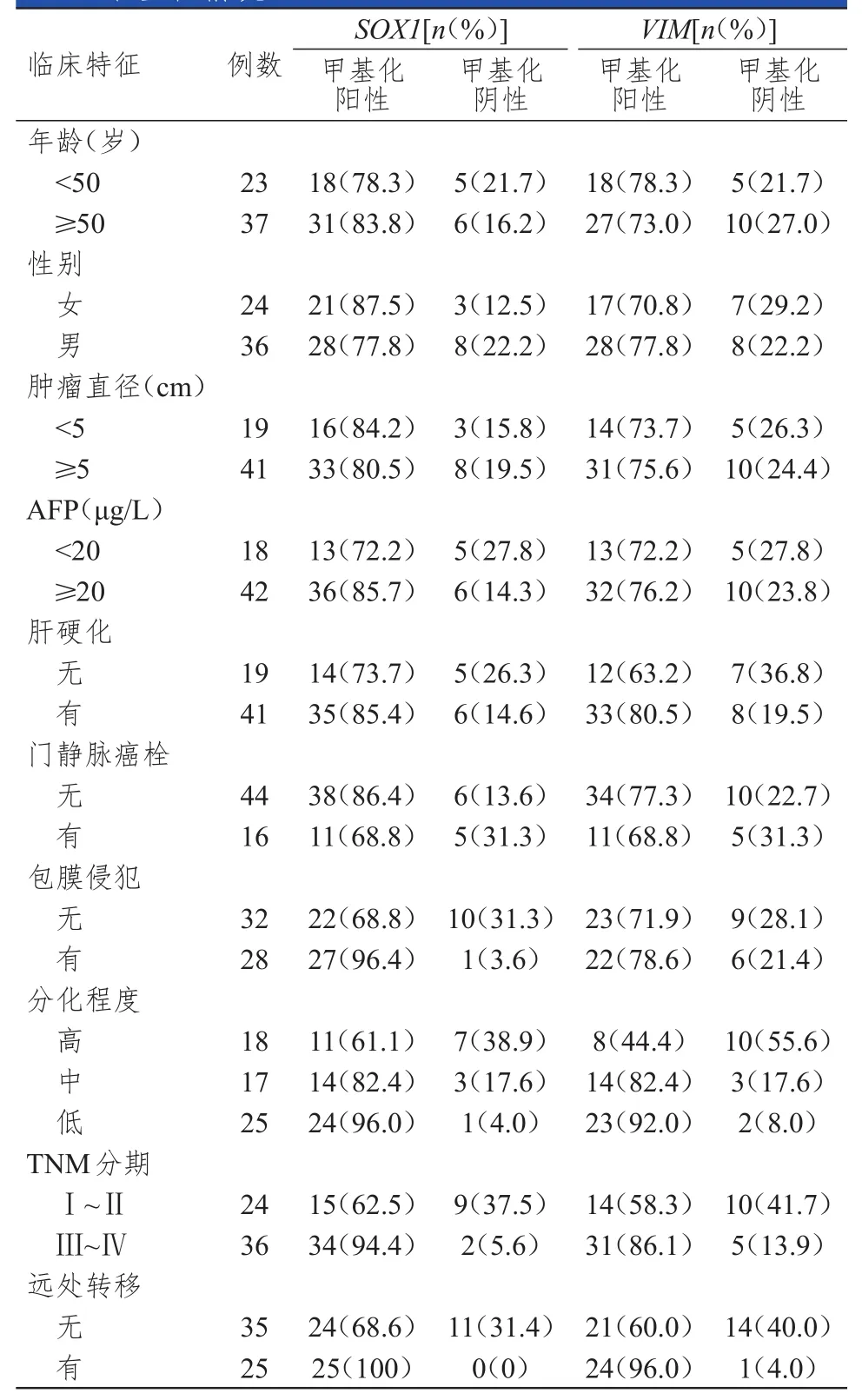
表4 不同臨床特征HCC患者血清SOX 1、VIM基因啟動子甲基化情況( n=60)
3 討論
腫瘤發生不同階段的CpG島異常高甲基化是導致腫瘤抑制基因(tumor suppressor gene,TSG)功能障礙的重要原因。基因啟動子的超甲基化可以是早期或晚期事件中HCC的標志物[6]。多種血清DNA的異常甲基化已被證實可作為評估HCC風險的生物標志物,如血清Ras相關區域家族1A(Ras association domain family 1A,RASSF1A)、谷胱甘肽S轉移酶P1(glutathione S-transferase P1,GSTP1)、活化蛋白C(activator protein C,APC)等[7-8]。既往研究已在HCC組織中檢測到SOX1和VⅠM的異常甲基化[9-10]。本研究證實,在HCC、LC、CHB患者血清中均可以檢測到SOX1基因和VIM基因啟動子甲基化。既往研究表明,慢性肝炎-肝硬化-HCC是一個持續發展的過程[11]。本研究中發現,HCC患者血清中SOX1基因和VIM基因啟動子甲基化陽性率高于LC患者和CHB患者,且而LC、CHB患者的血清SOX1基因和VIM基因啟動子甲基化陽性率高于Control組患者,這種趨勢可能對疾病的進展具有一定預測價值。
SOX1是SRY盒(SOX)蛋白家族成員之一,是編碼參與調控胚胎發育和細胞命運的決定性轉錄因子。研究發現,SOX1的組成型過表達可以抑制HCC細胞系的增殖、集落形成和侵襲能力,且SOX1敲減可以部分恢復這些功能,提示SOX1是HCC的重要腫瘤抑制因子[12]。另外,還有研究發現,SOX1的異位表達可以通過干擾Wnt/β-連環蛋白信號轉導而抑制HCC生長。已有研究證實,SOX1的異常甲基化與子宮頸癌和非小細胞肺癌相關[13-14]。另外有研究報道,在HCC組織中,SOX1表達下調與啟動子甲基化之間存在負相關[15]。VIM基因編碼波形蛋白,其在維持細胞形態、穩定細胞骨架等多種過程中起重要作用。VⅠM也參與細胞遷移和信號轉導。此外,既往研究表明,VⅠM參與上皮-間質轉化過程(EMT),而EMT是惡性腫瘤細胞侵襲和轉移的關鍵途徑。另外,研究發現,VIM基因啟動子異常甲基化與宮頸癌和胰腺癌密切相關[16-17]。
本研究評估血清SOX1基因和VIM基因啟動子甲基化是否與HCC患者的臨床特征有關。結果發現,SOX1基因和VIM基因啟動子甲基化均與HCC患者的腫瘤分化程度、TNM分期、腫瘤遠處轉移有關,提示SOX1基因和VIM基因啟動子甲基化功能與HCC進展密切相關,可能通過調控腫瘤細胞增殖、遷移和侵襲,從而參與HCC的臨床進展過程。另外本研究還發現,SOX1基因啟動子甲基化與HCC患者的包膜侵犯情況有關,推測SOX1基因啟動子甲基化可能影響其他相關基因的表達,從而導致HCC的臨床特征發生變化。以上結果表明,血清SOX1基因和VIM基因啟動子甲基化狀態可能是HCC進展的有效預測因子。
然而,由于本研究樣本量較少,且沒有量化HCC患者血清和組織中SOX1、VIMmRNA和蛋白表達水平,因此在后續研究中將進一步檢測HCC患者SOX1和VIM表達與啟動子甲基化之間的關系,以期為血清SOX1基因和VIM基因啟動子甲基化的臨床應用提供更充分的參考依據。
綜上所述,HCC患者血清中存在SOX1基因和VIM基因啟動子甲基化,SOX1基因啟動子甲基化與包膜侵犯程度、分化程度、TNM分期、遠處轉移有關,VIM基因啟動子甲基化與腫瘤分化程度、TNM分期、腫瘤遠處轉移等有關,可作為HCC分子診斷和病情進展的生物標志物。

