尿素微膠囊緩/控釋肥料制備工藝研究*
楊艷艷,韓月云,湯建偉,化全縣,劉 麗,劉 詠
(鄭州大學化工與能源學院,國家鈣鎂磷復合肥技術研究推廣中心,河南鄭州450001)
在中國農業生產中,尿素對提高作物產量和產品質量發揮著關鍵作用。但是尿素易溶于水,施用于土壤后40%~60%的尿素隨水土流失,不僅利用率低,也不利于環境保護[1-6]。采用緩控釋技術可以有效解決這類問題[7]。傳統緩釋肥是通過物理方法將聚烯烴、熱塑性樹脂以及聚氨酯等有機高分子包裹顆粒尿素表面,但此類包膜材料價格較高,難降解,進而對土壤造成危害。殼聚糖(Chitosan,CS)是一種來源廣泛的天然生物可降解聚合物,以其廉價性、無毒性和生物可降解性引起研究者的廣泛關注[8]。其分子內具有化學性質活潑的氨基與羥基,可以在溫和的反應條件下改變其化學性質[9]。因此,殼聚糖可以作為理想的天然緩釋載體廣泛用于生物醫學、制藥及農業領域[10-11]。 A.Rattanamanee 等[12]在蠶絲蛋白/明膠水凝膠中添加殼聚糖,通過溶劑揮發法制備緩釋尿素。L.Wu等[13]以四氯化碳和丙酮為溶劑,通過轉筒造粒法制備了雙層包膜尿素顆粒緩釋肥,其中殼聚糖為內層,聚丙烯酸高吸水性樹脂為外層。這些研究大部分采用物理方法將殼聚糖包裹尿素,難以達到控釋效果,且生產成本高。與傳統緩釋肥料制備方法相比較,采用微膠囊技術制備緩釋肥在降低成本、調控養分釋放速率方面有很大優勢[14-15]。鑒于上述原因,本研究初步探討采用天然高分子聚合物CS為尿素載體,通過反相乳化-化學交聯法制備了尿素微膠囊緩釋肥。實驗還分別考察了CS濃度、尿素用量、戊二醛用量、乳化劑用量、反應溫度以及攪拌速度對制備微膠囊的形態、載肥量以及包封率的影響。通過FT-IR和SEM表征其結構,并探究尿素微膠囊的緩釋性能。
1 實驗部分
1.1 試劑與儀器
試劑:殼聚糖、對二甲氨基苯甲醛尿素,國藥集團化學試劑有限公司提供;異丙醇、戊二醛、液體石蠟、Span-80、冰乙酸、石油醚,均為分析純,天津市科密歐化學試劑有限公司提供。
儀器:F25-ED型加熱制冷循環器、DT1000A型多管架自動平衡離心機、KQ-500DE型數控超聲波清洗器、TU-1901型雙光束紫外可見分光光度計。
1.2 實驗方法
通過反相乳化-化學交聯法制備尿素/CS緩釋微膠囊。將1 g CS加入體積分數為1%的醋酸水溶液中,60℃下攪拌溶解,靜置12 h后,稱取一定質量的尿素加入到已配制好的CS溶液中作為水相溶液待用。按照體積比3:1配制石蠟與石油醚混合溶液作為油相待用。將水相分散到油相中,并加入一定量的乳化劑Span-80,使尿素/CS水溶液在油相中形成穩定的W/O體系。以體積分數為50%的戊二醛為交聯固化劑,反應3 h后停止并靜置一定時間。離心抽濾,回收上層油相。先后分別使用石油醚和異丙醇洗滌,50℃下干燥24 h,得到微膠囊樣品。
1.3 結構表征與性能測試
1.3.1 SEM表征
采用JEM-5600LV型掃描電鏡對樣品做形貌分析。將樣品表面噴金處理,實驗工作電壓為20kV,觀察樣品的表面結構形態。
1.3.2 FT-IR表征
采用WQL-510型傅立葉變換紅外光譜儀對樣品做結構分析。以溴化鉀壓片法制備試樣,掃描波長為 400~4 000 cm-1,分辨率為 0.5 cm-1。
1.3.3 載肥量測定
配 制 質 量 濃 度 分 別 為 0.00、0.05、0.10、0.15、0.20、0.25 g/L的尿素標準溶液。加入顯色劑對二甲氨基苯甲醛,分別在波段420 nm處用紫外分光儀測定吸光度,并繪制標準曲線[16]。
稱取0.2 g微膠囊樣品經充分研磨后,樣品浸入蒸餾水中至尿素完全釋放后過濾。通過紫外分光光度法測定溶液中氮含量。載肥量與包封率按以下公式計算[17]:

式中:ULE為載肥量,%;UCE為包封率,%;m0為加入的尿素總量,g;mC為微膠囊中包封的尿素量,g;mT為微膠囊總質量,g。
1.3.4 微膠囊緩釋性能分析
精確稱取8份相同質量(0.1 g)的樣品,分別置于燒杯中,并分別加入等體積的蒸餾水50mL。在25℃恒溫水浴中分別靜置不同時間(4、8、12、24、36、48、60、72 h),移取上層清液并測定溶液中的尿素含量。尿素釋放率按下式計算:

式中:f為尿素釋放率,%;Mt為t時刻尿素釋放量,g;M∞為微膠囊中所含尿素總質量,g。
2 結果與討論
2.1 尿素用量對實驗結果的影響
由于尿素用量對載肥量和包封率有著直接影響,本實驗分別將不同質量的尿素加入CS溶液中,考察尿素用量對實驗結果的影響。稱取2 g CS溶于100 mL體積分數為1%的冰醋酸水溶液中,在Span-80和戊二醛體積分數均為3%、轉速為900 r/min、反應溫度為40℃的條件下制備微膠囊,結果見圖1。由圖1結果可以看出,在尿素用量為1~6 g時,隨著尿素用量的增加,尿素/CS微膠囊的載肥量增加。原因是當體系中尿素含量較低時,CS量過剩;隨著尿素量逐漸增加,更多的尿素包埋在CS中,因此載肥量也隨之增加。當尿素用量超過6 g并繼續增加時,載肥量和包封率逐漸降低。原因是尿素過量造成CS不能完全包裹體系中的尿素,導致形成的微膠囊不完整,載肥量也因此降低。
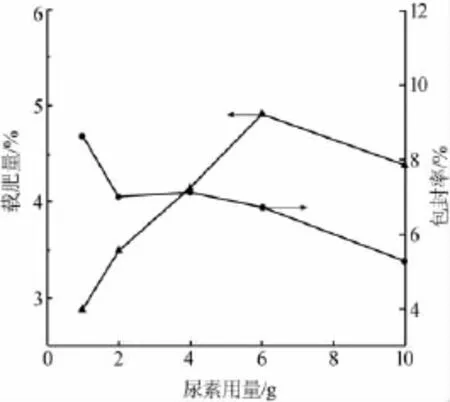
圖1 尿素用量對微膠囊載肥量和包封率的影響
2.2 交聯劑用量對實驗結果的影響
戊二醛含有2個醛基,能在溫和條件下與CS分子上的伯氨基和羥基發生反應,在微膠囊內部形成穩定的網絡結構。實驗分別加入體積分數為1%、2%、3%、4%、5%的戊二醛,其他因素保持不變,考察了交聯劑用量對實驗結果的影響,結果見圖2。由圖2可以看出,隨著交聯劑用量增加,載肥量和包封率相應降低,交聯劑達到一定量后,載肥量和包封率變化趨于平緩。原因是交聯劑的加入引起微膠囊內部自由體積減少,隨交聯劑用量增加,交聯點之間的分子距離減少,這將進一步降低微膠囊內部的自由體積,使得可以容納的尿素減少,載肥量和包封率降低[19]。此外在體積分數為2%~3%戊二醛用量的使用范圍內,CS的交聯點可能達到飽和,此時載肥量和包封率基本保持不變。

圖2 戊二醛用量對微膠囊載肥量和包封率的影響
2.3 反應溫度對實驗結果的影響
反應溫度會影響戊二醛和CS分子交聯反應程度,進而影響微囊的成型。本實驗在加入交聯劑后,其他因素保持不變,考察了反應溫度分別為30、40、50、60、70℃時對微膠囊載肥量和包封率的影響,結果見圖3。由圖3可以看出,在30~40℃時,隨著溫度升高,載肥量和包封率相應降低;當達到一定溫度后,載肥量和包封率變化趨于平緩,這與戊二醛用量對載肥量的影響呈現出類似的規律。這是因為當溫度升高時,會加劇交聯反應的進行,溫度越高,交聯程度越大;當溫度升至一定值時,交聯程度達到飽和,此時載肥量變化趨向平緩。

圖3 反應溫度對微膠囊載肥量和包封率的影響
2.4 攪拌速度對實驗結果的影響
實驗保持其他因素不變,考察了攪拌速度分別為 600、900、1 200、1 500 r/min 時對微膠囊的載肥量和包封率的影響,結果見圖4。由圖4可知,隨著轉速上升,微膠囊的載肥量和包封率都呈現出下降的趨勢。其原因是隨著攪拌速度提升,液滴均勻分散在油相中,乳化交聯后所形成的微膠囊粒徑也越來越小,使得微囊比表面積增大,囊壁變薄。此時的微囊在高剪切力作用下易破碎,造成包封率下降;同時如果壁材厚度較小,樣品離心抽濾時,膠囊也容易破裂,導致載肥量降低。
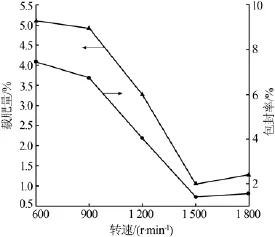
圖4 轉速對微膠囊載肥量和包封率的影響
2.5 正交試驗分析
根據單因素實驗的結果,本研究設計了4因素3水平的正交試驗,以綜合指標即載肥量和包封率的和為篩選指標。正交試驗結果見表1。從表1結果可知,影響因素的顯著次序由大到小為m(尿素)/m(CS)、反應溫度、轉速、戊二醛用量。微膠囊的最佳制備條件為 A3B3C1D1,即:m(尿素)/m(CS)=3、戊二醛用量為1.5%(體積分數)、反應溫度為30℃、轉速為600r/min。實驗隨后在最佳條件下制備出尿素微膠囊樣品,并對其做了FT-IR、SEM結構和形貌表征,以測定微膠囊的緩釋性能。

表1 正交試驗結果
2.6 FT-IR表征
圖5為2.5節最佳條件下制備的尿素微膠囊樣品、尿素以及CS原料的紅外光譜圖。由圖5可見,在尿素光譜圖中,3 342~3 455 cm-1處有 2個振動峰,應為尿素的特征峰,即N—H鍵的伸縮振動峰;1 608~1 685 cm-1處的尖銳峰為尿素中C=O雙鍵的伸縮振動特征峰;在微膠囊的光譜圖中,3 433 cm-1處的氨基伸縮振動吸收峰變窄效果明顯,特征峰強度減弱,將微膠囊光譜圖與CS光譜圖比較分析,可能是由于交聯劑戊二醛的加入,與CS交聯后形成Schiff堿的特征峰[20],削弱了 CS 在 1 651 cm-1處的酰胺峰強度,同時在1 623 cm-1處的吸收峰為C=N的伸縮振動峰。而微膠囊光譜圖中1 072 cm-1處的羥基變形振動吸收峰減弱,由此證明CS分子中的羥基也同樣與交聯劑中的醛基發生了交聯反應。尿素氨基特征峰吸收強度也減弱了。綜合比較3種物質的吸收譜圖可知,尿素應該被包埋于CS微膠囊之中。

圖 5 尿素(a)、微膠囊(b)和殼聚糖(c)紅外光譜圖
2.7 SEM表征
圖6為2.5節最佳條件下制備的微膠囊樣品的SEM形貌照片。由圖6可見,粒徑小于100 μm的微球應為未包裹尿素的空白CS微膠囊,部分微球形狀不規則,出現破損。而成球性良好,顆粒表面光滑且粒徑分布在100~130 μm之間的微膠囊應為尿素/殼聚糖微膠囊。這是因為CS包裹尿素后相應體積增加,從而導致粒徑增加。

圖6 CS微膠囊掃描電鏡照片
2.8 微膠囊緩釋性能分析
將2.5節最佳條件下制備的微膠囊樣品進行不同時間下尿素釋放性能的測試,檢測0~80 h內尿素的釋放情況,結果見圖7。由圖7可知,尿素釋放分為3個階段:初期階段(0~12 h),微膠囊中的尿素釋放比較快,尿素累積釋放率急劇增大,12 h之后釋放曲線變得平緩,這是由于微囊表層尿素分子快速溶解產生了突釋效果;第二階段(12~48 h),釋放速率主要由溶解擴散作用控制,由于微膠囊表面存在大量的孔隙,水分子可以通過它進入微膠囊的內部并溶解,CS吸水溶脹后成為凝膠態,在微膠囊表面形成凝膠保護層,微膠囊壁厚增加,致使大部分尿素截留在凝膠層中,只能通過擴散作用釋放出來,所以釋放曲線變得平緩;第三階段(48~72h),CS分子開始降解,微囊結構開始破壞,此時尿素的釋放由CS降解作用主導,尿素釋放速率增加,直至72h內完全釋放。
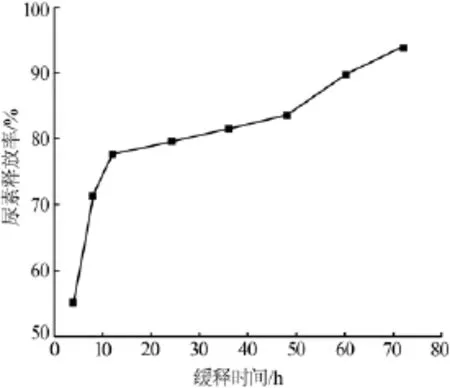
圖7 CS微膠囊中尿素釋放量隨時間的變化曲線
3 總結
1)在制備尿素/CS微膠囊過程中,隨著攪拌速度、交聯劑戊二醛用量和溫度的增加,尿素/CS微膠囊的載肥量呈現下降趨勢;而當尿素用量、CS濃度、乳化劑濃度增加時,載肥量和包封率均呈現先增后減趨勢。
2)通過單因素結果設計4因素5水平正交試驗,得到最優工藝條件:m(尿素)/m(CS)=3、戊二醛用量為1.5%(體積分數)、反應溫度為30℃、轉速為600 r/min。此條件下制備出的尿素微膠囊成球率高,圓整度好,顆粒表面光滑,粒徑分布在100~130 μm之間,載肥量達到11.26%,包封率為15.01%。
3)靜水實驗表明,尿素呈階段性釋放,且緩釋周期可以達到72 h。在緩釋肥領域,尿素/CS微膠囊尿素具有潛在的應用價值。

