苦參素對慢性腦缺血大鼠海馬CA1區神經元凋亡保護作用的研究*
余 婷,韓亞非
(1.邯鄲市中醫院內科,邯鄲 056001;2.邯鄲市中心醫院神經外四科,邯鄲 056001)
細胞凋亡是缺血性腦病神經元遲發性死亡的主要形式,是缺血性腦損傷的主要病理機制之一[1-2],而海馬區神經元是對腦組織缺血缺氧最為敏感的部位。苦參素是中藥苦參的主要有效成分之一,既往研究發現苦參素能夠通過抑制細胞凋亡而對心肌缺血、肝臟缺血起到一定的保護作用[3-4],本實驗制備慢性腦缺血大鼠模型并給予苦參素,探討苦參素通過抑制大腦海馬CA1區神經元凋亡而對慢性腦缺血損傷起到一定的保護作用及其可能的作用機制。
1 材料與方法
1.1 實驗動物 清潔級SD大鼠(雌雄不限)購自河北醫科大學實驗動物中心[SCXK(冀)2013-1-003],適應性飼養1周后進行實驗。
1.2 藥物與試劑 苦參素購自南京澤朗醫藥科技有限公司(批號:20170114);末端標記(TUNEL)試劑盒購自北京博奧森生物技術有限公司(批號:170324);半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)多克隆抗體、核因子-κB(NF-κB)多克隆抗體、B 淋巴細胞瘤-2(Bcl-2)多克隆抗體、Bcl-2 相關 X 蛋白(Bax)多克隆抗體和ABC-DAB試劑盒購自上海碧云天生物技術有限公司(批號:201701009、201703012、201703029、201702001、201704006);超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、丙二醛(MDA)試劑盒購自南京建成生物工程研究所(批號:20170309、20170413、20170114);白介素-1β(IL-1β)、白介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)試劑盒購自北京博奧森生物技術有限公司(批號:170129、170312、170116)。
1.3 實驗方法
1.3.1 動物分組與模型制備 取100只實驗用大鼠按照隨機數字表法隨機分為假手術組、模型組和苦參素低[25 mg/(kg·d)]、中[50 mg/(kg·d)]、高[100 mg/(kg·d)]劑量組,每組20只。采用結扎雙側頸總動脈制備慢性腦缺血大鼠模型,假手術組行手術操作但不結扎雙側頸總動脈。術后第2天開始腹腔注射給藥治療(每日1次),療程7 d[5]。
1.3.2 觀察大腦海馬CA1區神經元形態結構及凋亡狀況 每組隨機取10只大鼠,實施深度麻醉后斷頭取腦,去除嗅球、小腦和低位腦干,多聚甲醛溶液(濃度4%)固定3 d、石蠟包埋、切片、脫蠟水化,然后行常規蘇木精-伊紅(HE)染色后通過倒置光學顯微鏡觀察大腦海馬CA1區神經元形態(海馬CA1區范圍見圖1);行TUNEL染色后觀察海馬CA1區神經元凋亡狀況并計算凋亡指數(AI),AI(%)=(視野凋亡細胞數/視野細胞總數)×100%,每只取5張切片,每張切片取5個互不重疊的視野,取平均值。
圖1 大鼠大腦海馬組織結構圖Fig.1 Brain hippocampustissue structure of rats
1.3.3 檢測海馬區 Bcl-2、Bax蛋白表達 取 1.3.2制備的大鼠腦組織石蠟切片,脫蠟水化處理后,通過ABC-DAB法進行染色:乙醇梯度脫蠟水化、磷酸鹽緩沖液(PBS)洗滌、3%過氧化氫-甲醇溶液孵育25 min、PBS 洗滌、山羊血清封閉 1.5 h、滴加一抗4℃過夜、PBS洗滌、滴加二抗室溫孵育1.5 h、PBS洗滌、滴加辣根過氧化物酶標記的鏈霉卵白素室溫孵育1 h、PBS洗滌、DAB顯色5 min、充分水洗、梯度脫水、封片,然后通過倒置光學顯微鏡觀察并照相保存。每只大鼠取5張切片、每張圖片同一部位選取互不重疊的5個視野,采用Image Pro plus圖像分析系統測定圖片灰度并半定量分析海馬區Bcl-2、Bax蛋白表達。
1.3.4 檢測海馬組織 Caspase-3、NF-κB蛋白表達 取每組剩余的10只大鼠,實施麻醉后斷頭取腦并剝取海馬組織,研磨勻漿、經12 000 r/min低溫(4℃)離心20 min處理后取沉淀,行BCA蛋白定量、高溫蛋白變性,電泳;待溴酚藍接近膠底部時停止、轉膜、春紅溶液染色,室溫下5%脫脂奶粉封閉 2 h,一抗 Caspase-3、NF-κB、β-actin(1∶500)4 ℃過夜;洗膜,二抗(1∶100)37℃恒溫孵育 1 h后經ECL顯色。根據條帶灰度值半定量分析Caspase-3、NF-κB 蛋白表達。
1.3.5 檢測抗氧化酶活性和MDA含量 遵照試劑盒步驟處理后通過紫外-可見分光光度計測定抗氧化酶(SOD、CAT)活性和MDA含量。
1.3.6 檢測海馬組織炎癥細胞因子含量 遵照試劑盒操作處理后通過酶標儀測定海馬組織炎癥細胞因子(IL-1β、TNF-α、IL-6)含量。
1.4 統計學處理 運用軟件SPSS19.0進行統計分析,計量資料以均數±標準差(x±s)表示,多組間均數比較采用單因素方差分析,組間兩兩比較若方差齊采用LSD-t檢驗,若方差不齊采用Dunnett’s T3法,P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠大腦海馬CA1區神經元形態結構 假手術組大鼠海馬CA1區神經元層次清晰,排列整齊,形態完整,核膜、核仁清晰,形態結構未見異常;模型組大鼠海馬CA1區神經元呈現層次紊亂,排列稀疏、間隙增大、數量減少,胞體腫脹變形,胞核固縮或溶解等形態結構病理性改變;與模型組比較,苦參素各劑量組海馬CA1區神經元病理性形態結構改變呈不同程度改善,該效果以苦參素高劑量組最為顯著。結果見圖2。
2.2 各組大鼠海馬CA1區神經元凋亡狀況 假手術組大鼠大腦海馬CA1區僅見少量凋亡細胞;與假手術組比較,模型組大鼠海馬CA1區凋亡細胞數量顯著增多;與模型組比較,苦參素各劑量組大鼠海馬CA1區凋亡細胞數量呈不同程度減少,以苦參素高劑量組最為顯著,見圖3。與假手術組比較,模型組大鼠海馬CA1區神經元AI顯著升高(P<0.01),而與模型組比較,苦參素中、高劑量組AI顯著降低(P<0.01)。
2.3 各組大鼠海馬組織Bcl-2、Bax表達 與假手術組比較,模型組大鼠海馬組織Bcl-2表達明顯下調、灰度顯著降低(P<0.01),Bax表達顯著上調、灰度顯著升高(P<0.01);與模型組比較,苦參素各劑量組海馬組織Bcl-2表達上調、Bax表達下調,苦參素對Bcl-2、Bax表達的影響呈一定劑量依賴性,調控效果以苦參素高劑量組最為顯著;與模型組比較,苦參素中、高劑量組Bcl-2表達灰度值顯著升高(P<0.05 或 P<0.01)、Bax表達灰度值顯著降低(P<0.01),Bcl-2/Bax比值顯著升高(P<0.01)。見表1。
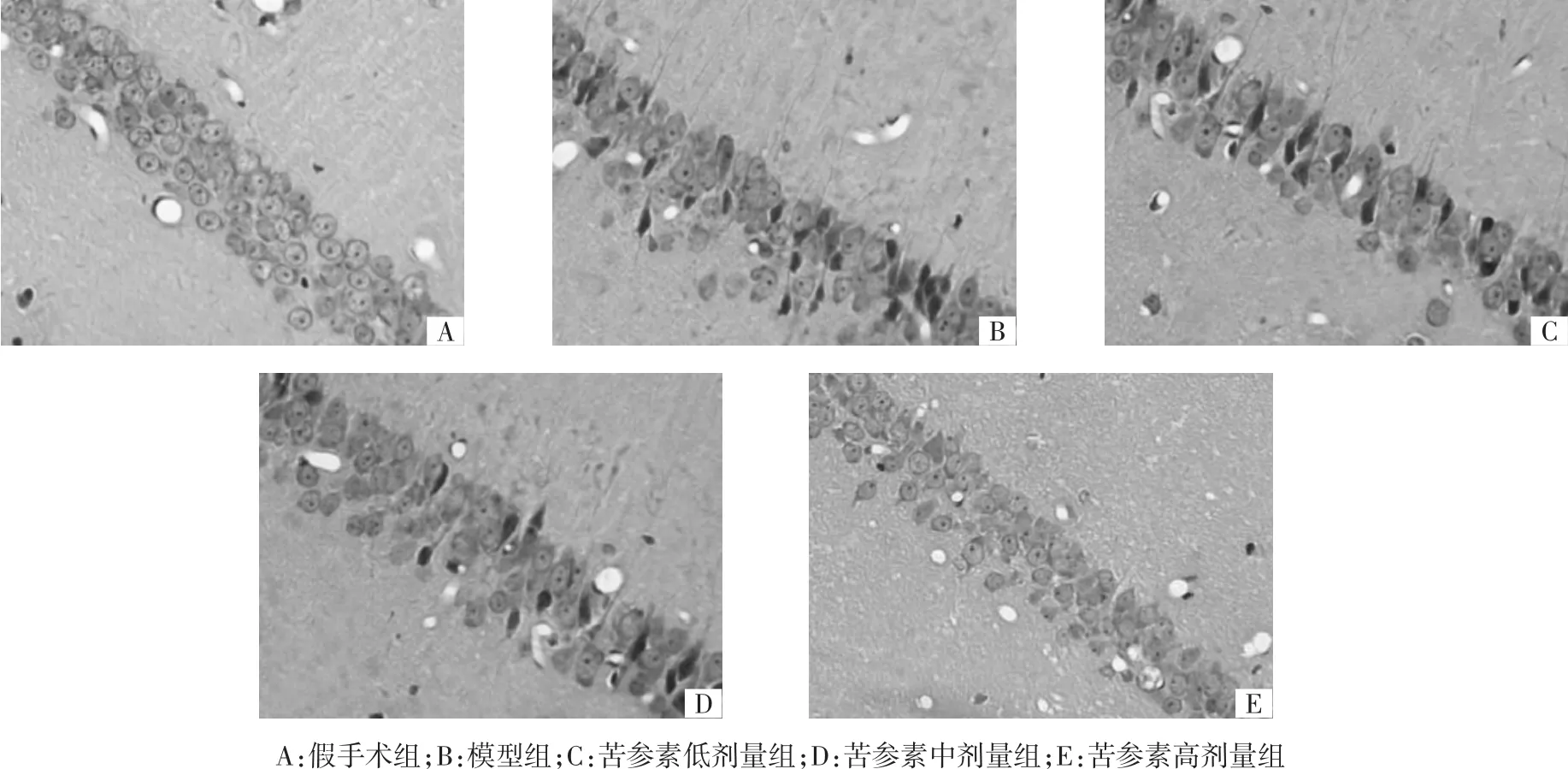
圖2 各組大鼠大腦海馬CA1區神經元形態結構(HE,×400)Fig.2 Morphology and structureof hippocampal CA1 neurons of rat brain in each group(HE,×400)

圖3 各組大鼠海馬CA1區神經元凋亡狀況(TUNEL,×400)Fig.3 Apoptosisof neuronsin hippocampal CA1 area of rats in each group(TUNEL,×400)
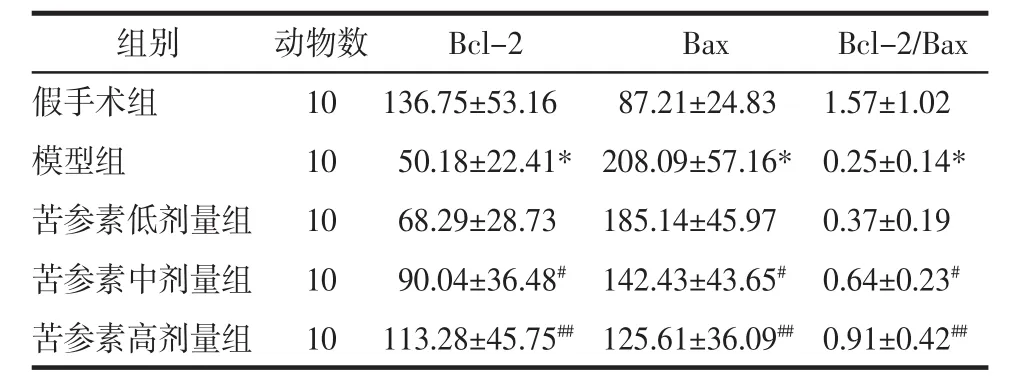
表1 各組大鼠海馬Bcl-2、Bax表達灰度值及 Bcl-2/Bax 比值(x±s)Tab.1 Gray value of Bcl-2 and Bax and the ratio of Bcl-2/Bax in hippocampusof ratsin each group(x±s)
2.4 各組大鼠海馬組織Caspase-3、NF-κB蛋白表達 與假手術組比較,模型組大鼠海馬組織Caspase-3、NF-κB 蛋白表達顯著下調(P<0.01);與模型組比較,苦參素中、高劑量組大鼠海馬組織Caspase-3、NF-κB蛋白表達均顯著下調(P<0.05 或 P<0.01)。見表 2。
2.5 各組大鼠海馬組織抗氧化酶活性和MDA含量 與假手術組比較,模型組大鼠海馬組織抗氧化酶(SOD、CAT)活性顯著降低且MDA含量顯著升高(P<0.01);與模型組比較,苦參素中、高劑量組大鼠海馬組織SOD、CAT活性顯著提高且MDA含量顯著降低(P<0.05 或 P<0.01)。見表 3。
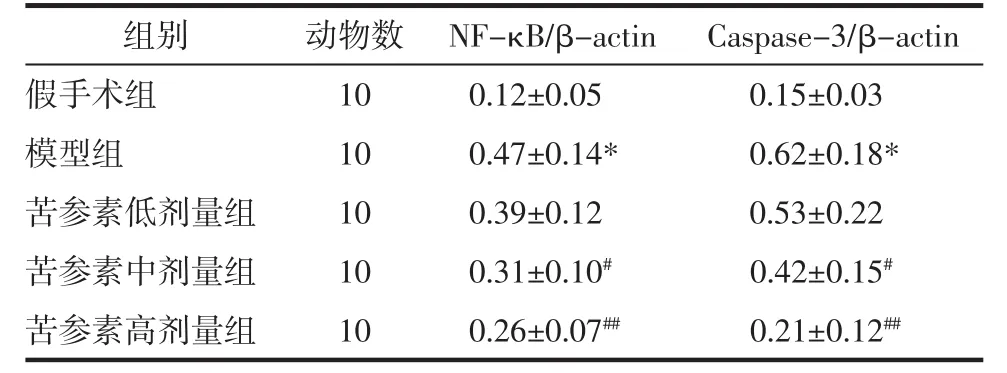
表2 各組大鼠海馬組織Caspase-3、NF-κB蛋白表達(x±s)Tab.2 Protein expression of Caspase-3 and NF-κB in hippocampus of rats in each group(x±s)
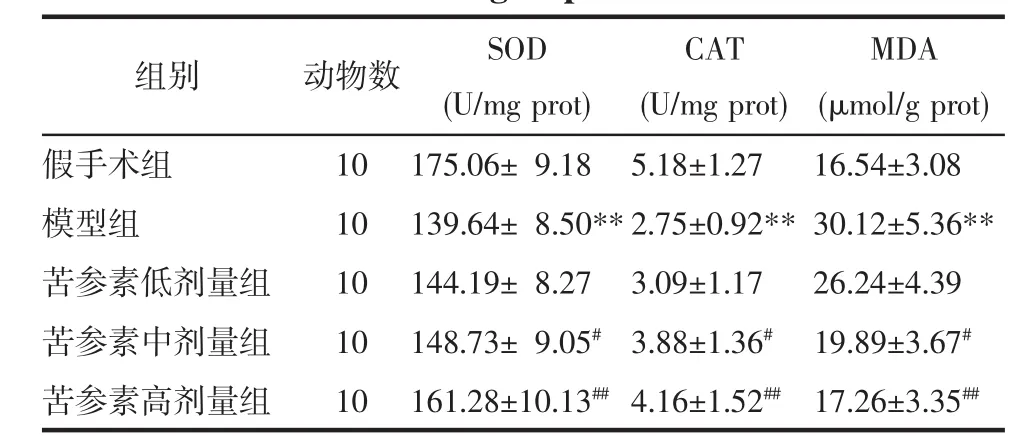
表3 各組大鼠腦組織抗氧化酶活性和MDA含量(x±s)Tab.3 Antioxidaseactivity and MDA contentsin ratsbrain of each group(x±s)
2.6 炎癥細胞因子含量 與假手術組比較,模型組大鼠海馬組織炎癥細胞因子(TNF-α、IL-1β、IL-6)含量顯著升高(P<0.01);與模型組比較,苦參素中、高劑量組大鼠 TNF-α、IL-1β、IL-6 含量均顯著降低(P<0.05 或 P<0.01),結果見表 4。
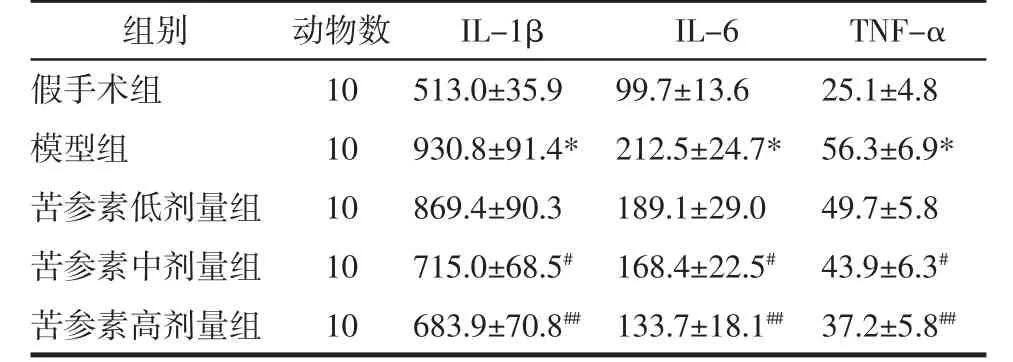
表4 各組大鼠海馬組織炎癥細胞因子含量(x±s)Tab.4 Contentsof inflammatory cytokinein hippocampusof ratsin each group(x±s)nmol/L
3 討論
海馬組織不僅與多種神經性和精神性疾病相關,而且與空間學習記憶密切相關,海馬對缺血缺氧十分敏感,尤其CA1區椎體系細胞極易受缺血缺氧損傷[6],而細胞繼發性凋亡是神經元遲發性死亡的主要形式,因此抑制海馬CA1區細胞凋亡可能是降低慢性缺血性腦病損傷的有效途徑。
Caspase-3蛋白在細胞凋亡過程中具有非常關鍵的調控作用,參與細胞凋亡的啟動及整個過程的調節[7]。Bcl-2基因家族是一系列原癌基因蛋白,在細胞凋亡過程中發揮著重要的調控作用,其中Bcl-2和Bax具有較高的同源性,但功能相反[8]。Bcl-2能夠通過抑制線粒體細胞色素C釋放,抑制半胱氨酸天冬氨酸蛋白酶激活,表現出抑制細胞凋亡的作用;Bax能夠促進細胞色素C釋放,激活Caspase-9,并且能夠與Bcl-2形成二聚體而抑制Bcl-2活性,因此Bax具有促凋亡的作用,而Bax/bcl-2比值更加能夠體現Bcl-2基因家族對細胞凋亡的調控作用[9-10]。此外,體內氧自由基(ROS)過剩是細胞凋亡的重要誘發因素,而NF-κB蛋白則是連接氧化應激和細胞凋亡的“橋梁”[11]。正常生理狀態下NF-κB以無活性狀態存在于細胞質中,而當細胞受ROS攻擊時將激活NF-κB蛋白,活化NF-κB進入細胞核并與凋亡相關基因c-myc等NF-κB調控元件結合,促進凋亡相關基因轉錄并誘導細胞凋亡[12];此外,活化的NF-κB蛋白還能夠促進巨噬細胞活化和浸潤、誘導促凋亡信號釋放而導致細胞凋亡[11]。正常生理狀態下體內ROS在抗氧化酶SOD、CAT相繼催化作用下被還原生成H2O和O2[13-14];細胞膜主要成分不飽和脂肪酸極易被ROS攻擊生成MDA,因此MDA含量水平能夠間接反映機體內ROS水平[15]。炎癥細胞因子(TNF-α、IL-1β、IL-6)是臨床上監測炎癥反應的常用指標,炎癥反應與細胞凋亡密切相關[16],并且NF-κB蛋白在炎癥反應和細胞凋亡間起到橋梁作用[17]。
苦參(Sophora flavescens Ait.)為豆科苦參屬多年生落葉亞灌木植物苦參的根,為傳統中藥品種之一,《本草綱目》、《神農本草經》等均有記載,其味苦、性寒,具有清熱燥濕、利水退黃、祛風殺蟲之功效;苦參素是苦參的主要有效成分之一,具有抗炎、改善微循環等藥理學作用[18-19]。本實驗研究發現經50~100 mg/kg苦參素治療能夠抑制海馬CA1區神經元病變并抑制該區域神經元凋亡、降低凋亡指數,上調海馬組織Bcl-2表達、下調Bax表達并提高Bcl-2/Bax比值,下調海馬組織 Caspase-3、NF-κB蛋白表達,提高SOD、CAT活性并降低MDA含量,降低炎癥細胞因子 IL-1β、IL-6、TNF-α 含量;提示苦參素具有抑制慢性腦缺血大鼠海馬CA1區細胞凋亡的藥理學作用,其機制可能與苦參素調節凋亡相關蛋白表達以及提高ROS清除能力有關。

