尿酸對大鼠血管平滑肌細胞賴氨酰氧化酶和基質金屬蛋白酶-2表達的影響
劉會,張曙影,袁國軍,榮季冬
動脈粥樣硬化是導致動脈缺血性疾病的主要原因,平滑肌細胞增殖是動脈粥樣硬化發生和發展的關鍵環節。賴氨酰氧化酶(LOX)是一種依賴銅的氨基酸氧化酶,參與細胞分化、遷移、轉型與基因表達調控[1]。LOX表達與動脈粥樣硬化密切相關[2,3]。高尿酸血癥是冠狀動脈粥樣硬化獨立的危險因素,可導致氧化應激和炎癥反應增加,并介導平滑肌細胞增生[4]。Gacheru等[5]發現,刺激大鼠血管平滑肌細胞(VSMC)增殖可上調LOX表達。因此,我們推測尿酸可能上調VSMC中LOX的表達。為驗證這一假說,我們體外培養大鼠VSMC,研究尿酸對大鼠VSMC 中LOX及基質金屬蛋白酶-2(MMP-2)表達的影響。
1 材料與方法
細胞、實驗試劑及耗材:大鼠VSMC來自大連醫科大學附屬第一醫院中心實驗室。四甲基偶氮唑藍(MTT)、尿酸、β氨基丙腈(BAPN)、二甲基亞砜(DMSO)、溴化乙錠(Sigma公司,美國);DMEM/F12細胞培養液(HyClone公司,北京);胎牛血清、0.25%胰酶-0.03 EDTA細胞消化液(Gibco公司,美國);活性氧測定盒(碧云天公司,廣州);磷酸鹽緩沖液(PBS,HyClone,北京);25 cm2細胞培養瓶(Corning,美國);逆轉錄聚合酶鏈式反應(RT-PCR)試劑盒、RNAiso Plus、DL1000 DNA marker、瓊脂糖(寶生物工程有限公司,大連);免疫印跡及凝膠電泳試劑、細胞及組織總蛋白抽提試劑盒、BCA蛋白質定量試劑盒(凱基生物有限公司,南京);羊抗人LOX多克隆抗體(Santa Cruz公司,北京);辣根過氧化物酶(HRP)結合的二級抗體、鼠抗MMP-2、鼠抗β-肌動蛋白(中杉金橋生物有限公司,北京);Millipore 超濾離心管(Millipore公司,上海);增強化學發光法(ECL)化學發光試劑盒(碩嘉生物科技公司,上海)。
大鼠VSMC培養:液氮凍存的細胞株用 37℃水浴溶解后用含 10%胎牛血清的DMEM/F12 細胞培養液洗去凍存液,接種于 25 cm2培養瓶,于 37 ℃、5%二氧化碳培養箱中培養,24 h 后更換培養液,以后每 2 d 換液,生長融合達 80%左右時進
行傳代培養。
實驗分組及預處理:本實驗分為三組:對照組(只加新鮮的DMEM/F12 培養基);尿酸組(20、40、60 mg/L尿酸干預48 h;40 mg/L尿酸干預24、48、72 h);β氨基丙腈組(40 mg/L尿酸干預48 h后加入LOX的特異性抑制劑β氨基丙腈 10 mg/ml孵育 24 h)。
細胞的形態學觀察:用倒置相差顯微鏡下觀察細胞生長狀態。
MTT比色法檢測細胞增殖量:MTT法測得的光密度值可間接反應細胞增殖量。參照榮季冬等[6]提出的方法,將狀態良好的大鼠VSMC按(2.0±0.2)×105/ml密度接種到96孔培養板中,加入DMEM/F12培養基(不含血清),孵育4 h后吸棄培養基,于不同孔中分別加入終濃度為 20、40、60 mg/L的尿酸 200 μl,孵育48 h;或在不同孔中加入終濃度為40 mg/L 尿酸 200 μl,分別孵育 24、48、72 h,加入 MTT 溶液,避光孵育4 h后吸棄培養液,加入DMSO 150 μl,振蕩10 min,酶標儀(490 nm波長)測定各孔光密度值。
細胞活性氧測定:將狀態良好的大鼠VSMC按5×104/ml~10×104/ml密度接種于 96孔板中,孵育6 h后吸棄DMEM培養基,于不同孔中分別加入終濃度 20、40、60 mg/L 的尿酸 100 μl,孵育 48 h,吸棄培養液后加入終濃度為10 μmol/L的熒光探針2,7-二氯熒光黃雙乙酸鹽(DCFH-DA) 100 μl,37℃孵育20 min,DMEM/F12培養基漂洗3次,激光共聚焦顯微鏡下觀察活性氧情況[7],最大激發及發射波長分別是488 nm和525 nm。
RT-PCR:濃度為40 mg/L尿酸干預48 h后,吸棄細胞培養液,PBS漂洗2次,收集大鼠VSMC并提取其總RNA,計算總RNA的濃度和純度。取1 μg總RNA按逆轉錄試劑盒說明書方法合成cDNA,產物按PCR試劑盒說明書方法操作。所有引物均參造Genebank提供的序列,由大連晨鈺生物有限公司合成,引物序列見表1。反應條件:95℃預變性2 min,經過多個(表1)循環(95℃變性25 s,復性 48℃ ~63℃ 35 s,72℃ 延伸 65 s),終末 72℃延伸 5 min 。PCR產物以3%瓊脂糖凝膠電泳,以Bio-Image圖像采集和分析軟件分析各條帶的光密度值,計算目的條帶與內參(β-肌動蛋白)的光密度比值,以此作為目的基因的相對表達量。

表1 逆轉錄聚合酶鏈式反應中所用引物信息
免疫印跡法檢測:吸棄細胞培養液,PBS漂洗2次,加蛋白裂解液及蛋白酶抑制劑,冰上裂解30 min,期間反復震蕩混勻,離心后取上清 BCA 法蛋白定量。取50 μg蛋白進行十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳分離蛋白及轉膜,15%脫脂牛奶-PBST溶液室溫下封閉60 min,加入一級抗體(β-肌動蛋白:鼠抗單克隆抗體為1:2 000;LOX:羊抗人多克隆抗體為 1:500;MMP-2:鼠抗單克隆抗體為1:500),4℃搖床上過夜,PBST洗膜10 min,洗5次,加入HRP偶聯二級抗體(β-肌動蛋白:山羊抗小鼠為1:20 000;LOX:兔抗羊為1:2 000;MMP-2:山羊抗小鼠為1:2 000),室溫下搖床上孵育60 min,PBST洗膜10 min,洗5次,ECL法發光顯像,X線壓片曝光,將曝光膠片進行掃描,用凝膠圖像處理系統分析條帶像素灰度值。用目標蛋白的灰度值比β-肌動蛋白的灰度值為數值,所得數值代表目標蛋白的相對含量。
統計學方法:用 SPSS 16.0統計學軟件進行統計學分析,所有數據用均數±標準差(±s) 表示,組間資料比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
體外培養的大鼠VSMC形態:倒置顯微鏡顯示,培養的大鼠VSMC呈典型谷峰樣生長,為大鼠VSMC特異的生長方式。
不同濃度尿酸干預48 h對大鼠VSMC增殖的影響(表2):與對照組比較,尿酸組不同濃度尿酸干預大鼠VSMC 48 h后細胞增殖量均明顯增加,且細胞增殖量隨著尿酸濃度升高而增加,差異均有統計學意義(P均<0.01)。
表2 對照組和尿酸組不同濃度尿酸干預下大鼠血管平滑肌細胞增殖情況比較(n=5,±s)
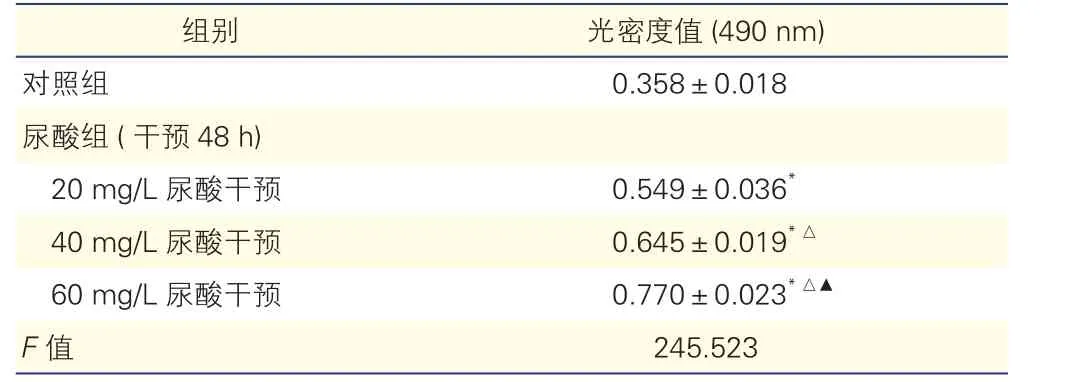
表2 對照組和尿酸組不同濃度尿酸干預下大鼠血管平滑肌細胞增殖情況比較(n=5,±s)
注:與對照組比較*P<0.01;與尿酸組(20 mg/L尿酸干預)比較△P<0.01;與尿酸組(40 mg/L尿酸干預)比較▲P<0.01
組別 光密度值(490 nm)對照組 0.358±0.018尿酸組(干預48 h)20 mg/L尿酸干預 0.549±0.036*40 mg/L尿酸干預 0.645±0.019*△60 mg/L尿酸干預 0.770±0.023*△▲F值 245.523
不同濃度尿酸干預48 h對大鼠VSMC活性氧的影響(圖1、表3):與對照組相比,不同濃度尿酸干預大鼠VSMC 48 h后細胞活性氧均明顯增多, 且活性氧含量隨著尿酸濃度升高而增加,差異均有統計學意義(P均<0.01)。
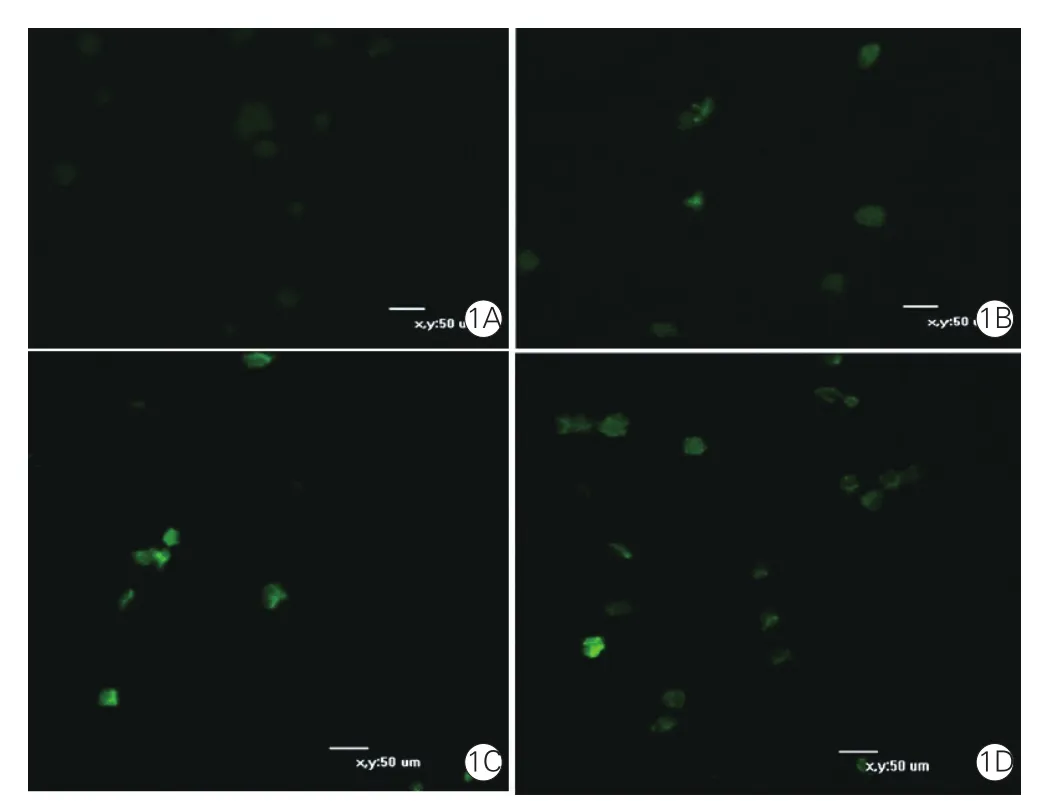
圖1 激光共聚焦顯微鏡下對照組和尿酸組不同濃度尿酸干預下大鼠血管平滑肌細胞活性氧生成情況(n=5,×10)
表3 對照組和尿酸組不同濃度尿酸干預下大鼠血管平滑肌細胞活性氧的平均熒光強度比較(n=5,±s)
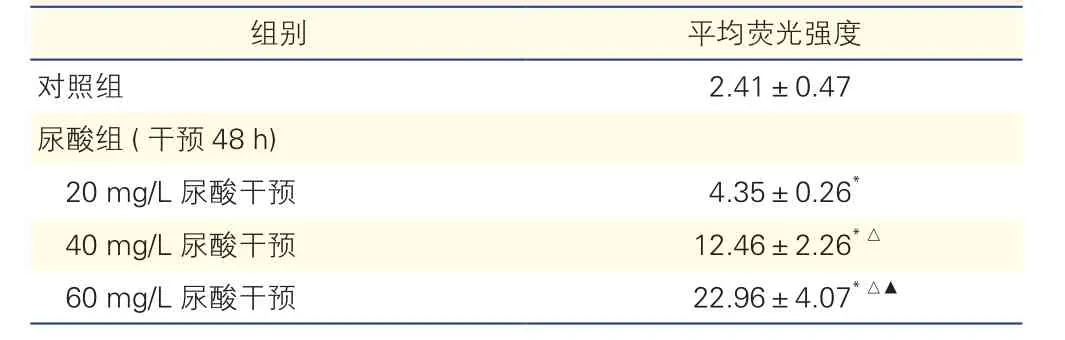
表3 對照組和尿酸組不同濃度尿酸干預下大鼠血管平滑肌細胞活性氧的平均熒光強度比較(n=5,±s)
注:與對照組比較*P<0.01;與尿酸組(20 mg/L尿酸干預)比較△P<0.01;與尿酸組(40 mg/L尿酸干預)比較▲P<0.01
組別 平均熒光強度對照組 2.41±0.47尿酸組(干預48 h)20 mg/L尿酸干預 4.35±0.26*40 mg/L尿酸干預 12.46±2.26*△60 mg/L 尿酸干預 22.96±4.07*△▲
40 mg/L尿酸干預不同時間對大鼠VSMC增殖的影響(表4):對照組及尿酸組40 mg/L尿酸干預下,大鼠VSMC增殖量隨孵育時間延長均有所增加;在孵育時間相同的情況下,尿酸組40 mg/L尿酸干預下大鼠VSMC增殖量較對照組均明顯增加,差異均有統計學意義(P均<0.01)。

表4 對照組和尿酸組40 mg/L尿酸干預不同時間后大鼠血管平滑肌細胞增殖情況比較(n=5,±s)
40 mg/L尿酸干預 48 h對大鼠VSMC中LOX和MMP-2 mRNA和蛋白表達的影響(圖2、圖3、表5):與對照組比較,尿酸組(40 mg/L尿酸干預 48 h)大鼠VSMC中LOX、MMP-2 mRNA和蛋白表達量均明顯增加(P均<0.01);與尿酸組(40 mg/L尿酸干預 48 h)比較,β氨基丙腈組大鼠VSMC中LOX、MMP-2 mRNA和蛋白表達量均明顯下降(P均<0.01)。
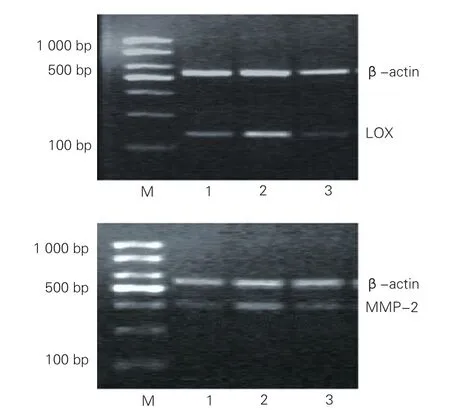
圖2 逆轉錄聚合酶鏈式反應產物電泳顯示三組大鼠VSMC中LOX和MMP-2 信使核糖核酸的表達情況
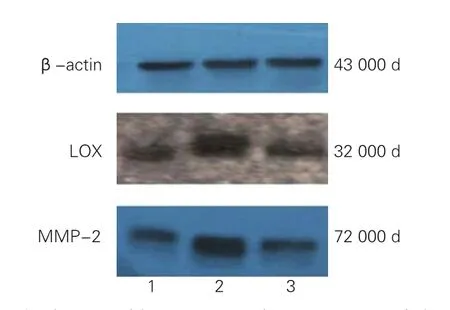
圖3 免疫印跡法顯示三組大鼠VSMC中LOX和MMP-2蛋白的表達情況
表5 半定量分析三組大鼠VSMC中LOX、MMP-2的mRNA和蛋白表達水平的影響(n=5,±s)
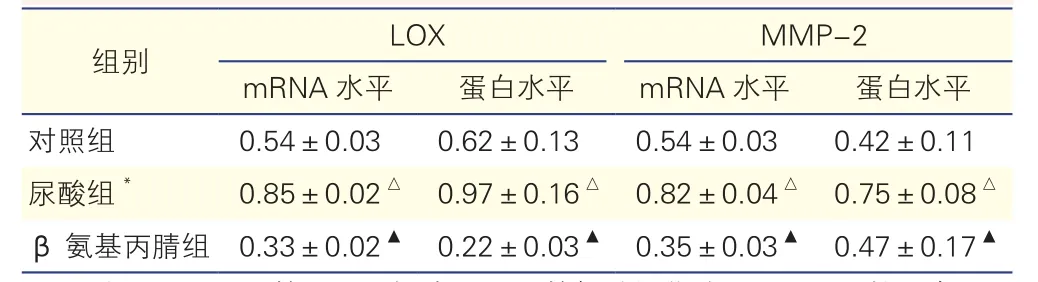
表5 半定量分析三組大鼠VSMC中LOX、MMP-2的mRNA和蛋白表達水平的影響(n=5,±s)
注:VSMC:血管平滑肌細胞;LOX:賴氨酰氧化酶;MMP-2:基質金屬蛋白酶-2;mRNA:信使核糖核酸。*:指40 mg/L尿酸干預 48 h的情況下。與對照組比較△P<0.01;與尿酸組比較▲P<0.01
3 討論
動脈粥樣硬化是人類心血管疾病的重要病理基礎,因此,防治動脈粥樣硬化對于減少心血管疾病負擔非常關鍵。目前公認的動脈粥樣硬化發病機理是:內皮細胞受損后其功能及滲透性發生改變,脂質和單核細胞沉積于內皮下形成脂質斑,附著于損傷處的血小板釋放生長因子刺激平滑肌細胞進入內膜、增殖合成膠原纖維,最終纖維斑塊形成。因此,平滑肌細胞增殖是動脈粥樣硬化發生和發展的關鍵步驟。
自Gertler等[8]首次報道尿酸與冠狀動脈粥樣硬化性疾病相關后,眾多的臨床研究證實,血尿酸增高與心血管疾病密切相關[9],并且認為高尿酸血癥是心血管疾病的危險因素[10,11]。但高尿酸血癥與心血管疾病之間如何關聯目前尚不明確。本研究結果顯示,不同濃度尿酸(20、40、60 mg/L)干預大鼠VSMC 48 h及40 mg/L尿酸干預不同時間(24、48、72 h)后,細胞增殖量均增加,且呈濃度依賴性和時間依賴性。大鼠VSMC在不同濃度尿酸(20、40、60 mg/L)干預下細胞內活性氧生成量增加,且呈濃度依賴性,這印證了尿酸可通過一系列途徑使氧自由基增加,導致氧化應激加重。
LOX在動脈粥樣硬化過程中扮演著重要的作用,LOX的調節變化在動脈粥樣硬化早、晚期可能有所不同,在動脈粥樣斑塊形成及破裂過程中,均發現有LOX表達異常[12]。既往我們的研究表明,LOX在心臟重構中扮演重要作用,提取慢性心力衰竭小鼠心肌組織的RNA及蛋白質,LOX可通過p38及核因子-κB信號通路調節心臟重構[13]。此外,刺激成年大鼠VSMC增殖可促進LOX的表達[14]。既往有研究表明,尿酸可刺激大鼠VSMC增殖[15],但尿酸誘導VSMC增殖后是否能調節LOX表達進而促進動脈粥樣硬化的發生和發展則未見報道。本研究發現,尿酸誘導VSMC增殖后LOX的表達上調,這與Gacheru等[5]的報道相似,這證實尿酸可上調大鼠VSMC中LOX的表達進而在一定程度上促進動脈粥樣硬化的發生和發展。
MMP是一組鋅、鈣離子依賴的蛋白水解酶家族,特異性地與細胞外基質成分結合并降解細胞外基質,參與炎性反應、缺血缺氧損傷、心血管疾病和癌癥等病理過程[16,17]。姜昕等[18]報道,在正常動脈組織中沒有檢測到MMP活性,而在動脈粥樣硬化血管中,隨著血管動脈粥樣硬化程度加重,MMP的表達量升高。此外有研究表明,心肌梗死動物模型心肌組織中LOX的表達明顯上調,心肌組織膠原纖維明顯增加,MMP-1表達明顯下調,金屬蛋白酶抑制因子-1表達無明顯變化[19]。在擴張型心肌病中,轉化生長因子-β可上調LOX的表達,參與促進膠原纖維的合成并誘導激活MMP活性[20],但在VSMC中LOX能否調節MMP-2的表達進而影響動脈粥樣硬化的發生和發展少見報道。我們推測,尿酸可通過誘導大鼠VSMC增殖導致LOX表達增加,進一步誘導MMP-2表達上調。我們發現,尿酸誘導VSMC增殖后MMP-2表達上調,應用LOX的特異性抑制劑β氨基丙腈后,細胞中的MMP-2表達明顯下調,這證實尿酸誘導VSMC增殖后LOX表達增加能進一步誘導MMP-2表達上調,加速細胞外基質的降解,進而促進動脈粥樣硬化的發生和發展。
綜上所述,尿酸誘導大鼠VSMC增殖后LOX表達上調,LOX可進一步上調MMP-2表達,加速細胞外基質的降解而促進動脈粥樣硬化的發生和發展,這可能是尿酸促進動脈粥樣硬化進展的主要機制之一。但本研究未探索尿酸促進LOX表達的上下游信號通路,這值得進一步研究。

