生物醫用開孔泡沫鋅的制備及力學性能
祖國胤 李志剛 胡磊 黃鵬 穆永亮

摘要:
采用自制的真空滲流鑄造裝置制備開孔泡沫鋅材料。運用壓縮測試研究了孔隙參數對其壓縮性能的影響。結果表明,開孔泡沫鋅孔的形狀呈近球形,孔洞相互連通為開孔結構,孔隙結構三維連接良好,與人骨松質骨的孔隙率和孔隙結構匹配程度較高。開孔泡沫鋅準靜態壓縮性能的主要影響因素為材料的孔隙率。隨著孔隙率的增加,材料的彈性模量、抗壓強度均降低,應力平臺延長。所制備的開孔泡沫鋅材料的抗壓強度高于人骨松質骨的抗壓強度,彈性模量與人骨松質骨的彈性模量相匹配,滿足移植材料的要求。
關鍵詞:
真空滲流鑄造; 開孔泡沫鋅; 孔隙率; 壓縮性能
中圖分類號: TG 146.13 文獻標志碼: A
Preparation and Mechanical Property of Open-cell Zinc
Foams for Biomedical Application
ZU Guoyin LI Zhigang HU Lei HUANG Peng MU Yongliang2
(1.School of Materials Science and Engineering, Northeastern University, Shenyang 110819, China;
2.School of Metallurgy, Northeastern University, Shenyang 110819, China)
Abstract:
The open-cell zinc foams were prepared by the self-made vacuum infiltration casting device.The effects of pore parameters on compressive performance were investigated by compressive tests.The results indicate that the pore shape of the zinc foams is nearly spherical,and the interconnected pores are open cell structure.The pore structure is well connected in three-dimensional,which show good matching with the porosity and pore structure of human cancellous bone.The main influencing factors for the quasi-static compressive properties of open-cell zinc foam are their porosity.With increase of porosity,both elastic modulus and compressive strength decrease,and the stress platform is prolonged.The compressive strength of the open-cell zinc foam is slightly higher than that of the human bone,and the elastic modulus well matches that of the human bone.The mechanical properties meet the requirements of the implants.
Keywords:
vacuum infiltration casting; open-cell foams zinc; porosity; compressive property
醫用金屬材料具有良好的力學性能和生物相容性,作為人體硬組織修復及替換材料已得到廣泛的應用[1-3]。但是臨床研究發現,醫用金屬材料與人骨的彈性模量不匹配,植入后產生應力屏蔽現象,導致植入體的松動或斷裂[4-6]。為了解決上述問題,學者們提出了在醫用金屬材料中引入孔隙的方法,將其制成多孔金屬材料[7-8]。孔隙的存在對材料的性能有以下幾個方面的改善:多孔金屬材料的密度、強度和彈性模量可以通過對孔徑大小和孔隙率的調整來達到生物力學相容,從而可以減輕或消除應力遮擋現象[9-10];特有的多孔結構及粗糙的內外表面有利于成骨細胞的黏附、增殖和分化,促使新骨組織長入孔隙,使植入體同骨之間形成生物固定[11];三維連通的孔結構能夠使體液和營養物質在植入體中傳輸,促進組織再生與重建,加快愈合過程[12-13]。
目前,可作為骨組織修復與替換的多孔金屬材料主要有多孔鈦、鈦合金、多孔鉭等。需要指出的是,人體對金屬材料植入物的功能需求在一些情況下只是暫時的,例如骨科鋼板、螺釘材料及血管支架等,往往需要進行二次手術取出[14]。此外,金屬植入物長期植入骨骼會產生應力遮擋效應,影響骨骼生長發育。針對這一問題,可降解金屬材料的研發得到了許多研究者的關注,如鎂、鐵及其合金等[15]。目前對于可降解金屬生物材料的研究主要集中在鎂及鎂合金上,但鎂合金在人體內的降解速率過快及不均勻性降解導致力學性能迅速下降,從而難以達到植入材料的性能要求,同時生成大量氣體引起局部區域pH升高[16-17]。鋅及鋅合金在生物體內也可以降解,和可降解鎂合金的體內降解機理類似,但鋅比鎂更耐腐蝕,比鐵更易腐蝕。鋅及鋅合金如果作為生物可降解材料,就可避免出現如生物鎂合金降解速度過快或如生物鐵基合金降解速度過慢而引發的一系列問題[18]。同時,鋅也是人體必須的微量元素之一,在人體的生理機能、細胞代謝以及基因表達方面有十分重要的作用[19-20]。因此,鋅及鋅合金更適合用作需要降解速率較低的骨組織工程支架材料。
本文采用自主設計的真空滲流鑄造裝置制備了近球形孔開孔泡沫鋅材料,對開孔泡沫鋅孔隙基本參量進行表征和檢測,分析了材料準靜態壓縮性能和孔隙基本參量之間的關系。
1 試驗材料與方法
傳統滲流鑄造裝置往往由多個部分組成,滲流過程中各部分一般都需要預熱,導致裝配復雜,裝置的密封也難以保證。同時,傳統的固體壓頭加壓法和氣體加壓法滲流過程不易控制,工藝參數控制
不當時容易出現滲流不足和滲流過度等缺陷[21-22]。本試驗采用自主設計的真空滲流鑄造裝置制備開孔泡沫鋅,有效地解決了以上問題。本試驗選擇球形氯化鈣作為預制體燒結材料,其宏觀形貌如圖1所示,粒徑范圍為1.5~4.0 mm,試驗所用的鋅錠純度≥99.995%(質量分數)。
圖1 不同粒徑的球形氯化鈣顆粒
Fig.1 Spherical calcium chloride particle with different diameters
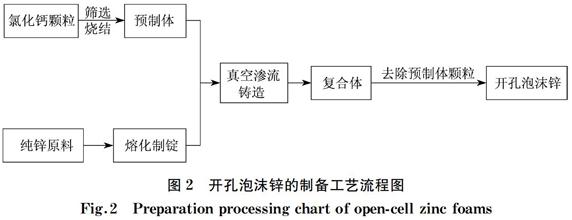
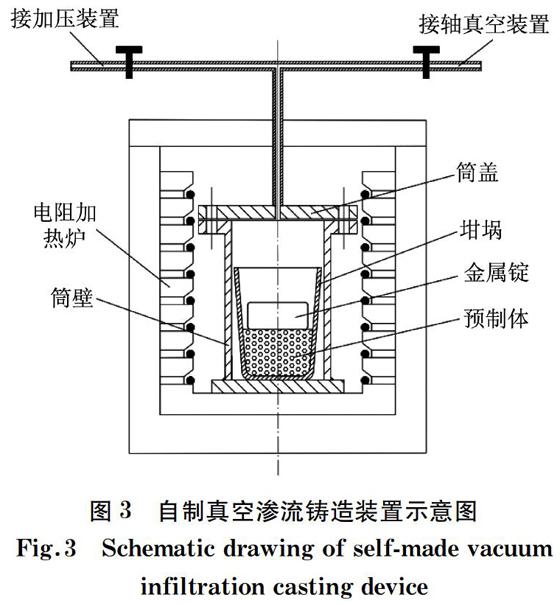
開孔泡沫鋅的制備工藝流程如圖2所示。首先將篩分好的粒徑均勻的球形氯化鈣顆粒在650~700 ℃燒結5 h,得到氯化鈣預制體;將鋅錠置于氯化鈣預制體上,再置于真空滲流裝置中升溫加熱,同時抽真空,使內部真空度保持在0.090~0.098 MPa,完全液封后,關閉真空系統;當滲流溫度達到570~620 ℃后,保溫,之后打開加壓閥門進行滲流鑄造,滲流壓力為0.3~0.7 MPa,得到鋅-氯化鈣復合體;待復合體凝固后,用水溶法除去氯化鈣顆粒,即得到開孔泡沫鋅材料。自主設計的真空滲流鑄造裝置如圖3所示。
圖2 開孔泡沫鋅的制備工藝流程圖
Fig.2 Preparation processing chart of open-cell zinc foams
圖3 自制真空滲流鑄造裝置示意圖
Fig.3 Schematic drawing of self-made vacuum infiltration casting device
采用高像素數碼相機(SONY,DSC-P10)觀測開孔泡沫鋅的截面宏觀形貌,采用SIGMA 500場發射掃描電子顯微鏡(SEM)對開孔泡沫鋅試樣進行組織形貌分析。采用Instron5843型萬能試驗機測試開孔泡沫鋅的準靜態壓縮性能,加載速度為1 mm/min。圓柱體試樣的外觀尺寸為40 mm×30 mm,準靜態壓縮應力-應變曲線由位移-載荷數據經計算機處理后得到。
2 結果與討論
2.1 開孔泡沫鋅孔隙結構特征
圖4為高像素數碼相機拍攝的不同孔徑的開孔泡沫鋅經線切割后的宏觀形貌。從圖4中可以看出,不同孔徑的氯化鈣顆粒制備的開孔泡沫鋅整體結構相對完整,孔洞分布均勻,孔的形狀比較規則,呈近球形,孔徑越大,其孔壁結構越完整;同時,也可以看到泡沫鋅內部的孔洞相互連通,其中小孔徑泡沫鋅連通性較好,大孔徑泡沫鋅連通性較差,但都屬
于開孔結構。因此,采用球形氯化鈣顆粒制備的開孔泡沫鋅孔分布是較為均勻的,孔的形狀也基本呈近球形,其力學性能的穩定性得到了很好的保證。
圖4 不同孔徑開孔泡沫鋅宏觀形貌
Fig.4 Macrograph of open-cell zinc foams with different apertures
深入了解開孔泡沫鋅孔的微觀形貌有利于研究其力學性能和孔的結構與人體骨骼的匹配情況。圖5為制備的開孔泡沫鋅單個孔的SEM照片。從圖5中可以看出,不同孔之間依靠較粗的孔棱連接,開孔泡沫鋅孔隙連通性較好,孔隙率較高,力學性能也較好,孔隙結構和力學性能與人體松質骨的匹配程度較高。同時,這些孔為連通孔,當開孔泡沫鋅植入人體后,這些孔洞能夠讓新的骨組織長入其內部,也便于人體體液和營養物質的傳輸。
圖5 開孔泡沫鋅單個孔的SEM照片
Fig.5 SEM images of single pore in open-cell zinc foams
2.2 開孔泡沫鋅的準靜態壓縮變形特征
圖6為平均孔徑為2.0 mm,孔隙率為68.12%的開孔泡沫鋅的應力-應變曲線。從圖6中可以看出,其應力-應變曲線平滑,無明顯的波動,整個壓縮過程表現為塑性變形。曲線具有3個明顯的階段:彈性變形階段Ⅰ、應力平臺階段Ⅱ和密實化階段Ⅲ。
在壓縮開始時,應力隨應變的增大而不斷增大,此時材料處于彈性變形階段,該階段應變范圍很小,一般≤5%。在彈性變形階段,開孔泡沫鋅在宏觀上幾乎沒有變化,此階段開孔泡沫鋅的變形機理主要是孔壁和孔棱的彎曲,從而產生彈性變形;之后進入應力平臺階段,隨著應變的增大,壓縮曲線呈現出一個近似平臺的區域,在此階段,開孔泡沫鋅首先在孔壁薄弱處發生坍塌,形成局部變形帶,在塑性變形開始后,孔壁或孔棱的應變硬化引起連續的應力傳遞,形成了多個變形帶,經進一步變形,變形帶逐步的應變硬化和孔壁或孔棱的相互接觸使得開孔泡沫鋅強度穩步增加,在整個塑性變形過程中多個變形帶同步活動,整體變形協調性較好,基本不存在個別變形帶突然崩潰的現象,反映在應力-應變曲線上表現為曲線平滑;最后坍塌的孔壁和棱柱相互接觸,進入密實化階段,進一步變形需施加更大的載荷,即表現為應力-應變曲線迅速升高,此時應變的產生主要由基體材料來承擔,應力隨應變的增加急劇增加,此階段中應力-應變曲線特征與實體鋅的壓縮曲線基本一致。
圖6 開孔泡沫鋅的應力-應變曲線
Fig.6 Stress-strain curve of the open-cell zinc foams
對壓縮應力-應變曲線進行分析,可以得到開孔泡沫鋅壓縮性能的相關特征參數。開孔泡沫鋅的彈性模量(E)通過對線彈性階段應力-應變曲線的斜率計算得到。從開孔泡沫鋅壓縮應力-應變曲線中(圖6)可以看出,其線彈性階段后,無明顯峰值應力,因此取應變為1%時對應的應力作為抗壓強度(σy)。平臺應力(σpl)取宏觀應變在20%~40%的應力的平均值,平臺截至應變(εD)取1.3倍的平臺應力對應的應變值,得到的數據如表1所示。
從表1可知,所制備的開孔泡沫鋅孔隙率為59%~70%,彈性模量為0.4~2.1 GPa,抗壓強度為6.3~14.8 MPa,高于人骨松質骨的抗壓強度,彈性模量與人骨的彈性模量相匹配,符合松質骨的要求(人骨松質骨的孔隙率為40%~90%,抗壓強度為2~10 MPa,彈性模量為0.1~2.0 GPa[23])。
2.3 開孔泡沫鋅的準靜態壓縮性能及其影響因素
圖7為兩組孔隙率相同,孔徑不同的開孔泡沫鋅的準靜態壓縮應力-應變曲線。結合表1可以看出,在相同孔隙率下,平均孔徑為4.0 mm的開孔泡沫鋅的抗壓強度和彈性模量高于相同孔隙率下平均孔徑為2.0,3.0 mm的試樣。這是因為孔徑增大時,相應的孔壁或孔棱的厚度也增大,承受載荷的能力增強,同時4.0 mm孔徑的開孔泡沫鋅孔壁較完整,故力學性能各項數值明顯增大。而平均孔徑為2.0,3.0 mm的開孔泡沫鋅由于孔的連接結構均為孔棱,力學性能基本一致,其壓縮應力-應變曲線基本重合。研究顯示,當材料的孔隙率相同,孔徑的大小對具有均勻孔結構的開孔泡沫鋅的壓縮性能影響很小。
表1 開孔泡沫鋅的壓縮性能
Tab.1 Compressive properties of open-cell zinc foams
圖7 相同孔隙率不同孔徑開孔泡沫鋅的 應力-應變曲線
Fig.7 Stress-strain curves of the open-cell zinc foams with different pore sizes
對泡沫金屬力學性能影響最大的因素是它的相對密度,其孔隙率(θ)與相對密度之間的關系為:
θ=1-ρ*ρs×100%
(1)
式中:ρ*為開孔泡沫鋅表觀密度;ρs為基體材料的密度。
由式(1)可知,開孔泡沫鋅的孔隙率和相對密度具有直接對應關系,因而孔隙率對開孔泡沫鋅的力學性能具有重要影響。當開孔泡沫鋅的孔隙率提高時,其相對密度降低,使孔壁和孔棱的相對厚度減小,因而強度降低,造成了較低的彈性模量和平臺應力;而且孔隙率越大則孔隙在泡沫鋅中所占的體積越大,泡沫鋅就會有更多的可壓縮空間,這就增大了致密化開始的應變。圖8所示為平均孔徑為3.0 mm孔隙率不同的開孔泡沫鋅準靜態壓縮應力-應變曲線。從圖8中可以看出,隨著泡沫鋅孔隙率的增大,泡沫鋅的彈性模量和抗壓強度明顯降低,平臺應力也降低,并且應力平臺相應延長,更晚地進入密實化階段。可見孔隙率是開孔泡沫鋅各項壓縮力學性能的主要影響因素。
圖8 孔徑相同孔隙率不同的開孔泡沫鋅應力-應變曲線
Fig.8 Stress-strain curves of the open-cell zinc
foams with same pore size but different porosities
圖9為不同孔隙率開孔泡沫鋅的平臺應力與孔隙率之間關系,可以看出平臺應力隨著孔隙率的增加而逐漸降低。平臺應力和孔隙率之間關系[24]為:
σplEs=C′ρ*ρs21+ρ*ρs1/22
(2)
式中:C′為幾何比例常數;Es為基體材料的彈性模量和密度。
圖9 平臺應力與開孔泡沫鋅孔隙率的關系曲線
Fig.9 Relationship between platform stress and porosity of open-cell zinc foams
由式(2)可知,平臺應力主要與泡沫材料的相對密度及其基體材料的性能有關,當開孔泡沫鋅的孔隙率增加時,其相對密度降低,因此平臺應力下降。
圖10和圖11分別為開孔泡沫鋅的抗壓強度和彈性模量與孔隙率之間的關系,其抗壓強度和彈性模量隨著孔隙率的增加而逐漸降低。開孔泡沫鋅的彈性模量與孔隙率的關系可由下式得出[24]:
EEs=C′ρ*ρs2
(3)
圖10 開孔泡沫鋅的抗壓強度與孔隙率的關系曲線
Fig.10 Relationship between compressive strength and porosity of open-cell zinc foams
由式(3)可知,開孔泡沫鋅的彈性模量主要取決于其相對密度及基體材料的性能。當開孔泡沫鋅的孔隙率提高時,其相對密度下降,其彈性模量也隨之下降。這主要是,因為孔隙率的增加會減小孔壁和孔棱的相對厚度,孔壁的彎曲抗力和孔穴的坍塌抵抗力均降低,因此抗壓強度和彈性模量降低。
醫用金屬材料具有良好的力學性能和生物相容性,作為人體硬組織修復及替換材料已得到廣泛的應用。但作為人體醫用植入材料,醫用金屬材料的彈性模量比人骨大許多(如鈦合金的彈性模量為100~110 GPa,人骨的彈性模量為 1~30 GPa[1]),當金屬材料植入人體以后會產生應力屏蔽現象。開孔泡沫鋅的彈性模量為0.4~2.1 GPa,抗壓強度為6.3~14.8 MPa,其彈性模量與人骨相匹配,而抗壓強度卻不低于人骨,可以很好地解決人工骨植入體材料與人骨力學性能不匹配的問題。對于人骨而言,輸送體液和營養物質是其一項重要的功能,開孔泡沫鋅內部相互連通孔洞的存在恰好便于體液和營養物質的傳輸。可以通過改變預制體顆粒的大小、分布以及調整預制體的制備工藝參數來調節開孔泡沫鋅的孔徑和孔隙率,使得開孔泡沫鋅與人骨的彈性模量和孔徑相匹配,以滿足人體植入材料的要求。同時,鋅及其合金具有良好的生物相容性,作為生物可降解材料,可避免出現如生物鎂合金降解速度過快或如生物鐵基合金降解過慢而引發的一系列問題。因此,開孔泡沫鋅作為骨組織工程材料是一種很有前景的生物材料。
圖11 開孔泡沫鋅的彈性模量與孔隙率的關系曲線
Fig.11 Relationship between elastic modulus and
porosity of open-cell zinc foams
3 結 論
(1) 采用自主設計的真空滲流鑄造裝置成功制備的開孔泡沫鋅孔隙率可調,分布均勻,孔洞相互連通為開孔結構,孔隙結構三維連接良好,與人體骨骼松質骨的孔隙率和孔隙結構匹配程度較高。
(2) 隨著孔隙率的增加,材料的彈性模量、抗壓強度均降低,應力平臺延長,平臺應力下降。
(3) 所制備的開孔泡沫鋅的抗壓強度高于人骨松質骨的抗壓強度,彈性模量與松質骨的彈性模量相匹配,符合松質骨的要求,并且可通過調節開孔泡沫鋅的孔隙率使其彈性模量與人骨彈性模量相匹配,以滿足人體植入材料的要求,是一種很有前景的骨組織工程材料。
參考文獻:
[1] GEETHA M,SINGH A K,ASOKAMANI R,et al.Ti based biomaterials,the ultimate choice for orthopaedic implants-A review[J].Progress in Materials Science,2009,54(3):397-425.
[2] 任伊賓,楊柯,梁勇.新型生物醫用金屬材料的研究和進展[J].材料導報,2002,16(2):12-15.
[3] 張永濤,劉漢源,王昌,等.生物醫用金屬材料的研究應用現狀及發展趨勢[J].熱加工工藝,2017(4):21-26.
[4] NAGELS J,STOKDIJK M,ROZING P M.Stress shielding and bone resorption in shoulder arthroplasty[J].Journal of Shoulderand Elbow Surgery,2003,12(1):35-39.
[5] ENGH JRC A,YOUNG A M,ENGH C A S,et al.Clinical consequences of stress shielding after porous-coated total hip arthroplasty[J].Clinical Orthopaedics & Related Research,2003,417:157-163.
[6] CHEN J,MA F C,LIU P,et al.Effects of different processing conditions on super-elasticity and low modulus properties of metastable β-type Ti-35Nb-2Ta-3Zr alloy[J].Vacuum,2017,146:164-169.
[7] ARABNEJAD S,JOHNSTONR B,PURA J A,et al.High-strength porous biomaterials for bone replacement:a strategy to assess the interplay between cell morphology,mechanical properties,bone ingrowth and manufacturing constraints[J].Acta Biomaterialia,2016,30:345-356.
[8] WANG X J,XU S Q,ZHOU S W,et al.Topological design and additive manufacturing of porous metals for bone scaffolds and orthopaedic implants:a review[J].Biomaterials,2016,83:127-141.
[9] TORRES Y,TRUEBA P,PAVN J,et al.Designing,processing and characterisation of titanium cylinders with graded porosity:an alternative to stress-shielding solutions[J].Materials & Design,2014,63:316-324.
[10] ARABNEJAD S,JOHNSTON B,TANZER M,et al.Fully porous 3D printed titanium femoral stem to reduce stress-shielding following total hip arthroplasty[J].Journal of Orthopaedic Research,2017,35(8):1774-1783.
[11] 劉輝,憨勇.醫用多孔金屬的制備及其生物活化研究進展[J].中國材料進展,2012,31(5):40-56.
[12] WU S L,LIU X M,YEUNG K W K,et al.Biomimetic porous scaffolds for bone tissue engineering[J].Materials Science and Engineering:R:Reports,2014,80:1-36.
[13] ZHANG Z,JONES D,YUE S,et al.Hierarchical tailoring of strut architecture to control permeability of additive manufactured titanium implants[J].Materials Science and Engineering:C,2013,33(7):4055-4062.
[14] NIINOMI M.Recent metallic materials for biomedical applications[J].Metallurgical and Materials Transactions A,2002,33(3):477-486.
[15] 鄭玉峰,劉彬,顧雪楠.可生物降解性醫用金屬材料的研究進展[J].材料導報,2009,23(1):1-6.
[16] ZHANG S X,ZHANG X N,ZHAO C L,et al.Research on an Mg-Zn alloy as a degradable biomaterial[J].Acta Biomaterialia,2010,6(2):626-640.
[17] SONG G L.Control of biodegradation of biocompatable magnesium alloys[J].Corrosion Science,2007,49(4):1696-1701.
[18] MOSTAED E,SIKORA-JASINSKA M,MOSTAED A,et al.Novel Zn-based alloys for biodegradable stent applications:design,development and in vitro degradation[J].Journal of the Mechanical Behavior of Biomedical Materials,2016,60:581-602.
[19] HAMBIDGE K M,KREBS N F,MILLER L V.Zinc:physiology and health effects[M]∥CABALLERO B,FINGLAS P M,TOLDR F.Encyclopedia of Food and Health.Amsterdam:Elsevier,2016:633-637.
[20] BOWEN P K,DRELICH J,GOLDMAN J.Zinc exhibits ideal physiological corrosion behavior for bioabsorbable stents[J].Advanced Materials,2013,25(18):2577-2582.
[21] DESPOIS J F,MARMOTTANT A,SALVO L,et al.Influence of the infiltration pressure on the structure and properties of replicated aluminium foams[J].Materials Science and Engineering:A,2007,462(1/2):68-75.
[22] 周向陽,尚保衛,劉宏專.真空滲流法制備通孔泡沫鋁及其缺陷分析[J].山西化工,2008,28(4):1-5.
[23] WEN C E,YAMADA Y,SHIMOJIMA K,et al.Compres-sibility of porous magnesium foam:dependency on porosity and pore size[J].Materials Letters,2004,58(3/4):357-360.
[24] GIBSON L J,ASHBY M F.Cellular solids:structure and properties[M].2nd ed.Cambridge:Cambridge University Press,1997.

