布魯氏菌OMP31 T-B聯合表位抗原的免疫應答分析①
江曉明 張峰波 朱玥潔 甫拉提·熱西提 李智偉 龐 盼 丁劍冰
(新疆醫科大學基礎醫學院免疫教研室,烏魯木齊830011)
布魯氏菌病(Brucellosis)是由布魯氏菌感染引起的,《中華人民共和國傳染病防治法》中規定報告的乙類傳染病,是一種呈世界范圍分布的人畜共患病[1],布病主要流行于我國的農牧區,新疆是主要的高發地區之一[2,3]。布病的早期癥狀多不典型,容易發生診斷不清,延誤治療,使病情拖延至慢性期引發多器官受累致殘甚至致死[4-6],且目前缺乏有效的治療方法[7]。為了減少疾病痛苦與社會損失,有必要開發安全有效的疫苗[8],尤其在布病流行趨式嚴峻的地區。
至今尚未有國際認可的人用布病疫苗,目前我國用于動物的疫苗是A19和S2兩種減毒疫苗,但在廣泛用于布病防控的同時也存在一些缺陷[9],主要是毒性較大,使一些接種對象出現不同程度的副反應或急性布病癥狀。生物信息學技術助力推進布病疫苗的研發,目前針對布病研發的基因工程疫苗如表位疫苗取得了一定進展,其中以外膜蛋白OMP31的研究較為突出。
本研究應用生物信息軟件預測分析布魯氏菌OMP31的T淋巴細胞和B淋巴細胞(T-B)的聯合表位,利用優勢表位人工合成OMP31肽段后免疫小鼠,分析OMP31 T-B聯合表位誘導的免疫應答效果。
1 材料與方法
1.1材料 SPF級雌性BALB/c小鼠,6~8周齡,體重(20±2)g,由新疆醫科大學第一附屬醫院臨床研究院實驗動物科學研究部提供,實驗動物生產許可證編號A-20130216-155。
1.2方法
1.2.1表位預測與合成 采用SYFPEITHI (http://syfpeithi.de/) and ProPred Prediction Server (http://www.imtech.res.in/raghava/propred1/)預測T細胞表位,OMP31B細胞表位采用DNAstar(USA lynnon biosoft)and IEDB(http://tools.immuneepitope.org/bcell)預測。預測后T-B細胞表位肽段由上海生工生物工程公司合成。
1.2.2小鼠免疫 將24只小鼠隨機分成兩組,每組12只:A組(陰性對照PBS組),B組(實驗組)。B組背部皮下多點注射10 μg/ml的肽段200 μl與等體積完全弗氏佐劑(F5881,Sigma,USA),2周后使用相同濃度肽段200 μl與等體積不完全弗氏佐劑(F5881,Sigma,USA)加強免疫,一共加強免疫3次,共8周。陰性對照組相同方法注射生理鹽水200 μl/(只·次)。
1.2.3Th1免疫應答檢測 末次免疫后2周,麻醉后頸椎脫臼法處死小鼠,無菌分離脾臟,調整脾細胞濃度至1×107ml-1,ELISPOT檢測試劑盒(BD公司)計數小鼠脾細胞中分泌IFN-γ的淋巴細胞。具體方法如下:純化的IFN-γ包被ELISPOT板,100 μl/孔,4℃靜置過夜后棄掉包被液,用10%小牛血清的1640做封閉液清洗ELISPOT板一次,加入封閉液200 μl/孔,室溫靜置2 h,棄去封閉液,拍干后加入10 μg/ml的稀釋肽50 μl/孔,終濃度為5 μg/L,同時加設50 μl/孔 刺激肽ConA的陽性對照。每孔加入脾細胞懸液50 μl,置于37℃含5%CO2孵育箱中24 h,棄去細胞液,無菌水沖洗2次,PBST沖洗3次。用稀釋液稀釋檢測抗體250倍后,加入培養板,每孔100 μl,室溫孵育2 h。棄去檢測抗體溶液,PBST沖洗3次,將酶標結合物稀釋100倍后100 μl/孔 加入培養板,室溫孵育1 h,棄去液體,PBST沖洗4次,PBS沖洗2次。加入底物溶液100 μl/孔,室溫顯色5 min,流水終止顯色反應,干燥后ELISPOT計數儀分析實驗結果。
1.2.4體液免疫應答檢測 末次免疫后2周,小鼠麻醉后內眥靜脈取血,分離血清,采用ELISA法檢測兩組小鼠血清中的IgG1和IgG2a抗體水平。具體方法如下:取未偶聯KLH多肽100 ng/孔包被ELISA檢測板,4℃靜置過夜,棄去包被多肽,PBST洗板5次后用10%小牛血清37℃封閉1 h后,棄去封閉液,PBST洗板5次。分別加入1∶100稀釋的待檢血清,37℃孵育1 h,棄去血清后PBST洗板5次,加入1∶5 000稀釋的辣根過氧化物酶標記的山羊抗小鼠抗體,37℃孵育1 h,移去二抗,PBST洗板5次,加入顯色液37℃5 min后,各孔加入2 mol/L H2SO4終止反應,以450 nm/630 nm雙波長讀取各孔OD值。實驗組/對照組的OD值≥2∶1為陽性。
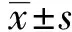
2 結果
2.1OMP31 T-B細胞聯合優勢抗原表位檢測 通過IEDB軟件在線分析OMP31蛋白抗原指數,篩選出了20個得分較高的區域,得分由高到低排列分別為:19~25、22~28、4~10、3~9、18~24、21~27、20~26、2~8、94~100、71~77、230~236、23~29、5~11、98~104、232~238、82~88、97~103、17~23、1~7、201~207(見圖1)。
通過DNAStar綜合分析篩選出了4個T-B細胞聯合優勢抗原表位,分別為:4~11、108~114、152~157、171~176區段(見表1)。這些區段有適當的抗原決定基特征,因此可能會有助于刺激細胞和體液免疫系統消除病原體,為構建多價布病疫苗的研究提供新的數據資料。
2.2重組OMP31 T-B表位可增強Th1免疫應答 ELISPOT計數脾細胞中分泌IFN-γ的淋巴細胞。如圖2所示: PBS組SFU為(2.08±0.99)/106細胞,T-B聯合表位組SFU為(90.08±19.05)/106細胞。ConA組SFU為(397.15±23.10)/106細胞。與PBS組相比,T-B聯合表位組SFU明顯增高,差異具有統計學意義(P<0.01,見圖2、3)。
圖1 OMP31蛋白抗原指數預測圖Fig.1 OMP31 protein antigen index prediction chart
表1T-B聯合表位
Tab.1CombinedT-Bepitope
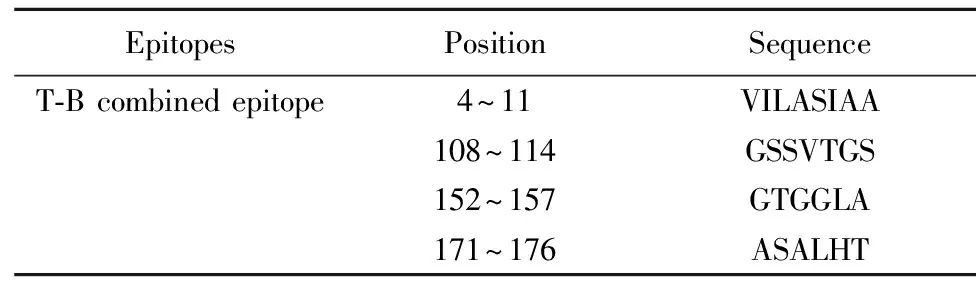
EpitopesPositionSequenceT-B combined epitope4~11VILASIAA108~114GSSVTGS152~157GTGGLA171~176ASALHT

圖2 ELISPOT 檢測結果Fig.2 Test results of ELISPOT
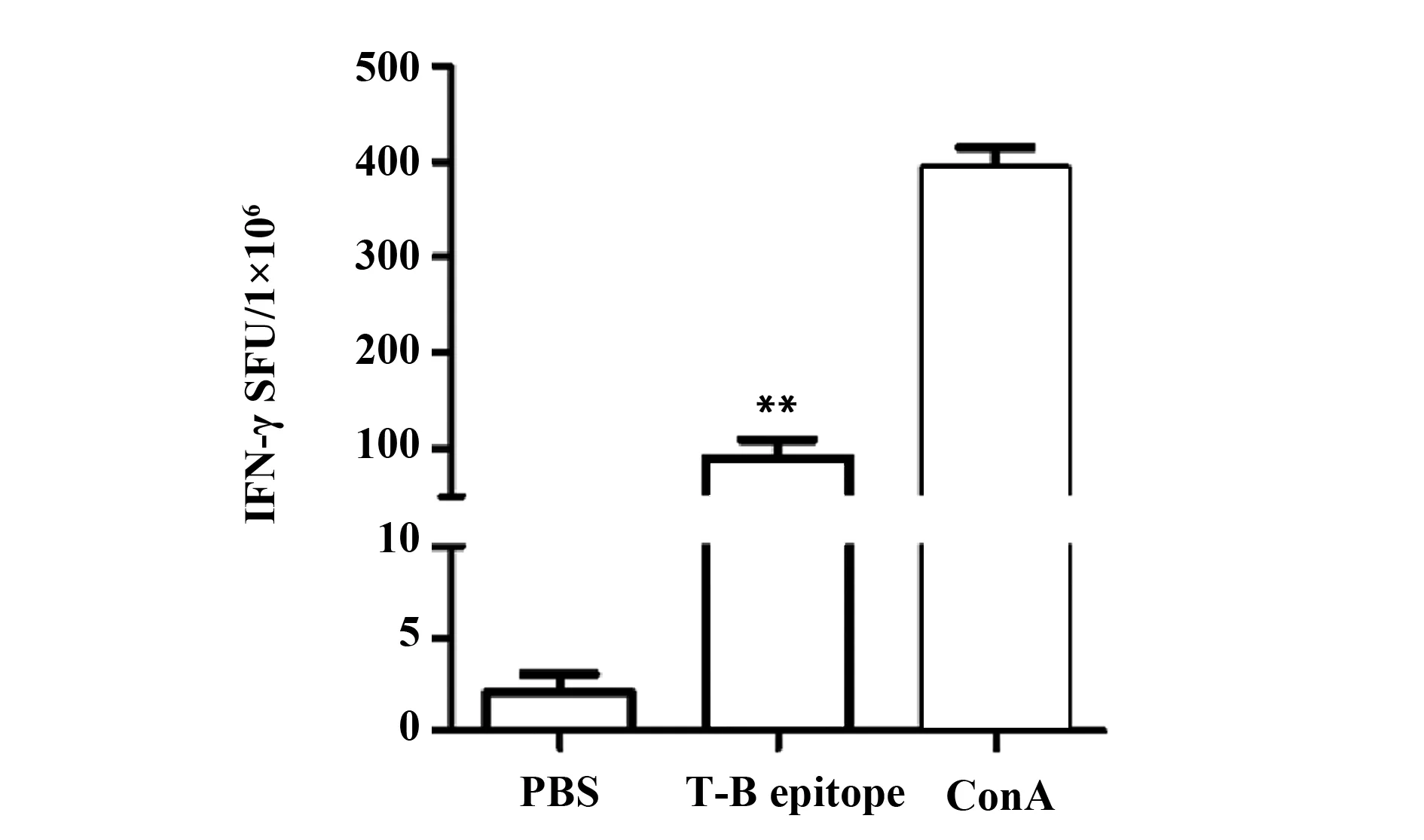
圖3 不同分組IFN-γ陽性T淋巴細胞斑點數Fig.3 SFU of IFN-γ-positive T lymphocyte in each groupNote: **.P<0.01 vs PBS.SFU(Spot forming units).
2.3重組OMP31 T-B表位可刺激小鼠產生IgG抗體 小鼠免疫結束后2周,ELISA法在1∶100稀釋血清中檢測出一定水平的IgG1和IgG2a抗體。PBS組IgG1水平0.13±0.06,T-B聯合表位組IgG1水平1.20±0.39,T-B聯合表位組IgG1水平高于PBS組,差異具有統計學意義(P<0.01)。PBS組IgG2a水平0.10±0.07,T-B聯合表位組IgG2a水平1.54±0.37,T-B聯合表位組IgG2a水平高于PBS組,差異具有統計學意義(P<0.01,見圖4)。
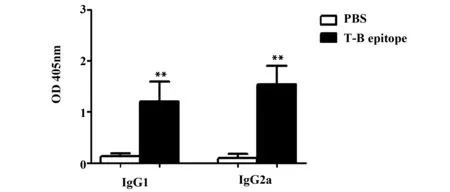
圖4 不同分組小鼠血清IgG1和IgG2a抗體水平Fig.4 Level of IgG1 and IgG2a antibody in serum of mice in each groupNote: **.P<0.01 vs PBS.
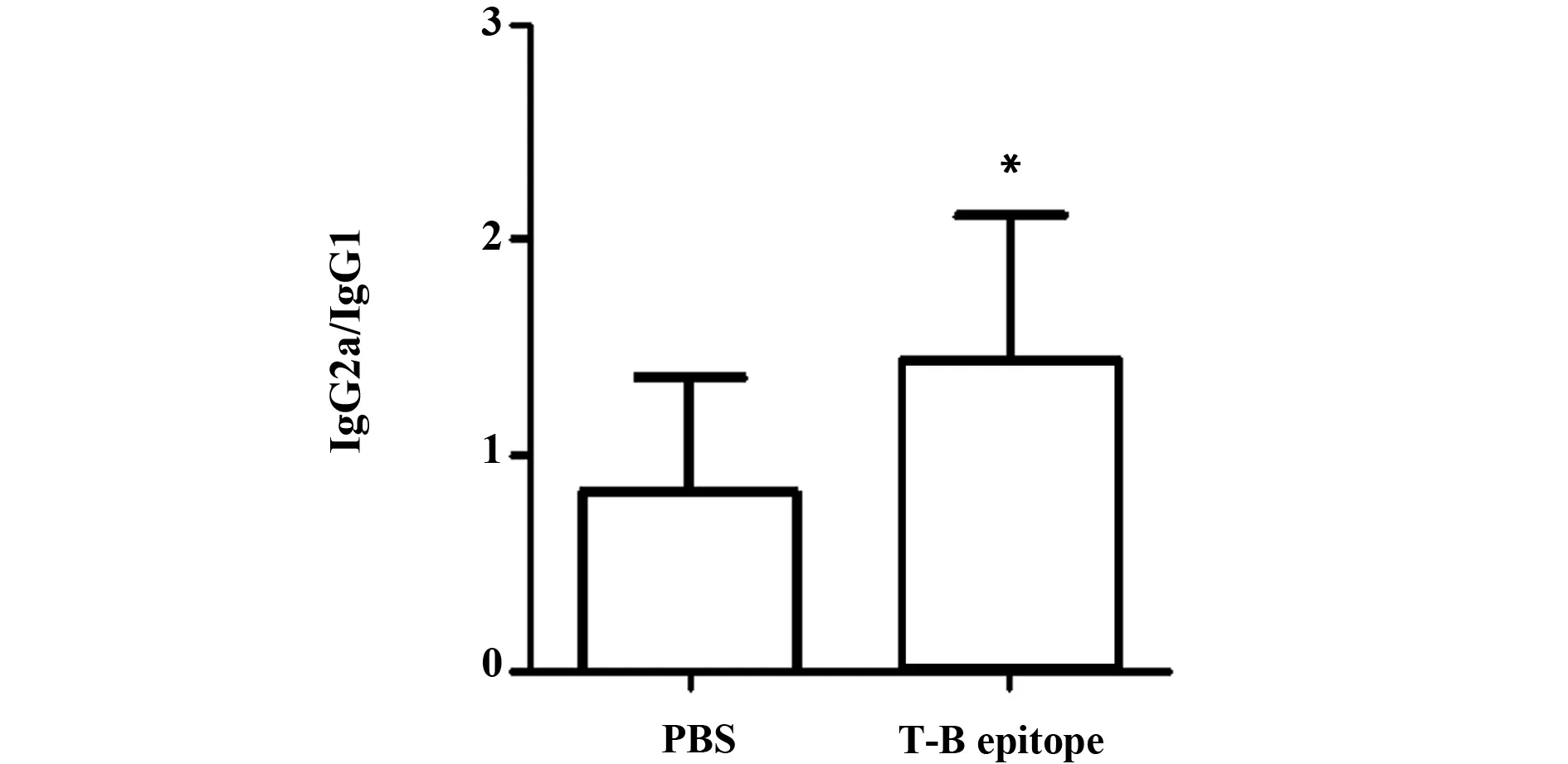
圖5 不同分組小鼠血清IgG2a/IgG1水平比較Fig.5 Level of IgG2a/IgG1 in serum of mice in each groupNote: *.P<0.05,vs PBS.
為進一步了解Th1/Th2平衡的情況,本研究檢測了IgG2a/IgG1水平,結果顯示T-B聯合表位組IgG2a/IgG1為1.45±0.67,PBS組IgG2a/IgG1為0.83±0.53。T-B聯合表位組IgG2a/IgG1高于PBS組,差異具有統計學意義(P<0.05,見圖5)。
3 討論
布病在我國多個省市都有較高的患病率,特別是在畜牧業迅速發展的新疆[10]。鑒于布病發病范圍廣且病情較難控制,研制預防控制布病的高效疫苗顯得尤為重要。目前針對布病研發的基因工程疫苗如表位疫苗、DNA疫苗、亞單位疫苗等均取得了一定進展,基因工程具有以下優勢[11]:其一,免疫持久,能刺激機體產生保護性免疫;其二,借助分子生物學基因重組技術,對不同抗原進行操作,從而達到使該種疫苗理想化的目的;其三,成本低、易使用、易于運輸和保存[12]。由于布魯氏菌為胞內寄生菌,有效的T細胞免疫反應對布魯氏菌的清除有最重要作用,因此DNA疫苗和亞單位疫苗的保護效果遠不如活減毒疫苗[13],而表位疫苗則有望取代常規布病減毒疫苗用于布病的防控。研制表位疫苗面臨的關鍵問題就是如何找到特異性抗原,抗原上免疫原性最強的區域即表位所在的位置[14]。
本研究顯示:與PBS組相比,T-B聯合表位組脾淋巴細胞中分泌IFN-γ的淋巴細胞、血清中IgG1、IgG2a抗體水平,均高于PBS組,差異具有統計學意義(P<0.01);且T-B聯合表位組IgG2a/IgG1高于PBS組,差異具有統計學意義(P<0.05)。表明基于OMP31的4個T-B聯合優勢抗原表位設計合成的肽段可以誘導免疫小鼠產生較強的Th1免疫應答和一定水平的體液免疫應答。淋巴細胞增殖分化是機體免疫應答過程中的一個重要階段,淋巴細胞增殖水平反映機體的細胞免疫狀態,CD4+T細胞在機體控制細菌增長繁殖中起關鍵作用,龐盼等[15]研究發現布魯氏菌病患者血清中IFN-γ表達降低,提示低水平的IFN-γ不利于布魯氏菌的清除。且大量研究表明Th1免疫應答在機體控制布魯氏菌感染的過程中在發揮重要作用[16,17]。體液免疫應答中抗原抗體相互作用同樣在控制感染中發揮關鍵作用,抗體可通過調解機體特定的免疫應答來消除抗原。一個保護性強的表位疫苗應含有B細胞和T細胞聯合優勢抗原表位,T細胞和B細胞聯合表位抗原可誘導宿主產生持久及高水平免疫應答,以便更有效地消除病原微生物[18]。
表位疫苗是控制預防布魯氏菌感染的有效途徑,表位的篩選與鑒定是表位疫苗的研究中最為關鍵的工作,而鑒定疫苗的標準之一就是表位的抗原性及刺激產生應答反應的強弱。本研究表明這4個T-B聯合表位有良好的免疫原性,具有作為布魯氏菌表位疫苗的潛質,為進一步研制布魯氏菌疫苗提供了科學參考。

