β-甘草次酸對炎癥相關胃癌的抑制作用及其機制
趙 丹,曹東慧,金美善,吳孟輝,王玥琦,楊 娜,周天宇,張厚君,姜 晶,曹雪源
(1.吉林大學第一醫院臨床研究部,吉林 長春 130021;2.吉林大學第一醫院病理診斷中心,吉林 長春 130021;3. 吉林大學第一醫院胃結直腸外科,吉林 長春 130021)
胃癌是常見惡性腫瘤之一,2012年全球有95.2萬新發胃癌病例,死亡72.3萬例[1]。2013年中國胃癌新發病例42.7萬,死亡30.1萬例[2]。探索胃癌發病機制,降低胃癌發病率是當務之急。炎癥反應與胃癌發生有密切關聯,通過調節和抑制胃黏膜炎癥反應從而降低胃癌發病是化學預防胃癌研究的熱點之一。研究[3]顯示:一些植物多酚類活性物質對胃炎和胃癌發病具有抑制作用,包括茶多酚和姜黃素等,然而目前對這些天然活性物質的抑癌機制尚有待深入研究。胃癌動物模型K19-C2mE轉基因鼠的胃黏膜高表達前列素內環氧化物合成酶2(prostaglandin endoperoxide synthase 2, PTGS2)和前列素E合成酶(prostaglandin E synthase, PTGES),環氧化酶2(cyclooxygenase-2, COX-2)/前列腺素E2(prostaglandin E2, PGE2)信號通路激活,胃黏膜自發出現明顯的炎癥反應和腫瘤[4-5]。在此基礎上,Oshima等[6]建立了另一種新型胃腫瘤動物模型—K19-Wnt/C2mE轉基因鼠模型,該動物胃黏膜內同時過表達COX-2/PGE2和Wnt信號通路,組織結構形態與人胃癌中的管狀腺癌相似,且與炎癥有密切關聯[7],該模型是研究胃癌發病機制和化學預防的重要模型之一。
18β甘草次酸(18β-glycyrrhetinic acid, 18β-GA)具有抗炎、抗潰瘍、抗腫瘤以及調節免疫功能等廣泛的生理活性。本課題組既往研究[8-10]顯示:18β-GA可明顯降低K19-C2mE轉基因鼠胃癌的發生率,同時可有效減輕胃黏膜炎癥反應,其機制可能是通過下調COX-2和白細胞介素1β(interleukin-1β,IL-1β)表達而實現。目前,同類研究大多局限于細胞系體外實驗,而本研究利用更接近人類胃癌的K19-Wnt/C2mE模型小鼠(簡稱Gan 小鼠),通過體內實驗研究18β-GA的抑癌作用,探討18β-GA是否通過降低炎癥反應、影響細胞分化從而抑制胃癌發生,為18β-GA化學預防胃癌提供理論依據。
1 材料與方法
1.1 實驗動物、主要試劑和儀器 K19-Wnt/C2mE轉基因小鼠(雄性小鼠3只,雌性小鼠5只,購自日本熊本大學實驗動物中心,動物合格證號:OS150CARDID:709)和C57BL/6N野生小鼠(雄性小鼠2只,雌性小鼠15只,購自維通利華實驗動物技術有限公司,動物合格證號:1140070018832)均為6周齡,體質量12~20 g,均在吉林大學SPF動物實驗室繁殖飼養。K19-Wnt/C2mE與C57BL/6N野生型小鼠交配,獲得子代小鼠。4周齡時剪取鼠尾檢測基因序列。將72只轉基因小鼠隨機分為18β-GA給藥組(n=36)和對照組(n=36)。投藥方法:從動物6周齡開始,18β-GA給藥組小鼠給予質量濃度為0.1%的18β-GA水溶液作為飲水,對照組小鼠給予正常飲水。2組小鼠飲水均新鮮配制,每周更換3次,2組小鼠均自由飲用。溫度(23℃±2℃)、濕度(50%±8%)、晝夜交替(12 h白晝交替)、飼料(SPF級)等均保持一致。52周后對小鼠進行麻醉解剖,取胃并沿胃大彎剖開,觀察記錄腫瘤形態,測量腫瘤直徑。兔抗Wnt-1、COX-2、Ki-67、F4/80和KCNE2多克隆抗體購自美國Abcam公司(貨號:ab15251、ab15191、ab15580、ab15580、ab69376),兔抗β-catenin單克隆抗體購自美國Cell Signaling Technology公司(貨號:0582s),兔抗ATP4a和胃蛋白酶原C(pepsinogen C,PGC)多克隆抗體購自德國Sigma公司(貨號:Merck 119102、HPA031718),檸檬酸鈉、PBS、山羊血清和二氨基聯苯胺(DAB)購自福建省福州市邁新生物技術開發有限公司,中性甲醛購自長春賽默瑞特科技有限公司,石蠟購自上海器械廠華靈康復有限公司,乙醇和二甲苯購自北京化工廠,中性樹脂封片劑購自中國上海標本模型廠。切片機購自德國萊卡公司,烘箱購自上海一恒科學儀器有限公司,顯微鏡購自日本奧林巴斯公司,冰箱購自中國海爾集團。
1.2 標本取材和形態觀察 標本離體后按照癌組織和癌旁組織、胃近端和遠端劃分分別取材。部分組織置于液氮冷凍,然后于-80℃深低溫保存。另一部分組織標本置于10%中性甲醛中固定、常規石蠟包埋切片。觀察2組小鼠胃組織形態表現。
1.3 HE染色 切片經65℃烘箱烘烤10 min后,常規采用二甲苯脫蠟,經各級乙醇梯度脫水至水洗:二甲苯2次,每次10 min;無水乙醇洗滌2次,90%乙醇和80%乙醇各1次,自來水洗滌后鹽酸酒精分化,氨水溶液洗滌30 s,伊紅染色1 min,自來水洗后脫水封片:80%乙醇和90%乙醇各1次,無水乙醇2次,二甲苯2次。中性樹脂封片。
1.4 免疫組織化學染色 切片經65℃烘干后,常規脫蠟,梯度水化,檸檬酸鈉高溫高壓抗原修復1.5 min,PBS洗滌3次各5 min;內源性過氧化酶阻斷劑5 min;蒸餾水浸泡后,正常山羊血清室溫封閉10 min;PBS洗滌3次各5 min;滴加一抗Wnt-1、COX-2、β-catenin、Ki-67、F4/80、ATP4a、KCNE2和PGC 100 μ L,室溫靜置1.5 h;PBS洗滌3次,各5 min;滴加HRP標記羊抗兔IgG抗體室溫靜置30 min;PBS洗滌3次,各5 min;DAB顯色,蘇木精復染3 min脫水封片。
結果判定采用組織化學評分(histochemistry score,H-score)系統評估染色強度及特定強度范圍內細胞染色百分比:H-score=Σpi(i)(i=0,1,2,3,pi=0~100%)。i代表腫瘤細胞的染色強度(無染色=0,弱染色=1,中度染色=2,強染色=3),pi是每一個強度下腫瘤細胞染色的百分比,范圍0~100%。H-score的總分為各強度得分之和,結果為0~300。
1.5 腫瘤組織病理學檢查結果的判定標準 病理學檢查結果分為輕度、中度和重度不典型增生。輕度不典型增生:細胞變圓上皮增厚,但細胞仍靠近基底膜一側,存在核分裂相,但細胞異型性所占比例不大;中度不典型增生:癌細胞核漿比增高,核異形性高,多見核分裂相,可見癌細胞以單層或多層排列成腺管狀,但細胞極性發生改變,且核大深染;重度不典型增生:細胞排列紊亂,腺管結構不規則,有的相互融合,呈分支狀或折疊狀,細胞極性喪失,細胞原形態徹底消失,呈柱狀或立方形,異型細胞較多。
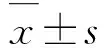
2 結 果
2.1 各組小鼠胃癌組織大體及鏡下形態表現 大體形態觀察顯示:野生型小鼠的胃黏膜光滑,未見糜爛、潰瘍或息肉增生等病變(圖1A,見插頁一);對照組小鼠的胃黏膜明顯肥厚,表面粗糙,呈顆粒狀,腫瘤呈菜花或息肉狀隆起(圖1B,見插頁一);18β-GA給藥組小鼠的胃腫瘤體積變小,雖然仍存在隆起,但瘤旁組織變光滑,并可見正常胃黏膜皺襞(圖1C,見插頁一)。

鏡下觀察:野生型小鼠胃黏膜呈現正常的組織學形態表現,黏膜及黏膜下層無炎性細胞浸潤,各層組織結構明顯、排列有序;對照組小鼠胃黏膜出現不同程度的不典型增生,根據病理學檢查結果分為輕度、中度和重度不典型增生。本模型胃腫瘤的特征是癌細胞局限于上皮層內而未突破基底膜向下浸潤,無侵襲或轉移。見圖2(插頁二)。

對照組小鼠胃黏膜輕度不典型增生2例,中重度不典型增生10只,胃癌24只;18β-GA給藥組小鼠輕度不典型增生1只,中重度不典型增生21例,胃癌14只。與對照組(38.9%)比較,18β-GA給藥組小鼠胃癌發病率(66.6%)明顯降低(P=0.019)。見表1。18β-GA給藥組小鼠腫瘤直徑[(1.28±0.51)cm]明顯小于對照組[(2.16±1.15)cm ](P<0.01)。
2.2 各組小鼠Ki-67和F4/80的H-score 免疫組織化學染色結果顯示:細胞增殖標志Ki-67陽性表達定位于胃黏膜上皮細胞核,呈淺棕或深棕色。對照組中有12只(32%)H-score為3分,15只(39%)H-score為2分,11只(29%)H-score為1分;18β-GA給藥組中有13只(37%)H-score為3分,16只(46%)H-score為2分,6只(17%)H-score為1分。2組小鼠H-score比較差異有統計學意義[92.5(85.0,96.5)vs55.0(40.0,62.5),P<0.01)]。
表1 對照組和18β-GA給藥組小鼠胃癌發病率和黏膜不典型增生發生率
Tab.1 Incidence of gastric cancer and incidence of dysplasia of gastric mucosa of mice in control group and 18β-GA treatment group

(n=36,η/%)
巨噬細胞F4/80染色結果顯示:對照組小鼠胃黏膜內和黏膜下存在大量巨噬細胞,18β-GA給藥組小鼠胃黏膜上皮大部分細胞為陰性染色,間質存在少量巨噬細胞浸潤;對照組和18β-GA給藥組小鼠H-score[180(120,210)vs90(60,150)]比較差異有統計學意義(P<0.01)。對照組小鼠胃黏膜上皮細胞間及固有層可見大量淋巴細胞及中性粒細胞浸潤,以淋巴細胞浸潤為主。18β-GA給藥組小鼠炎癥反應明顯減輕,可見部分細胞排列紊亂。見圖3(插頁二)。

2.3 2組小鼠ATP4a、KCNE2和PGC的H-score ATP4a表達陽性染色主要集中于胃壁細胞的細胞膜。KCNE2蛋白陽性表達集中在細胞質,PGC陽性表達主要集中在胃腺體部位,18β-GA組小鼠胃黏膜大部分細胞的細胞膜為深棕色的ATP4a陽性染色,KCNE2和PGC的陽性表達升高。見圖4(插頁二)。2組小鼠ATP4a、KCNE2和PGC陽性表達率比較差異有統計學意義(P=0.045,P=0.007,P=0.021)。見圖5。
2.4 2組小鼠Wnt-1和COX-2和β-catenin的H-score 對照組小鼠Wnt-1和COX-2蛋白主要表達于細胞質中,對照組較18β-GA給藥組小鼠Wnt-1和COX-2的H-score降低(P<0.01)。對照組小鼠β-catenin在細胞質或細胞核中表達,18β-GA給藥組小鼠β-catenin在細胞質或細胞核中少量表達,見圖6(插頁二)。2組小鼠Wnt-1、β-catenin和COX-2的H-score比較差異有統計學意義(P<0.01)。見圖7。

A: ATP4a;B: KCNE2; C: PGC.
3 討 論
現代研究[11-12]證實:藥食兩用植物甘草的主要成分之一18β-GA是由三萜類化合物甘草甜素水解后脫去兩分子萄糖醛酸的產物,具有較強的抗炎、抗潰瘍、抗腫瘤及增強免疫功能等作用[13-14]。迄今,雖然一些研究[15-16]顯示 18β-GA 對胃癌細胞系生長具有抑制作用,但是缺乏體內實驗證據。Gan小鼠作為炎癥相關的胃癌模型,在小鼠近端胃黏膜出現局部隆起型腫瘤,能近似模擬人胃癌的發病過程。本研究體內實驗證實18β-GA可以有效抑制胃黏膜細胞增殖,降低炎癥反應,促進細胞分化,減少癌前病變,降低胃癌發病率。腫瘤發生涉及細胞增殖、分化、黏附、遷移和細胞凋亡等多個步驟。H+-K+-ATP酶的分子結構包括α和β蛋白質亞基[17],H+-K+-ATP酶的α亞基(即ATP4a)在胃壁細胞中表達,特別是在分泌性小管的細胞質囊泡或頂端血漿膜中,ATP4a催化ATP水解,與血漿膜上的H+和K+離子交換相結合,負責胃酸分泌。Judd 等[18]報道:H+-K+-ATP敲除的小鼠,胃上皮壁細胞的細胞膜完成性受到破壞,8個月后胃腺管增厚2倍。12和20個月后出現胃黏膜增生,1年后發現腸化生,黏蛋白實現從中性到酸性的轉變, CD44表達水平上調,最終出現胃腫瘤。本研究結果證實:18β-GA給藥后,小鼠胃組織中ATP4a表達水平升高,細胞進一步分化,泌酸能力增強。


A: Wnt-1;B: β-catenin; C: COX-2.
PGC主要由胃底腺的主細胞和頸黏液細胞等分泌,在酸性條件下可轉化為具有消化功能的胃蛋白酶,PGC標志著胃黏膜細胞的分化成熟[17]。研究[19]表明:PGC在腫瘤中廣泛表達,其可能與腫瘤細胞增殖、分化、浸潤和遷移過程中激素水平變化有關。PGC水平的變化可以反映胃黏膜病變和分化程度,與萎縮性胃炎、不典型增生及癌變等有關。Fernandez等[20]發現:PGC在高、中和低分化胃癌組織中陽性表達率依次降低。本研究結果顯示:18β-GA可以提高PGC水平,說明18β-GA能夠促進胃黏膜上皮細胞分化,改善胃黏膜功能。
Wnt/β-catenin信號通路在胃癌發生發展過程中起關鍵作用。Wnt/β-catenin異常激活與腫瘤的發生發展有密切關系[21],腫瘤干細胞分化通常伴有Wnt/β-catenin通路的激活以及β-catenin水平升高。當Wnt 信號通路被激活時,胞漿內活化的Dishevelled 蛋白介導PGC磷酸化GSK-3β,使GSK-3β失去活性不能磷酸化β-catenin,致使β-catenin不被降解而蓄積在胞漿,并轉移入細胞核內與核轉錄因子中的T細胞轉錄因子(T-cell factor,TCF)/淋巴增強因子(lymphoid enhancer factor, LEF )結合,形成β-catenin /TCF/LEF 轉錄復合物并啟動Wnt 靶基因轉錄,從而導致腫瘤干細胞分化成腫瘤[22],Wnt/β-catenin參與了炎癥微環境下細胞的分化,Wnt 通路激活可促進COX-2/PGE2 信號通路的表達使機體產生炎癥微環境。COX-2 /PGE2是胃癌發生過程中的重要途徑之一[23-25]。COX-2表達與IL-1β誘導的NF-κB轉錄活性激活有密切關聯,COX-2基因于轉錄水平被激活,進而引起蛋白表達導致炎癥反應的發生。
綜上所述,18β-GA處理后小鼠胃組織中Ki-67和F4/80的H-score明顯降低,ATP4a、KCNE2和PGC的H-score明顯升高,Wnt/β-catenin和COX-2信號通路被抑制,表明18β-GA可能通過調控Wnt和COX-2信號通路抑制細胞增殖,降低炎癥反應,促進細胞分化,進而抑制了胃癌的發生發展。

