NMN在糖尿病腎病大鼠腎臟纖維化中的作用及其機制
崔 奇,王曼伊,農琳琳,翟曉雅,馮樂平
(1.桂林醫學院公共衛生學院食品衛生與營養教研室,廣西 桂林 541004;2.桂林醫學院第一附屬臨床醫院優生優育科, 廣西 桂林 541004; 3.桂林醫學院基礎醫學院實驗教學中心,廣西 桂林 541004)
叉頭轉錄因子3a(Forkhead box O3a,FoxO3a)作為FoxO家族成員之一,通過調控下游靶基因,在細胞凋亡、自噬、氧化應激、細胞分化和細胞代謝等過程中發揮重要作用[1-4]。p-FoxO3a能夠通過細胞凋亡和細胞自噬作用[5]促進成纖維細胞凋亡和自噬,以及抑制上皮-間質轉化(epithelial mesenchymal transformation, EMT)基因表達[6],從而減緩組織纖維化進程。研究顯示:沉默信息調節因子1(silent information regulator,Sirt1)能夠導致p-FoxO3a去乙酰化,上調p-FoxO3a表達,進而阻止氧化應激對組織細胞帶來的損傷;p-FoxO3a也同樣受到蛋白激酶B(AKT)在不同位點的磷酸化調控,從而在調節細胞凋亡和抵抗氧化應激等方面發揮作用。本文作者采用動物模型和高糖濃度培養腎小球系膜細胞(HBZY-1)對糖尿病引起的腎實質細胞炎性-纖維化進行研究,通過煙酰胺單核苷酸(NMN)調控Sirt1和AKT,間接影響p-FoxO3a和小窩蛋白(caveolin-1,Cav-1)表達,闡明NMN減緩糖尿病腎病(diabetic nephropathy,DN)大鼠腎臟纖維化的作用機制。
1 材料與方法
1.1 主要試劑和儀器 0.56 mmol·L-1DMEM培養基(Dulbecco公司,美國),10%胎牛血清(Gemini公司,美國),胰蛋白酶(工作液濃度0.25%)、青霉素和鏈霉素(終濃度分別為100 U·L-1和100 kg·L-1)(Solarbio公司,中國),鏈脲佐菌素(streptozotocin,STZ)(Sigma-Aldrich公司,德國),煙酰胺和NMN(Sigma 公司,美國),Sirt1單抗(Abcam公司,英國),兔抗大鼠( Cav-1)單抗(Santa公司,美國),抗大鼠AKT單抗(Bioword 公司,美國),FoxO3a和p-FoxO3a單抗(Abcam公司,英國),FITC標記的羊抗兔多抗和Cy3標記的羊抗兔多抗(LIFE公司,美國)。血糖診斷試劑盒(Omron公司,日本),GT-1640血糖檢測儀(ARKRAY有限公司,日本),Cobas111 全自動生化分析儀(Roche公司,美國),LSM700激光共聚焦掃描顯微鏡(Zeiss公司,德國),Mini-PROTEAN 3 CELL 165-3301電泳系統和小型垂直電泳轉印系統(Bio-Rad公司,美國)。
1.2 動物分組和給藥 SD大鼠50只,雄性,體質量 200~250 g,由桂林醫學院實驗動物中心提供。大鼠于標準聚丙烯鼠籠中飼養,室溫(23±1)℃,濕度50%~60%,12 h光/暗光照周期,1周后隨機分為對照組(n=10,采用正常飲食,常規食物包括:脂肪5%、碳水化合物63%、蛋白質23%、總熱值25 kJ·kg-1)和實驗組(n=30,采用高脂肪飲食,高脂肪食物包括:脂肪32%、碳水化合物48%、蛋白質20%,總熱值54.3 kJ·kg-1)。2組大鼠均采用滅菌的自來水作為飲用水。實驗組大鼠平均體質量為(300±20)g,注射50 mg·kg-1STZ,以0.01 mmol·L-1冰鎮檸檬酸緩沖液(pH 4.5)溶解,在30 min內通過腹腔注射。對照組大鼠使用檸檬酸鹽緩沖液注射。隨后從尾靜脈中采集血液樣本,用于葡萄糖水平測定,當空腹血糖水平 持續達到16.7 mmol·L-1時,SD大鼠被認為是糖尿病模型大鼠。30只實驗組糖尿病大鼠進一步隨機分為糖尿病+NMN組和糖尿病+PBS組(每組15只);糖尿病+NMN組大鼠靜脈注射NMN(120 mg·kg-1)(NMN應用200 μL無菌磷酸鹽緩沖液稀釋),每隔1 d在頸部和肩部松散組織皮下注射,持續20 d;糖尿病+PBS組大鼠皮下注射接種200 μL無菌PBS,每隔1 d在頸部和肩部松散組織皮下注射,持續20 d,之后斷頭處死大鼠,摘取腎臟進行組織切片和蛋白提取,分別用于目的蛋白免疫印跡分析及免疫共聚焦分析。本研究經桂林醫學院實驗動物倫理審查委員會批準。
1.3 細胞培養 大鼠腎小球系膜HBZY-1細胞系購自中國醫學科學院基礎醫學研究所。細胞保存于正常濃度葡萄糖(5.6 mmol·L-1)條件下,置于含10%胎牛血清的DMEM培養基中,于體外37℃、5% CO2條件下適應性培養24 h,之后在高濃度葡萄糖(200 mmol·L-1)氧化應激條件下繼續培養1~6 d,并隔天更換相同條件培養基。高濃度葡萄糖培養細胞按照給予NMN濃度的不同,隨機分為0、50、100和200 μmol·L-1NMN組,并設對照組(未加入高濃度葡萄糖),繼續培養24 h后收集細胞,提取蛋白用于相關目的蛋白的免疫印跡分析。
1.4 免疫共聚焦法檢測大鼠腎小球細胞中Sirt1、AKT、p-FoxO3a和Cav-1蛋白表達水平 4%多聚甲醛固定大鼠腎組織,脫水后石蠟包埋并切片,組織切片經脫蠟和乙醇梯度脫水,枸櫞酸微波修復后,加待檢蛋白一抗:抗 Sirt1(1∶500)、AKT(1∶1 000)、p-FoxO3a(1∶1 000)和Cav-1(1∶400)單抗進行孵育,4℃冰箱靜置過夜,加入相應熒光標記的二抗(1∶1 000),37℃避光孵育 1 h;采用 PBS洗滌 3 次,DAPI 避光染色5 min ,N-丙基沒食子酸鹽(N-propyl gallate,NPG)(抗熒光淬滅劑)處理后樹脂膠封片,共聚焦顯微鏡下檢測大鼠腎小球細胞質和細胞核中Sirt1、AKT、p-FoxO3a和Cav-1蛋白表達水平。綠色熒光代表腎小球細胞中AKT和p-FoxO3a表達,紅色熒光代表腎小球細胞中Sirt1和Cav-1蛋白表達,采用 ImageJ 2×軟件計算10個視野的平均熒光強度,以熒光強度表示單位面積蛋白表達水平。
1.5 Western blotting法檢測HBZY-1細胞中Sirt1、AKT、p-FoxO3a和Cav-1蛋白表達水平 將1 mL含1×106mL HBZY-1細胞懸液移至直徑為35 cm的培養皿中,增加葡萄糖濃度至200 mmol·L-1,培養6 d后分別加入NMN,濃度分別為 0、50、100和200 μmol·L-1,繼續培養細胞24 h后,收集并裂解細胞提取蛋白,采用Western blotting法檢測高濃度葡萄糖條件下HBZY-1細胞中Sirt1、AKT和p-FoxO3表達水平。取出培養細胞加入細胞裂解液置于 Eppendorf 離心管中,超聲波粉碎儀裂解蛋白,經4℃低溫12 000 g、15 min離心取上清液;蛋白定量后行SDS-PAGE電泳,電壓 120 V,PVDF 半干式轉膜(電壓150 V、60 min),牛血清白蛋白封閉濾膜,加入待檢蛋白一抗[Sirt1(1∶500)、AKT(1∶200)、p-FoxO3a(1∶1 000)和Cav-1(1∶600)],4℃孵育過夜,次日加入相應二抗(1∶2 000)后孵育1 h,將 PVDF 膜置于凝膠成像系統中獲取相應蛋白條帶的積分吸光度(integrated absorbance,IA)值,計算蛋白相對表達水平。蛋白相對表達水平=目標蛋白的IA值/β-actin的IA值。
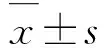
2 結 果
2.1 2組大鼠腎實質細胞中Sirt1和AKT蛋白表達水平 免疫共聚焦檢測結果顯示:與糖尿病+PBS組比較,糖尿病+NMN組大鼠腎小球體積相對較小,細胞排列比較密集,且雜亂無章。糖尿病+NMN組大鼠腎臟實質細胞中Sirt1(紅色熒光)表達水平明顯高于糖尿病+PBS組(P<0.01),糖尿病+NMN組大鼠腎實質細胞中AKT(綠色熒光)表達水平亦高于糖尿病+PBS組(P<0.01)。見圖1(插頁二)和2。
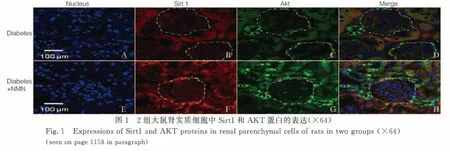
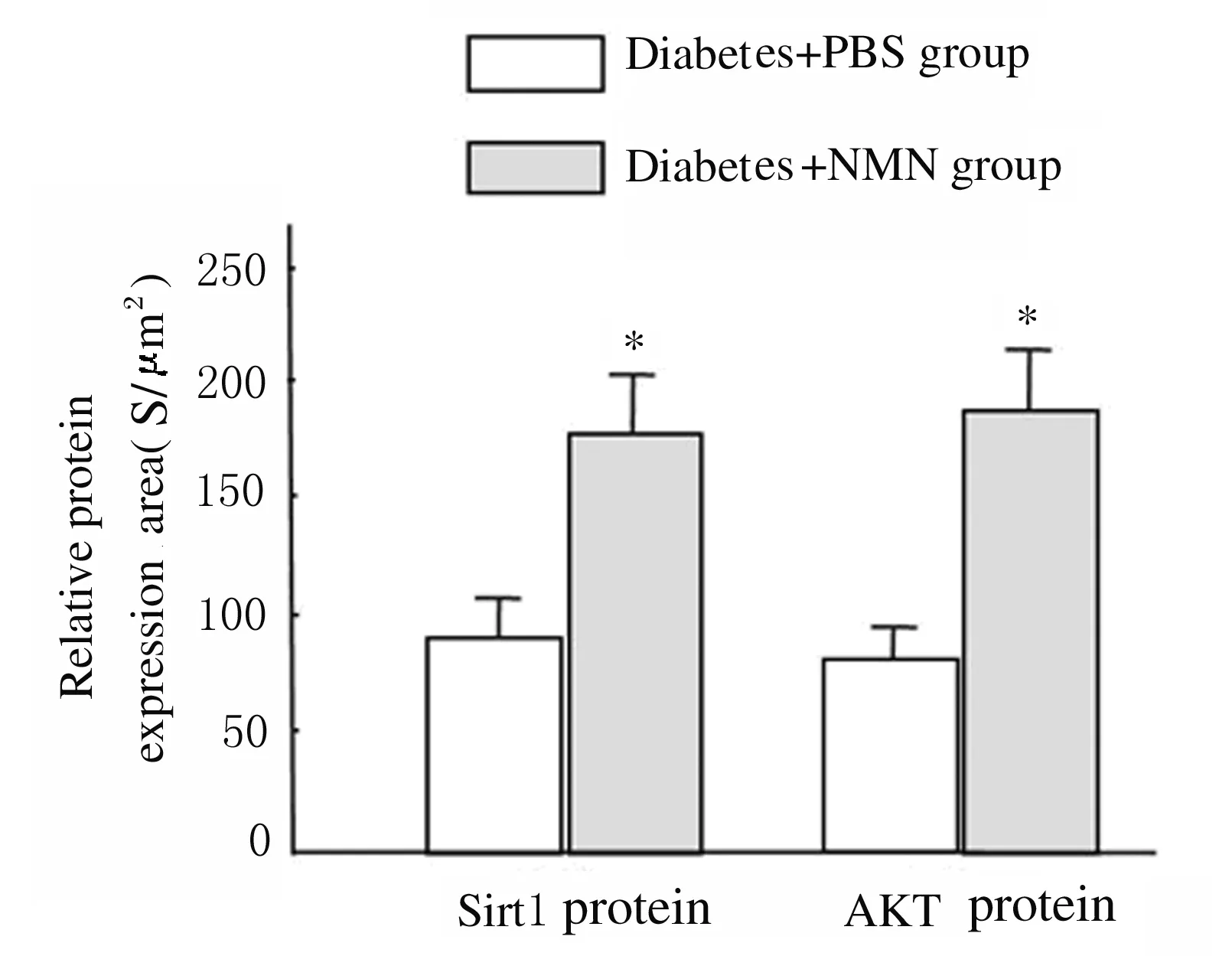
*P<0.01 compared with diabetes+PBS group.
Fig.2 Expression levels of Sirt1 and AKT proteins in renal parenchymal cells of rats in two groups
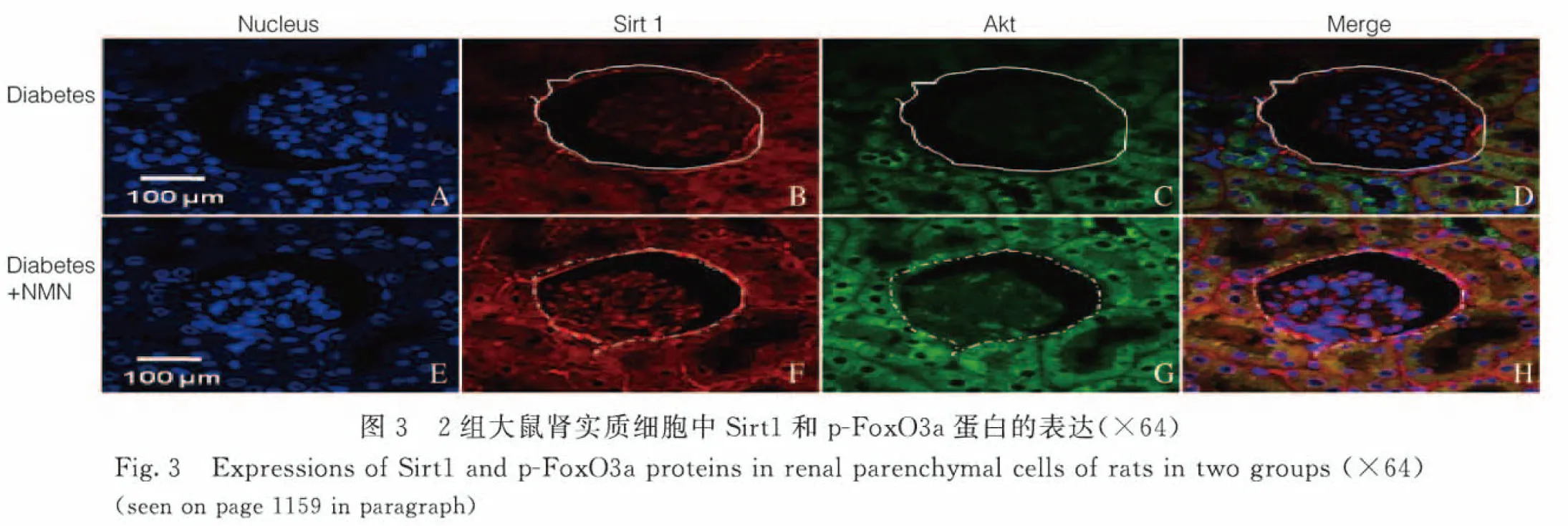
2.2 2組大鼠腎實質細胞中Sirt1和p-FoxO3a蛋白表達水平 與糖尿病+PBS組比較,糖尿病+NMN組大鼠腎實質細胞中Sirt1(紅色熒光)蛋白表達水平明顯升高(P<0.01),且大鼠腎實質細胞中p-FoxO3a表達(綠色熒光)水平亦明顯升高(P<0.01)。免疫共聚焦檢測結果顯示:腎小管細胞中p-FoxO3a蛋白表達(綠色熒光)在腎小管細胞中的分布多于腎小球細胞,說明腎小管細胞中p-FoxO3a蛋白表達多于腎小球細胞。見圖3(插頁三)和4。
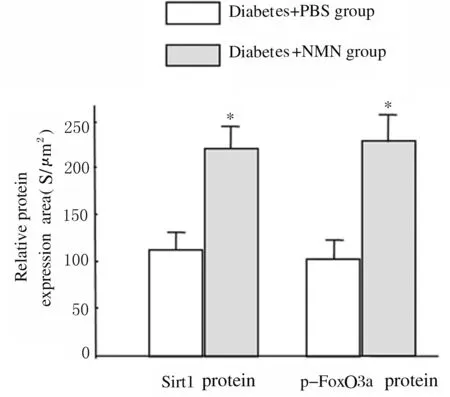
*P<0.01 compared with diabetes+PBS group.
圖4 2組大鼠腎實質細胞中Sirt1和p-FoxO3a蛋白表達水平
Fig.4 Expression levels of Sirt1 and p-FoxO3a proteins in renal parenchyma cells of rats in two groups
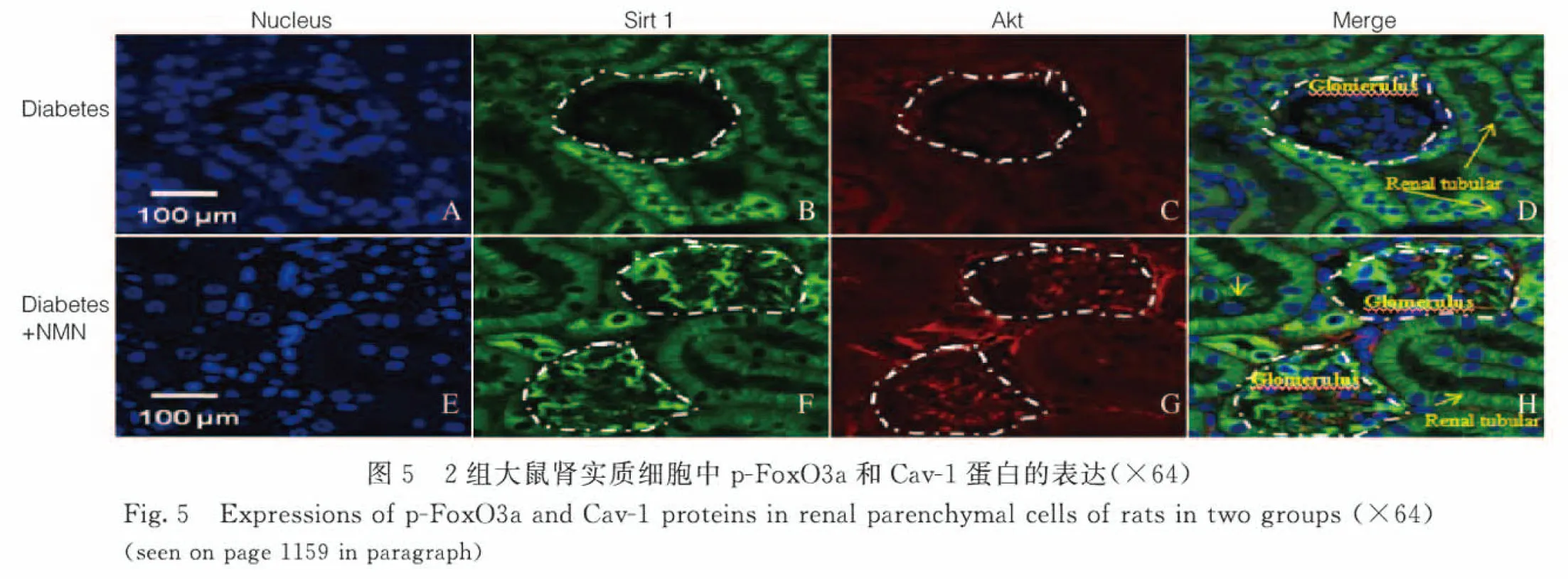
2.3 2組大鼠腎實質細胞中p-FoxO3a和Cav-1蛋白表達水平 免疫共聚焦檢測結果顯示:與糖尿病+PBS組比較,糖尿病+NMN組大鼠腎小管和腎小球細胞中p-FoxO3a蛋白(綠色熒光)表達水平明顯升高(P<0.01),腎小管和腎小球細胞中Cav-1蛋白表達水平亦明顯升高(P<0.01)。見圖5(插頁三)和6。
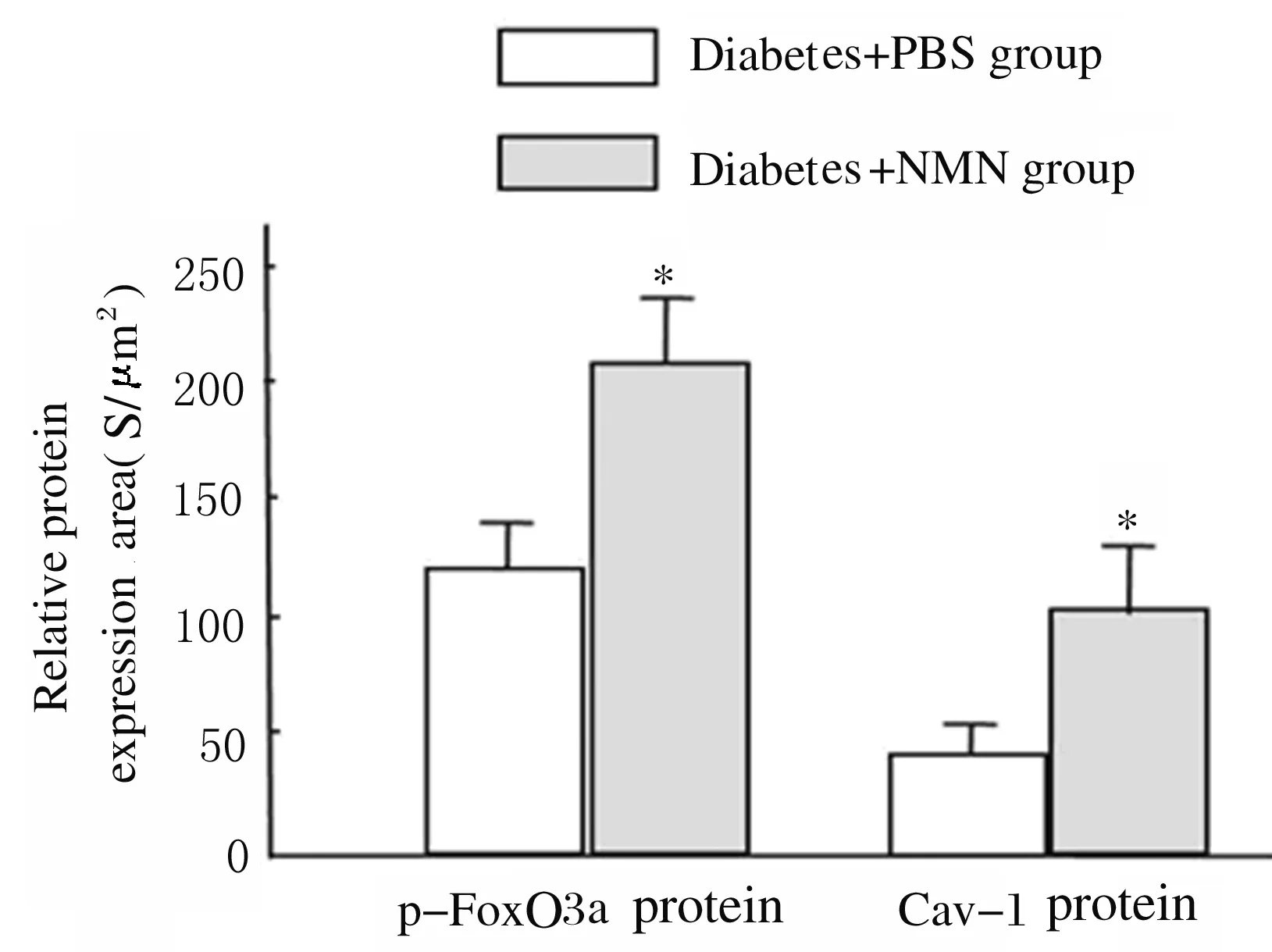
*P<0.01 compared with diatetes+PBS group.
圖6 2組大鼠腎臟實質細胞中p-FoxO3a和Cav-1蛋白表達水平
Fig.6 Expression levels of p-FoxO3a and Cav-1 proteins in renal parenchyma cells of rats in two groups
2.4 各組HBZY-1細胞中SIRT1、AKT和p-FoxO3a蛋白表達水平 Western blotting 檢測結果顯示:200 mmol·L-1葡萄糖處理HBZY-1細胞72 h后,分別加入不同濃度(0、50、100和200 μmol·L-1)NMN處理24 h,與對照組(未經200 mmol·L-1葡萄糖處理)比較,50 μmol·L-1NMN組HBZY-1細胞中Sirt1和AKT蛋白表達水平升高(P<0.05),100和200 μmol·L-1NMN組HBZY-1細胞中Sirt1和AKT蛋白表達水平明顯升高(P<0.01)。與對照組比較,50 μmol·L-1NMN組HBZY-1細胞中p-FoxO3a蛋白表達水平差異無統計學意義(P>0.05),但100和200 μmol·L-1NMN組HBZY-1細胞中p-FoxO3a蛋白表達水平明顯升高(P<0.05)。見圖7和8。
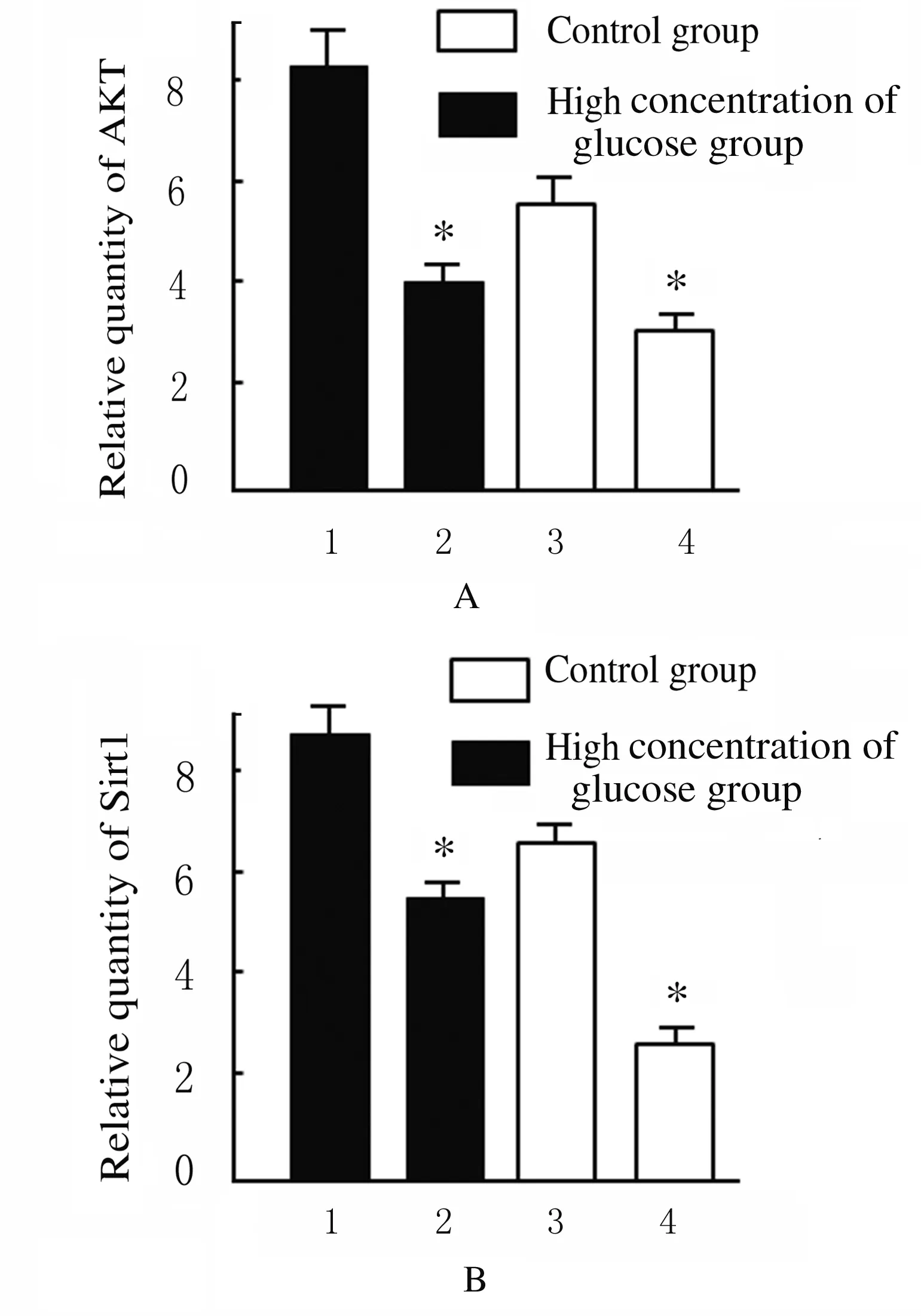
2.5 不同濃度葡萄糖培養的HBZY-1細胞中AKT和Sirt1蛋白表達水平 采用正常濃度葡萄糖(5.6 mmol·L-1)和高濃度葡萄糖(200 mmol·L-1)分別處理HBZY-1 細胞,隨后應用NMN分別干預24 h。在正常葡萄糖濃度或高濃度葡萄糖培養條件下,細胞中AKT與Sirt1蛋白表達水平均較對照組(5.6 mmol·L-1葡萄糖+0 μmol·L-1NMN)明顯升高(P<0.01),說明NMN在調節細胞表達內源性AKT與Sirt1過程中發揮重要作用。見圖9和10。
3 討 論
p-FoxO3a蛋白在應對氧化應激時具有雙重作用,當細胞發生氧化應激時,細胞處于胰島素抵抗狀態,細胞中的PI3K/AKT信號傳導途徑受阻,細胞質中大量p-FoxO3a蛋白集聚到細胞核,參與誘導細胞凋亡[7]。p-FoxO3a蛋白是AKT分子下游能夠啟動自噬基因轉錄的主要分子,其過度表達能夠啟動細胞自噬,并且能夠促使成纖維細胞分泌膠原明顯減少,從而改善細胞炎癥-纖維化過程[8-9]。有學者在基因序列分析時發現:Cav-1啟動子基因內包含了幾個p-FoxO3a結合位點,使p-FoxO3a牢固地綁定到Cav-1啟動子區域,p-FoxO3a轉錄表達增加了Cav-1 mRNA和蛋白表達。研究[11]顯示:通過改變AKT通路能夠使p-FoxO3a蛋白激活,進而增強成纖維細胞自噬活性,促進膠原蛋白降解,可以促進肺部纖維化形成。而具有去乙酰化酶活性的沉默信息調節因子Sirt1能夠使p-FoxO3a蛋白發生去乙酰化作用,并促使其進入細胞核進而調節細胞生長阻滯。然而,在氧化應激狀態下,隨著p-FoxO3a蛋白去乙酰化作用增強,p27kip1、Bim和MnSOD等基因表達水平升高,從而降低細胞中的活性氧水平,發揮抗凋亡作用。激活AKT軸能夠通過抑制細胞自噬,促進特發性肺纖維化的成纖維細胞維持膠原蛋白形成的病理狀態[12],說明細胞凋亡是細胞纖維化形成的重要因素[6,13-14]。但p-FoxO3a蛋白在DN腎臟纖維化方面的調控作用尚不清楚。本研究結果表明:在機體處于糖尿病腎臟逐步纖維化過程中,腎小球和腎小管細胞中內源性Sirt1和AKT蛋白表達水平均明顯降低。本課題組應用NAMPT的代謝產物NMN通過負反饋調節,在改善作為前炎癥因子NAMPT表達的前提下,試圖提高Sirt1蛋白的表達和活性,通過Sirt1-p-FoxO3a和AKT-p-FoxO3a對DN腎臟纖維化的相關基因發揮作用。本研究結果表明:SD糖尿病大鼠在應用一定量NMN后,腎小管和腎小球細胞中Sirt1和AKT蛋白表達水平均較未施加NMN的對照組明顯升高。與此同時,糖尿病+NMN組大鼠腎細胞中p-FoxO3a和Cav-1蛋白表達水平也明顯高于對照組。體外實驗中,應用高濃度葡萄糖(200 mmol·L-1)處理 HBZY-1細胞后,再應用不同濃度NMN處理,細胞中AKT與Sirt1也均較未施加NMN組增加。本研究結果顯示:當NMN濃度達100 μmol·L-1時,Sirt1與AKT蛋白表達水平均達到峰值,且均明顯高于對照組,在相同高濃度葡萄糖糖濃度培養條件下,當NMN濃度進一步加大到200 μmol·L-1時,細胞中Sirt1與AKT蛋白表達水平均未見明顯升高,說明NMN能夠使糖尿病狀態下大鼠腎小球和腎小管細胞中Sirt1與AKT蛋白表達水平升高,即NMN能夠在高濃度葡萄糖氧化應激狀態下使HBZY-1細胞中Sirt1與AKT蛋白表達水平明顯升高。在此過程中,經NMN處理的細胞中 p-FoxO3a和Cav-1蛋白表達水平也出現明顯升高趨勢。共聚焦顯微鏡下顯示:糖尿病大鼠腎小球明顯變小,且腎小球內細胞排列雜亂無章,呈明顯的纖維化狀態,但給予NMN后大鼠腎小球形狀明顯比未施加NMN時規整,腎小球內細胞排列有序,說明NMN通過增加腎臟細胞表達Sirt1與AKT蛋白,間接激活了p-FoxO3a和Cav-1蛋白表達,從而在一定條件下改善了DN腎臟炎性纖維化過程。本實驗結果充分說明了NMN能夠通過Sirt1-p-FoxO3a和AKT-p-FoxO3a對DN腎臟纖維化的相關基因發揮作用。NMN既是煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)前體物質,又是Nampt合成的底物。在正常情況下,Nampt是細胞合成DNA的關鍵限速酶[15]。然而,在機體處于氧化應激狀態下,Nampt能夠作為前炎癥因子激活典型的炎癥通路因子轉錄因子κB(NF-κB),啟動炎癥-纖維化通路[16-17]。離體實驗[18-19]結果表明:在200 mmol·L-1葡萄糖氧化應激條件下,50 μmol·L-1以上NMN即能夠通過負反饋抑制內源性Nampt表達,同時在不影響NAD+形成的基礎上,促進Sirt1和AKT蛋白表達水平升高[18-19]。本研究結果提示:NMN能夠提高糖尿病大鼠腎小球細胞中內源性Sirt1與AKT的表達水平,并改善p-FoxO3a蛋白的表達和磷酸化狀態,從而通過Cav-1改善腎臟細胞的炎癥纖維化狀態,提示NMN及其類似物可能在預防和治療DN腎小球纖維化中發揮作用。有研究[20-21]進一步證明:在NMN的作用過程中,Sirt1蛋白能使p-FoxO3a的乙酰基遷移,使p-FoxO3a蛋白發生去乙酰化反應,從而上調p-FoxO3a蛋白與特定靶基因的DNA結合能力并增加其轉錄活性。Sirtuins是一種NAD+依賴性的去乙酰化酶,即Sirtuins的去乙酰化反應需要氧化性的NAD+參與[22]。內源性Sirt1蛋白通過加強p-FoxO3a蛋白誘導細胞周期阻滯,允許細胞具有更多時間來修復損傷的DNA,并消除自由基的危害[23]。本研究結果顯示:在糖尿病大鼠腎臟實質細胞中, p-FoxO3a蛋白能夠同時受到Sirt1和AKT蛋白的共同調控,這一結果提示NMN可能在DN腎小球炎癥纖維化過程中發揮作用。
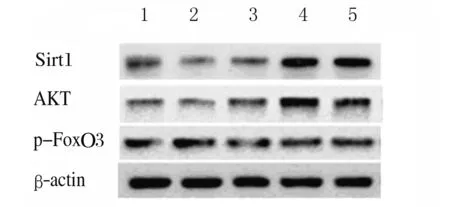
Lane 1:Control group;Lane 2-5:50, 100, and 200 μmol·L-1NMN groups.
圖7 各組HBZY-1細胞中Sirt1、AKT和p-FoxO3a蛋白表達電泳圖
Fig.7 Electrophoregram of expressions of Sirt1, AKT, and p-FoxO3a proteins in HBZY-1 cells in various groups
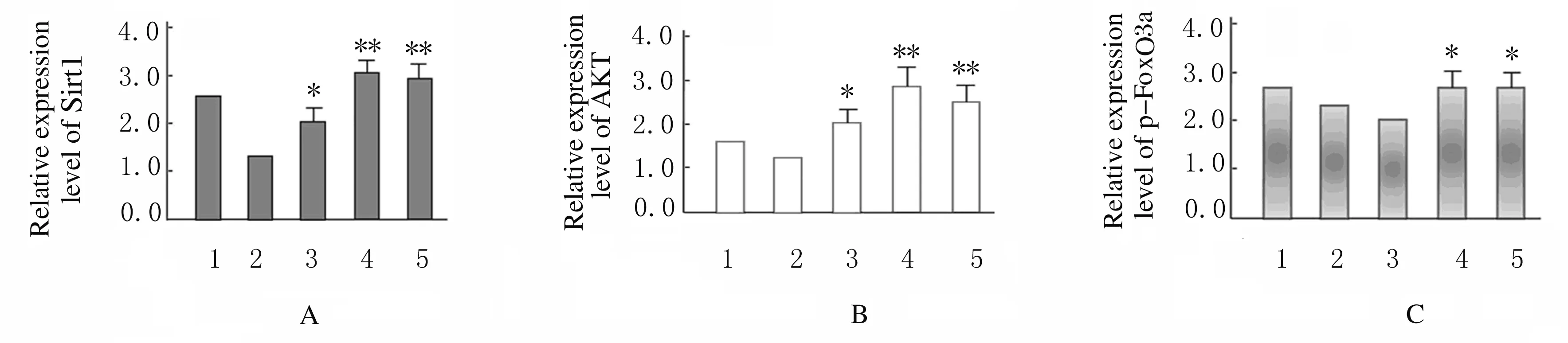
A:Sirt1;B:AKT;C:p-FoxO3a.1:Control group;2-5:50,100,and 200 μmol·L-1 groups.*P<0.05, **P<0.01 compared with control group.
A: AKT;B: HBZY-1.1,2:Before NMN treatment;3,4:After NMN treatment;*P<0.01 compared with control group.
圖9 對照組和高濃度葡萄糖組HBZY-1細胞中AKT和Sirt1蛋白表達水平
Fig.9 Expression levels of AKT and Sirt1 proteins in HBZY-1 cells in control group and high concentrations of glucose group
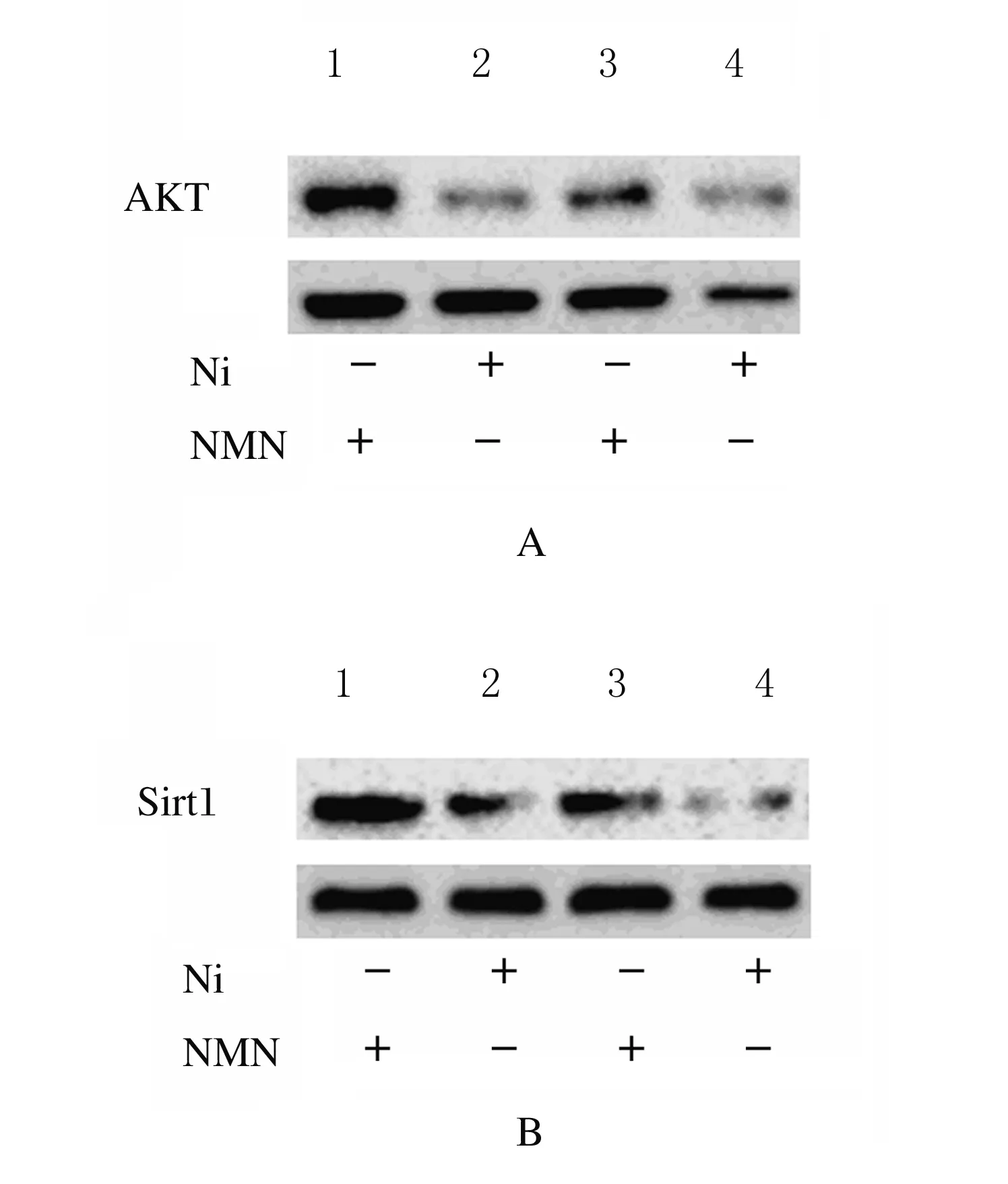
Lane 1,2:High concentration of glucose group;Lane 3,4:Control group.
圖10 各組HBZY-1細胞中AKT(A)和Sirt1(B)蛋白表達電泳圖
Fig.10 Electrophoregram of expression levels of AKT(A) and Sirt1(B) prioteins in HBZY-1 cells in various groups

