鹿茸多肽聯合GDNF基因修飾的雪旺細胞對Aβ25-35誘導脊髓神經元凋亡的保護作用
張鵬程,冷向陽,路博丞,張遠超,王 英,王旭凱
(1.長春中醫藥大學臨床醫學院骨傷科,吉林 長春 130021;2.長春中醫藥大學附屬醫院骨傷科,吉林 長春 130021)
脊髓損傷(spinal cord injury,SCI)屬于中樞神經損傷的一種,伴有極嚴重的致殘致死率,常見于交通和活動等意外,對個人及社會造成極其重大的影響[1]。SCI分為原發性損傷和繼發性損傷兩類。原發性損傷是直接暴力作用于脊髓所造成的,多屬于高能量傷所致[2],可直接造成神經元、膠原及血管的即刻性細胞死亡。細胞凋亡是一種常見的生命現象,是某種或幾種基因調控下的細胞主動死亡過程。SCI后,有許多因素可誘導脊髓神經元凋亡[3]。研究[4]顯示在機體神經損傷的急性期細胞凋亡的作用尤為主要。近年來SCI后神經的修復問題一直是醫學界研究的熱點和難點,而其細胞凋亡機制研究受到高度重視[5]。鹿茸多肽(velvet antler polypeptides,VAP)是從鹿科雄性梅花鹿幼角中提取的一種蛋白多肽類活性因子,具有促進神經再生的功效[6]。研究[7]證實:VAP可使β淀粉樣蛋白25-35(Aβ25-35)誘導大鼠腹部脊髓神經元凋亡,細胞中caspase-3表達下降,VAP對Aβ25-35誘導產生的大鼠腹部脊髓神經元凋亡具有一定抑制作用。體外實驗[8]表明:膠質細胞源性神經營養因子(glial cell line derived neurotrophic factor,GDNF)基因修飾的雪旺細胞(Schwann cells,SCs)可抑制脊髓神經元凋亡,并且對脊髓神經功能的修復具有一定的促進作用。本研究探討VAP聯合GDNF基因修飾的雪旺細胞對脊髓神經元凋亡的保護作用,旨在為臨床上治療SCI提供實驗和理論依據。
1 材料與方法
1.1 實驗動物、細胞、主要試劑和儀器 選用清潔級8~16周性成熟Wistar大鼠160只,雌雄各半,雌性大鼠體質量200~ 220 g,雄性大鼠體質量220~250 g,動物合格證編號:SCXK-(吉)2011-2014,購自吉林省長春市億斯實驗動物技術有限公司。實驗大鼠飼養溫度保持為18℃~ 25℃,自然采光,通風良好,濕度保持在60%~ 70%,普通飼料喂養,食水正常。每日定期維護鼠籠的清潔,確保飼養環境的潔凈無外界打擾。實驗前飼養大鼠適應實驗室5 d后開始實驗。SCs和GDNF由吉林大學基礎醫學院醫學生物學實驗中心提供;VAP由長春中醫藥大學制藥中心提供。多聚賴氨酸和2%戊巴比妥鈉(美國Sigma公司),DMEM低糖培養基(美國Gibco公司),羊抗兔IgG和兔抗大鼠Bcl-2、Bax (武漢博士德生物工程有限公司),免疫組織化學試劑盒(北京中杉金橋生物技術有限公司),胎牛血清(浙江天杭科技股份有限公司),胰酶(上海雅心生物技術有限公司),Hank’s液(北京譜析公司),PBS緩沖液(北京譜析公司)。CO2培養箱 (日本YAMATO公司),離心機(日本Hitachi公司),倒置熒光顯微鏡(德國Olympus公司),培養皿、培養板和培養瓶(丹麥NUNCLON公司),流式細胞儀(美國貝克曼公司)。
1.2 胎鼠脊髓細胞懸液的培養和制備 將雌雄大鼠按照1∶1的比例在每日晚約21時進行合籠,次日上午8時采用滴管輕觸陰門口處,如發現有乳白色、固態膠狀物即陰道栓,由于陰道栓阻塞陰道口而使滴管不能進入陰道內,可判定為陽性;否則為陰性。孕鼠另取籠飼養,連續3 d未見陰栓則棄用。取孕16 d大鼠,采用2%戊巴比妥鈉(3 mg·kg-1腹腔注射)麻醉大鼠后,仰臥位固定,于超凈工作臺上無菌取出胎鼠。將胎鼠經Hank’s液沖洗后,于顯微鏡下操作完全剝離胎鼠皮膚及皮下組織,完全暴露椎管于鏡下,再將椎管兩側呈楔形切開,剝離神經根,使脊髓完全暴露于視野中,并將脊髓組織分離出來。再次使用Hank’s液沖洗剝離出來的完整脊髓組織,在鏡下剪成1 mm × 1 mm× 1 mm糜狀碎塊。在pH= 8、37℃環境下采用0.25%胰蛋白酶消化15 min,采用5 mL移液管吹打數次后以0.075 mm篩孔尺寸濾網過濾,離心棄上清,在培養瓶中放置DMEM低糖培養基,并加入10%胎牛血清以1 × 106mL-1接種。將培養瓶置于飽和濕度、恒溫37℃、5%CO2培養箱中培養,每2~3 d更換培養基。
1.3 流式細胞術檢測Aβ25-35誘導的脊髓神經元凋亡率 取處于對數生長期的脊髓神經元,經過0.125%胰蛋白酶消化,采用5 mL移液管吹打數次后收集,收集后采用1 000 r·min-1室溫離心5 min,棄上清。將脊髓神經元置于完全培養基中重懸,等細胞濃度調整為1 × 106mL-1后接種于24孔板。待細胞融合至80%時,加入10 μmol·L-1Aβ25-35,作用48 h后吸盡培養液,以4% 多聚甲醛固定,得到實驗所需細胞。4℃保存備用。鏡下觀察胎鼠脊髓神經元,懸液接種后初始脊髓神經元大多為圓形,誘導凋亡后細胞形態發生改變,計算細胞凋亡率。脊髓神經元凋亡率=凋亡細胞數/細胞總數×100%。
1.4 細胞分組 將培養細胞分為6組,即正常細胞組(正常脊髓神經元)、誘導凋亡組(Aβ25-35誘導凋亡后的脊髓神經元)、SCs組(Aβ25-35誘導凋亡后的脊髓神經元+SCs)、GDNF組(Aβ25-35誘導凋亡后的脊髓神經元+GDNF)、SCs+GDNF組(Aβ25-35誘導凋亡后的脊髓神經元+GDNF轉染的SCs)和VAP聯合組(Aβ25-35誘導凋亡后的脊髓神經元+VAP聯合GDNF轉染的SCs)。
1.5 免疫組織化學染色檢測各組脊髓神經元中caspase-3陽性細胞數 將各組細胞置入24孔培養板上,采用甲醇固定10 min,采用37℃預熱的0.1 mol·L-1PBS洗滌后再應用95%乙醇固定30 min,將一抗或二抗工作液稀釋后滴加入其中,然后采用PBS洗滌3次,每次洗滌2 min再滴加適當由1%BSA-PBS稀釋的生物素標記的二抗,37℃孵育10 min后沖洗復染、封片。免疫細胞化學染色結果在光鏡下觀察,誘導后有10%~30%細胞呈現棕色,強度不一,為陽性表達;誘導和未誘導細胞完全不顯色為陰性表達。
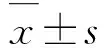
2 結 果
2.1 各組脊髓神經元凋亡率 與正常細胞組比較,誘導凋亡組脊髓神經元凋亡率明顯升高(P<0.05);與誘導凋亡組比較,SCs組、GDNF組、SCs+ GDNF組和VAP聯合組脊髓神經元凋亡率降低(P<0.05);與SCs組比較,GDNF和SCs+GDNF組脊髓神經元凋亡率明顯降低(P<0.05);與SCs+ GDNF組比較,VAP聯合組脊髓神經元凋亡率明顯降低(P<0.05)。見表1。
表1 共培養48 h后各組脊髓神經元凋亡率


GroupApoptotic rateNormal cell 10.32±1.32Induced apoptosis58.61±4.33*SCs 40.33±3.56△GDNF36.21±3.09△#SCs+ GDNF29.11±1.27△#VAP combination23.11±2.25△○
*P<0.05vsnormal cell group;△P<0.05vsinduced apoptosis group;#P<0.05vsSCs group;○P<0.05vsSCs+GDNF group.
2.2 各組脊髓神經元中caspase-3陽性細胞數 各組細胞中均有caspase-3表達,其中正常細胞組脊髓神經元中caspase-3陽性細胞數最少,細胞著色較淡;誘導凋亡組脊髓神經元中caspase-3陽性細胞數最多,細胞著色較深;VAP聯合組脊髓神經元中caspase-3陽性細胞數較SCs組、GDNF組、SCs+ GDNF組減少,細胞著色差異明顯;SCs組、GDNF組和SCs+ GDNF組細胞著色差異不大,caspase-3陽性細胞數相差不大,但與誘導凋亡組比較明顯減少(P<0.05)。見圖1(插頁四)。

3 討 論
SCI后可并發一系列病理改變,致使脊髓的損害加重,產生不同程度神經元壞死和組織變性等嚴重后果,最終導致神經功能異常或障礙。同時,由于中樞神經系統內神經營養因子缺乏,神經元的壞死與凋亡使得SCI后神經功能的恢復十分困難。GDNF是目前己知的神經營養因子中活性最強的運動神經營養因子[9],由于GDNF相對分子質量偏大、半衰期又相對較短,其不能自由通過血腦屏障,所以GDNF 始終未能直接應用于臨床。SCs可分泌多種神經營養因子,是周圍神經系統的主要神經膠質細胞,能夠有效促進神經元再生。研究[8,10]顯示:GDNF 基因修飾的SCs可通過降低 Bax mRNA表達水平和提高 Bcl-2 mRNA表達水平,從而抑制脊髓神經元凋亡。本研究首先分離培養 SCs,其次應用基因技術將GDNF轉染SCs,得到生物活性更強的SCs,最后采用VAP聯合GDNF轉染的SCs進行體外實驗,觀察VAP聯合 GNDF 修飾的 SCs 對SCI的保護作用。
鹿茸具有壯腎陽、益精血、強筋骨、調沖任和托瘡毒[11]的功能。研究[12-15]顯示:鹿茸中含有各種細胞生長因子,其中VAP具有促進骨及軟骨愈合、加速周圍神經組織再生、促進軟骨細胞和成纖維細胞的增殖等功能[16-18]。研究[19-20]顯示:VAP可使 Bax表達水平下調和 Bcl-2表達水平上調,從而抑制神經元凋亡。本文作者發現:VAP聯合GDNF轉染的SCs可使Aβ25-35誘導凋亡的脊髓神經元中caspase-3表達下調,從而抑制脊髓神經元凋亡。
綜上所述,本研究探討VAP聯合GDNF基因修飾的SCs對Aβ25-35誘導的脊髓神經元凋亡的保護作用,證實VAP聯合GDNF基因修飾的SCs對脊髓神經元具有保護作用,為臨床治療SCI尋找了新途徑,也為臨床優化組織工程中種子細胞的研究提供了實驗和理論依據。在未來研究中,本課題組將對本研究的結論進行更深入的論證。

