以彌漫性肺囊性病變伴咯血為表現的干燥綜合征1例報告及文獻復習
辛 桐,王 琦,陳 默,李 偉,高 鵬
(吉林大學第二醫院呼吸內科,吉林 長春 130041)
干燥綜合征(Sj?gren syndrome,SS)是臨床上較為常見的慢性自身免疫性疾病,主要累及淚腺和唾液腺等外分泌腺體。肺臟是易受累器官,其呼吸系統癥狀主要表現為呼吸困難,同時咳嗽、咳痰、胸部疼痛和發熱[1]也較常見,僅有不足1%的患者表現為咯血,多為痰中帶血[2]。胸部CT主要表現為雙肺彌漫的斑片、纖維索條影、網格、結節影或彌漫性毛玻璃改變等,少數患者可表現為雙肺多發囊性改變[3]。本文作者報道1例以彌漫性肺囊性病變伴咯血為表現的SS患者的診治過程。目前國外僅見2篇類似的文獻[4-5]報道,但患者的臨床表現略有不同。本例患者以咯血收入本院,胸部CT顯示大皰的直徑略小,臨床癥狀及CT表現更為罕見。本文作者對該患者的治療過程進行分析,并結合文獻復習,以加強臨床醫生對該病的認識。
1 臨床資料
1.1 一般資料 患者,女性,23歲,未婚。因“呼吸困難伴咳嗽、咳痰1個月,咯血3 d”就診。患者于1個月前無明顯誘因出現呼吸困難及咳嗽、咳痰,呼吸困難輕微,活動后加重,咳少許白色泡沫痰,胸部CT顯示雙肺散在多發囊樣改變。患者于3 d前無明顯誘因出現咯血,鮮紅色,晨起明顯,每日2~3次,總量約為10 mL·d-1,為明確病因來本院就診。既往病史:有海鮮過敏史,無其他慢性病病史及傳染病病史。查體:一般狀態尚可,淺表淋巴結未觸及腫大,瞼結膜蒼白,聽診雙肺呼吸音粗,未聞及干、濕啰音及胸膜摩擦音。心臟和腹部查體無明顯異常。
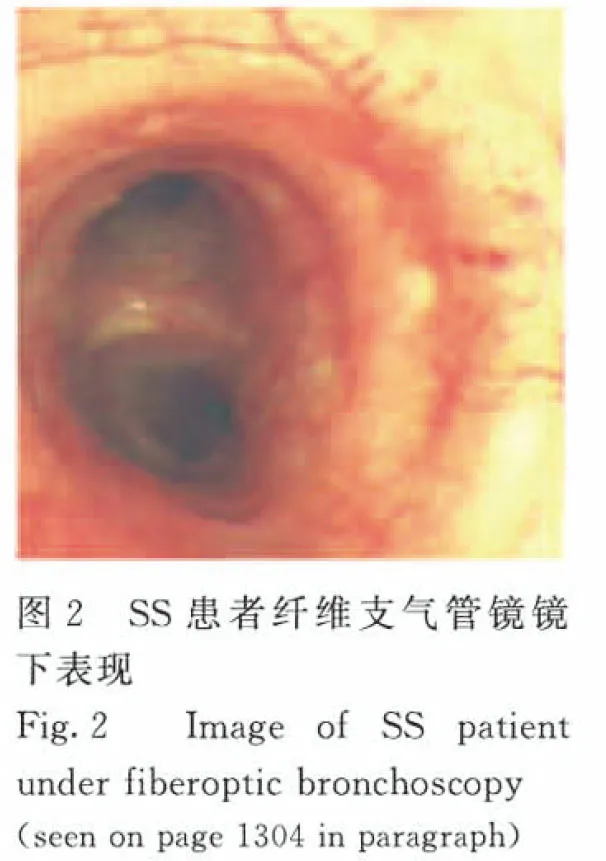
1.2 輔助檢查 胸部CT:雙肺散在多發囊樣改變(圖1)。實驗室檢查:①血常規中白細胞計數2.8×109L-1,中性粒細胞計數1.25×109L-1,紅細胞計數3.58×1012L-1,血紅蛋白水平89 g·L-1,平均紅細胞體積70.5 fl,平均紅細胞血紅蛋白水平24.9 pg,平均紅細胞血紅蛋白水平302 g·L-1,血小板計數 262×109L-1。凝血常規、肝、腎功、甲狀腺功能三項和尿常規正常。骨髓涂片、活檢和血片檢查大致正常。②支氣管舒張試驗中肺通氣功能正常,支氣管舒張試驗陰性。彌散功能試驗中肺彌散功能符合中度障礙,一氧化碳彌散功能(DLCO)=55.8%;殘氣/肺總量百分比輕度升高。③支氣管鏡檢查中氣管慢性炎癥伴毛細血管增生(圖2,見插頁六)。氣管鏡灌洗液病理檢查可見極少量細胞成分,未見惡性細胞。
1.3 治療經過 考慮該患者為年輕女性,主要表現為呼吸困難、咯血,胸部CT顯示雙肺散在多發囊樣改變,初步診斷為淋巴管平滑肌瘤病。患者入院后給予抗炎、止血、對癥支持治療后,臨床癥狀有所好轉,無咯血。為進一步明確診斷,再次行纖維支氣管鏡檢查,并行經支氣管肺活檢(TBLB)術,病理結果顯示:右肺中葉支氣管黏膜下灶狀淋巴細胞浸潤(圖3,見插頁六)。免疫組織化學染色結果顯示:HMB45(-)、S-100(-)、MelanA(-)、SMA(+)、H-Caldesmon(+)和Desmin (+)。根據病理特點考慮SS,追問病史,患者自感口干、眼干癥狀2年余,進一步完善相關檢查:類風濕因子1 100.0 IU·mL-1,ANA譜干燥綜合征A抗體陽性,干燥綜合征B抗體陽性,52 000蛋白抗體陽性,胞漿型-ANCA陽性,ANA篩查1∶1 000,ANA熒光模型為核顆粒性。免疫球蛋白G 20.90 g·L-1,補體C4 15.60×10-2g·L-1。唇腺活檢:送檢唇腺組織中可見灶狀淋巴細胞浸潤,每灶淋巴細胞數大于50個(圖3,見插頁六)。眼科濾紙試驗、淚膜破碎時間測定、角膜染色實驗:支持SS的診斷。最終診斷:SS、缺鐵性貧血(中度)。規律口服糖皮質激素(小劑量強的松)和免疫抑制劑(復方環磷酰胺)治療,患者病情好轉,呼吸困難減輕,無咯血,肺彌散功能明顯好轉,2個月后復查胸部CT較治療前無明顯變化。

A:Inferior lobe of right lung;B:Middle lobe of right lung;C:Upper lobe of left lung.
圖1 SS患者胸部CT影像
Fig.1 Chest CT images of SS patient

2 討 論
SS是一種主要累及外分泌腺體的慢性炎癥性自身免疫病。在我國人群中SS患病率為0.29%~0.77%,以女性多發,年齡集中在30~60歲[2,6]。SS可累及全身多器官系統,主要累及淚腺和唾液腺等外分泌腺以及骨骼、肌肉、腎臟、呼吸系統、消化系統和神經系統等,其中肺部損害的發生率高達9%~90%[4]。目前SS診斷依據主要根據2012年美國風濕病學會(ACR)關于SS的國際分類標準,主要包括:血清抗SSA和(或)抗SSB抗體(+);OSS染色評分≥3分;唇腺病理活檢示淋巴細胞灶≥1個·4 mm-2,以上3項至少滿足2項即可診斷[7]。
肺囊樣病變被定義為由增生的上皮或纖維壁圍繞的圓形空腔,與周圍的正常肺組織具有明確的界限,囊內通常含有空氣,也可含有液體或固體物質[8]。囊壁的厚度不一,但通常是薄壁(<2 mm)[9]。肺囊樣病變涉及的疾病譜相對較廣,癥狀表現無特異性,常見的可引起肺囊樣病變的疾病有:淋巴管平滑肌瘤病(lymphangioleiomyomatosis,LAM)、特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)、淋巴細胞性間質性肺炎(lymphocytic interstitial pneumonia,LIP)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、全小葉性肺氣腫、肺囊腫、支氣管擴張、肺朗格漢斯細胞組織細胞增多癥(pulmonary Langehans cell histiocytosis,PLCH)、原發性SS、硬皮病、結節病(晚期)、類風濕關節炎、濾泡素基因相關綜合征(follicular gene related syndrome,FLCN-S)或Birt-Hogg-Dubé綜合征、肺孢子蟲肺炎(pneumocystis carinii pneumonia,PCP)、肺淀粉樣變性病、輕鏈沉積病(light chain deposition disease ,LCDD)、肺癌和肺轉移癌等[10]。該患者在出現囊樣改變的同時伴有咯血,主要的鑒別診斷應首先考慮為LAM。
SS臨床上多見于雙肺散在囊樣改變伴咯血癥狀的年輕女性,更多見于LAM,因此根據臨床特征誤診為LAM的病例并不少見[5]。該病例診斷過程中,根據育齡女性、進行性呼吸困難及咯血、胸部CT存在多個薄壁肺囊腫、肺通氣和彌散功能下降等特點,疑似診斷為LAM,但最后通過血清學檢查、TBLB、唇腺活檢和淚腺等檢查,確診為SS。LAM主要發生于育齡期女性,幾乎無男性患者,其臨床表現為呼吸困難、咳嗽、咯血和胸痛等,尤其伴有反復發作的氣胸、乳糜胸。SS診斷主要依靠高分辨率CT(HRCT)和病理活檢。早期LAM的HRCT表現可無明顯異常,或雙肺野呈磨玻璃樣改變。隨病情進展可出現肺內彌漫性小結節、網格影,多均勻分布,伴或不伴有氣胸和胸腔積液改變。典型LAM的HRCT表現為雙肺野囊狀透光影,囊腔呈圓形或類圓形,大小不等,直徑為5~20 mm,多數約為10 mm,囊壁薄,壁光滑而完整,囊周無結節,囊狀影之間肺野正常。病情進展時囊腔增大,量增多。在LAM患者中該類形態的囊腔發生率幾乎為100%,這是診斷肺LAM(PLAM)的重要依據,因此胸部HRCT對 PLAM的診斷具有重要價值[11]。
盡管HRCT同樣表現為雙肺囊樣改變,SS和LAM形態特點及病理生理學機制存在明顯不同。SS囊性改變主要分布在肺野中下部區域,大多囊壁不規則,直徑為5~60 mm,但LAM囊樣改變主要于雙肺野中均勻分布[11]。在組織學上,LAM囊腫是由沿血管、淋巴管和細支氣管的LAM細胞浸潤所致的氣道狹窄、肺實質破壞、血管壁增厚、淋巴管長期發炎、空氣滯留和靜脈閉塞所致[12-13]。另有研究[14-15]顯示LAM囊樣改變更可能的原因是由于金屬蛋白酶介導的彈性組織的破壞以及LAM細胞產生蛋白水解酶導致肺囊腫形成。而SS是由于細支氣管周圍淋巴細胞浸潤和(或)淀粉樣蛋白沉積導致氣道變窄,并隨之引起空氣滯留,形成囊腫[16]。兩者在肺囊腫的病理生理學機制上最主要的區別在于LAM存在特征性LAM細胞以及一些特殊表達的酶類,這些也是目前肺活檢確診LAM的重要依據之一。
LAM較為公認的咯血形成機制是遠端血液回流受阻,血液淤滯甚至血管破裂,最近觀點也表明小靜脈的閉塞也可導致咯血[14, 17],而SS的咯血可能與血管受損有關,如急性壞死性血管炎和閉塞性血管炎等[2]。該患者纖維支氣管鏡鏡下表現為支氣管慢性炎癥伴毛細血管增生,考慮為SS所致血管受損、破裂所致咯血。
至今,關于SS患者彌漫性肺囊樣病變的影像報道較少,國內僅有4篇報道[18-21],Kobayashi 等[16]1988年首次報道SS患者伴肺大皰的臨床表現,本文作者認為以單純肺囊樣表現的SS在臨床診斷中容易漏診。就現階段而言,SS和LAM之間是否存在某種聯系尚無定論,但兩者在臨床上的鑒別診斷至關重要,進行必要的HRCT和病理診斷可以更好地避免漏診及誤診。尤其以肺部彌漫性囊樣病變伴咯血為主要臨床表現的育齡期女性,更應針對SS和LAM進行詳細的鑒別診斷。

