小電導鈣激活鉀通道在人心房中的增齡性變化
余奕言,何容芳,于風旭,范學慧,張 娟,李 濤,李妙齡△
(1.醫學電生理學教育部重點實驗室/醫學電生理四川省重點實驗室/西南醫科大學心血管醫學研究所,四川瀘州 646000;2.西南醫科大學附屬醫院心臟外科,四川瀘州 646000)
心房顫動(atrial fibrillation,AF)已成為全球重大的公共衛生問題,據不完全統計,直到2010年,全球AF患者已達到33.5億[1]。且除了AF自身的危害以外,還會增加卒中及心力衰竭的發病率以及致死率。AF是臨床最為常見的持續性心律失常,一般人群發病率為1%~2%,80 歲以上可高達8%。在所有AF患者中,70%的AF患者年齡在65~85 歲。對1999-2001年我國AF住院患者病因分析顯示,老年58.1%、高血壓病40.3%、冠心病34.8%、心力衰竭33.1%、風濕性心臟病23.9%;陣發性AF占33.7%、持續性AF占16.7%、永久性AF占49.5%[2]。老年和高血壓所占比例排前兩位,是AF的獨立危險因素。
小電導鈣激活鉀(SK2)通道是近期發現的一種對細胞胞內鈣敏感的一類鈣激活鉀通道[3]。SK2通道主要在心房上表達,在心房復極末期發揮重要作用。眾多研究支持SK通道的結構與功能變化與AF的發生與發展密切相關[4-7],參與了AF電重構過程。本課題組前期研究報道,AF時SK通道的功能明顯增強[8]。AF的發生隨年齡增加明顯增加,因此本研究旨在探究是否隨著年齡的增加,SK2通道功能會發生改變,進而增加AF的發生率,為闡明AF的發生和治療提供新的思路和新的靶點。
1 材料與方法
1.1材料
1.1.1取材 選取在西南醫科大學附屬醫院心臟外科進行體外循環的不同年齡段(<40歲、40~60歲、>60歲)竇性心律(SR)患者的新鮮右心耳組織。所有受試者均簽署知情同意書,且獲得西南醫科大學倫理委員會的同意,所有程序均遵照國內相關法律法規。
1.1.2主要試劑 Ⅴ型膠原酶、ⅩⅩⅣ型膠原酶、牛血清清蛋白、Apamin均購于Sigma公司,Rever Tra Ace q RT-PCR Master Mix逆轉錄試劑盒購于Toyobo公司,SYBR Green定量PCR試劑盒購于Qiagen公司,其余試劑均為國產分析純。
1.1.3主要儀器 低溫高速離心機購于Thermo Fisher公司,PCR儀、Real-time PCR儀購于Applied Biosystems公司,全功能酶標儀購于NanoDrop公司,凝膠成像系統購于Bio-Rad公司。微管電極拉制儀(PC-10,Narishige,日本)用于拉制玻璃微電極、膜片鉗放大器(EPC-10,HEKA,德國)用于全細胞膜片鉗記錄。
1.2實驗方法
1.2.1人心房肌細胞急性酶分離方法 將手術室中快速取回的心房組織置于培養皿中氧飽和的心肌轉運液(牛磺酸 10 mmol/L,腺苷 5 mmol/L,硫酸鎂8 mmol/L,HEPES 10 mmol/L,磷酸二氫鉀50 mmol/L,甘露醇100 mmol/L,葡萄糖140 mmol/L,用氫氧化鉀調pH值至7.4)中清洗并將心房組織剪為約1 mm3的小塊,再將組織塊置于酶液Ⅰ(蛋白酶、膠原酶和牛血清清蛋白)于37 ℃水浴中消化約50 min,再將心房組織轉移至酶液Ⅱ(膠原酶、清蛋白)中進行消化,隨時觀察細胞狀態,一般約5~8 min,低倍視野下出現3~5個細胞即可終止酶液Ⅱ消化,重復酶Ⅱ消化3次。以上所有過程均保持組織處于持續充氧狀態。收集3次消化的酶液并離心5 min (500 r/min),離心后去除上清液加入KB液 (牛磺酸10 mmol/L,β-羧基丁酸10 mmol/L,磷酸二氫鉀10 mmol/L,氯化鉀20 mmol/L,HEPES 10 mmol/L,EGTA 10 mmol/L,甘露醇5 mmol/L,葡萄糖 25 mmol/L,谷氨酸鉀 70 mmol/L,清蛋白1 mg/mL,用氫氧化鉀調pH值至7.4) 重懸后4 ℃保存,1 h后可用于電生理實驗[9]。
1.2.2全細胞膜片鉗技術 倒置相差顯微鏡下選取呈桿狀、橫紋清楚、無收縮且貼壁良好的心房肌細胞進行電生理的實驗,實驗電極選用硬質玻璃且用微管電極拉制儀通過兩步法拉制而成,充灌電極后電極阻抗為2~5 Ω。采用膜片鉗放大器(EPC-10,HEKA)記錄電流信號,用Patch Master軟件采集數據,采樣頻率為10 kHz,低通濾波頻率為2 kHz。記錄SK通道電流(ISK),電流保持電位-60 mV,指令電壓從-130 mV到+60 mV,Ramp刺激時間持續500 ms。可記錄到一內向整流特性的鉀電流,在此基礎上加入SK通道特異性阻斷劑Apamin后電流明顯減小,加藥前后相減的電流為SK通道電流。記錄電流的細胞外液(N甲基氨基葡萄糖 140 mmol/L,氯化鉀 4 mmol/L,氯化鎂 1 mmol/L,葡萄糖 5 mmol/L,HEPES 10 mmol/L,用鹽酸調pH值至7.4);電極液 (葡萄酸鉀144 mmol/L,氯化鎂 1.55 mmol/L,HEPES 10 mmol/L,EGTA 5 mmol/L,用氫氧化鉀調至7.2)。
1.2.3Western blot檢測心房組織中SK2通道蛋白的表達
1.2.3.1總蛋白的提取 將獲取的心房組織剪碎清洗,液氮研磨后加入RAPI裂解液(含蛋白酶抑制劑)在冰上裂解30 min,再用細胞破碎儀處理2 min。 4 ℃ 12 000 r/min離心15 min。用BCA法測蛋白濃度后加入5×Loading Buffer 99 ℃變性10 min 置于-20 ℃備用。
1.2.3.2Western blot 制備分離膠與濃縮膠,待膠凝固后上樣、電泳、轉膜、封閉。一抗4 ℃孵育過夜。第二天室溫孵育二抗1 h。再用TBST清洗,Bio-RAD凝膠成像系統顯影,采用Quantity One 軟件進行數據分析。
1.2.4qRT-PCR檢測心房組織中KCNN2基因的表達
1.2.4.1組織RNA提取 將獲取的心房組織剪碎清洗,加入Trizol后用液氮研磨,加入氯仿后渦旋振蕩混勻,室溫靜置5 min后離心。離心后取出上層水相并加入異丙醇離心后沉淀RNA。棄上清液,加入75%乙醇清洗后揮干,加入DEPC水吹打混勻,用全功能酶標儀檢測mRNA水平。
1.2.4.2引物的設計 根據GenBank中KCNN2、β-actin的引物序列來設計引物,引物序列見表1。

表1 KCNN2及β-actin引物序列
1.2.4.3逆轉錄獲得cDNA的第一鏈 將RNA統一標化為500 ng/μL,用Toyobo逆轉錄試劑盒進行逆轉錄,取1 μL總RNA,反應體系為10 μL,反應條件為37 ℃ 15 min,50 ℃ 5 min,98 ℃ 5 min,4 ℃保存。
1.2.4.4實時熒光定量PCR 熒光定量采用SYBR Green(QIAGEN公司)試劑盒,反應體系為20 μL,反應條件為95 ℃預變性3 min,95 ℃變性10 s,57℃退火10 s,72 ℃延伸10 s,共40個循環。
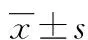
2 結 果
2.1病歷資料 本研究中<40歲組患者22例,40~60歲組患者34例和>60歲組患者18例,<40歲組的患者中主要以先天性心臟病(簡稱先心病)為主,而40~60歲組和>60歲組患者主要以二尖瓣或主動脈瓣病變為主,各組心臟的基礎性疾病及用藥的差異,見表2。

表2 患者資料

續表2 患者資料
相同年齡段患者心房組織存在共用情況,故導致不同實驗中例數不完全一致
2.2急性酶分離的心肌細胞 兩步酶法分離出的人心房肌細胞在顯微鏡下呈桿狀,細胞膜光滑,折光性好,橫紋清楚,不收縮,活性好(圖1A);細胞表面光滑平整或有一處多處小凹陷(圖1B),但并不影響封接破膜,均適宜做下一步的膜片鉗實驗。

A:橫紋清晰的人心房肌細胞;B:細胞有凹陷的人心房肌細胞

A:<40歲組加入Apamin 前后電流原始記錄圖; B:40~60歲組加入Apamin 前后電流原始記錄圖;C:>60 歲組加入Apamin 前后電流原始記錄圖;D:各組電流密度-電壓關系曲線(Ⅰ~Ⅴ曲線);加藥前后電流相減即為SK2通道電流
2.3老年患者心房肌細胞SK2通道電流的變化 記錄SK2通道電流的電極內液的游離鈣離子濃度為5×10-7mol/L,保證SK通道的充分激活。<40歲組 (n=16個細胞,來自8例患者心房)與40~60歲組(n=20個細胞,來自8例患者心房)比較差異無統計學意義(P>0.05),<40歲組與>60歲組(n=18個細胞,來自10例患者心房)比較,在多個膜電位水平(電壓從-130 mV到-80 mV、+50 mV到+60 mV)電流幅度明顯增加(P<0.01或P<0.05)。40~60歲組(n=20)與>60歲組(n=18)比較,在多個膜電位水平(電壓從-130 mV到-80 mV、+50 mV到+60 mV)電流幅度均明顯增加(P<0.01或P<0.05)。見圖2。
2.4人心房組織SK2蛋白的表達 與<40歲組(n=12)比較,40~60組(n=18)和>60歲組(n=10)SK2通道蛋白的表達均有所增加,但只有與>60歲組比較蛋白表達差異有統計學意義(P<0.05);40~60組(n=18)與>60歲組(n=10)比較差異也有統計學意義(P<0.05)。見圖3。

a:P<0.05
2.5熒光定量PCR檢測心房組織KCNN2基因的表達變化 熒光定量PCR結果顯示,與<40歲組(n=12)比較40~60歲組(n=18)和>60歲組(n=10)KCNN2基因表達均有所增加,但只有>60歲組KCNN2基因表達上調差異有統計學意義(P<0.05);40~60歲組(n=18)和>60歲組(n=10)比較KCNN2基因表達差異也有統計學意義(P<0.05)。見圖4。

a:P<0.05
3 討 論
AF是臨床最為常見的心律失常,心房電重構和結構重構是AF發生和維持的重要病理基礎。這些異常是由不同的病理生理學機制引起的,而AF發生的機制至今還未清楚。流行病學資料顯示AF的發生與患者的年齡密切相關,老齡很有可能是易于導致AF的重要原因,研究老齡患者的心房電重構,對臨床上指導老齡患者用藥具有重要的參考價值。統計資料顯示,因心律失常住院的患者中,約1/3的人是因為AF。對大多數人來說,40歲以后發生AF的風險接近25%[10],而且隨著年齡的增加風險指數也隨之增加。盡管AF沒有帶來毀滅性的傷害,但是它會大大降低人們的生活質量及增加腦卒中的風險[11-13]。多種臨床危險因素如高齡、高血壓、糖尿病、吸煙、心衰、肥胖等,還有一些心電圖和超聲心動圖的特性變化及一些生物化學的標志蛋白的變化都與發生AF風險增加有關。而在2014年美國心臟協會心AF動治療指南中,將高齡列為AF發生的第一危險因素[14]。有研究表明,在<60歲的受試者中,AF的發生率男性為0.78%、女性為0.76%。而在≥60歲的受試者中,男性、女性AF的發生率均增加為1.83%[15]。
小電導鈣激活鉀通道是一類對細胞內游離鈣離子敏感而對膜電位不敏感的鉀通道[16]。2007年OZGEN等[17]發現快速電刺激可導致SK通道蛋白從細胞內向膜上轉運導致心肌復極加速,第一次提出SK參與心房電重構。2009年LI等[18]研究發現,SK2基因敲除小鼠易發生AF,但卻沒有出現室性心律失常。2010年DINESS等[19]在乙酰膽堿結合電刺激誘發的AF模型上發現,AF發生后給予SK通道的阻滯劑可預防和終止AF的發生,且對心房具有明顯的靶向性。這些研究表明,SK通道在AF的發生中發揮重要作用,小電導鈣激活鉀通道是新近發現在心臟中發揮重要功能作用的一類鉀通道。近年來,越來越多的人關注這類通道,因為它可能作為心房特異性選擇的靶點。所以抑制SK通道的表達可能作為AF治療的新靶點[10]。
本研究結果表明,在急性酶分離的細胞中記錄到Apamin敏感的SK2電流。老年患者心房肌的SK2通道電流明顯增加,并伴隨著基因和蛋白的表達同時上調,表明隨著年齡的增加,SK2通道的功能明顯增強。從而為增齡與AF發生間的相關性提供了新的依據。隨著年齡的增加,心房SK2通道表達增加,可能是引起AF發生存在的底物,其具體的機制還有待進一步的探索。本研究未選取動物模型作為實驗對象,而是直接選取臨床上3個年齡階段(<40歲、40~60歲和>60歲)竇性心律患者的心房組織,更具有臨床指導意義。為探究高齡與AF間關系的機制提供新的思路,為AF的治療和預防提供新的方向。

