產低溫蛋白酶酵母菌株的篩選及發酵培養基優化
姜春宇,張 媱,孫燕飛,李 楊,雷勇輝*
(1.石河子大學 生命科學學院,新疆 石河子 832003;2.石河子大學 農學院,新疆 石河子 832003)
蛋白酶是世界三大工業用酶之一,可催化肽鏈中肽鍵水解,在食品、洗滌、皮革等工業領域發揮著舉足輕重的作用,市場占有率高達整個商品酶銷售量的一半以上[1-2]。蛋白酶作為常用工業酶之一,在市場上享有廣闊的應用及開發前景,并受到研究人員的廣泛關注:劉穎等[3]通過單因素試驗和正交試驗對枯草芽孢桿菌(Bacillus subtilis)10075發酵產中性蛋白酶的培養基組分及培養條件進行優化,中性蛋白酶活力由98.36 U/mL提高至353.45 U/mL;舒偉學等[4]通過基因組改造技術對一株具有角蛋白酶活性的節桿菌(Arthrobacter)進行改造,酶活力為原始菌株的5.48倍。低溫蛋白酶的最適溫度一般在40℃以下[5],由于在低溫環境下具有較高的酶活性,有助于在保證催化效率的前提下降低反應溫度和縮短反應時間,從而大幅度節約能源,具有廣泛應用前景以及中溫蛋白酶無法取代的優越性[6],自20世紀70年代以來,國際上越來越多的實驗室投入到低溫蛋白酶的研究,從海水、高山以及極地泥土等樣品中分離到產低溫蛋白酶的菌株,如張曉燕[7]從新疆冰川高寒地區阿勒泰進山口植物根際凍土中分離出一株沙雷氏菌(Serratiamarcescens),其所產的低溫蛋白酶活力為54.25 U/mL。
目前,蛋白酶主要來源于細菌,其中以芽孢桿菌屬(Bacillus)和假單胞菌屬(Pseudomonadaceae)尤為突出[8]。但其生產菌株的單一性不但不能滿足制革、絲綢、日化工業對多種酶類生產的需求,而且芽孢桿菌在工業生產過程中產生的芽孢往往影響產品的產量和質量。因此,打破現有產酶菌種的局限性,積極開發新菌種勢在必行。酵母菌作為一種工業常用菌種,在生產上具有發酵工藝成熟、產物易于誘導、產品質量優良等特點。徐亞男等[9]在新疆赤霞珠葡萄酒發酵過程中篩選得到1株產蛋白酶能力較強的葡萄汁有孢漢生酵母(Hanseniasporauvarum);DASKAYA-DIKMEN C等[10]于土耳其北部分離得到3株嗜冷酵母(Candidagelida),其蛋白酶酶活在2.11~10.53 U/mL范圍內。
本研究從新疆本地分離獲得的200株酵母菌中篩選產低溫蛋白酶菌株,并對其中3株低溫蛋白酶活力較高的酵母菌進行鑒定,并利用響應面法對低溫蛋白酶活力最高的菌株產蛋白酶發酵培養基配方進行初步優化,為后續酵母產低溫蛋白酶的研究和應用奠定了一定基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
200株酵母菌株:實驗室從新疆本地水果表皮、植物內部、水樣和土壤中分離得到。
1.1.2 培養基
種子液體培養基:采用酵母浸出粉胨葡萄糖(yeast extract peptonedextrose,YEPD)培養基。酵母粉1.0%,蛋白胨2.0%,葡萄糖2.0%,pH自然。121℃滅菌20 min。
蛋白酶平板篩選培養基[11]:在YEPD培養基基礎上添加脫脂奶粉1.0%,混勻,為防治奶粉變性應將培養基分別高壓滅菌。121℃滅菌20 min。
1.1.3 主要試劑
酪氨酸、干酪素、福林酚(均為分析純):北京索萊寶科技有限公司;DP307酵母基因組脫氧核糖核酸(deoxyribonucleic acid,DNA)提取試劑盒:北京天根生化科技有限公司;Taq酶(5 U/μL):大連TAkaRa公司。
1.2 儀器與設備
CS601恒溫水浴鍋:上海博訊實業有限公司;759S紫外可見分光光度計:上海棱光技術有限公司;ZHWY-100B搖床:上海智城分析儀器制造有限公司;HWS恒溫恒濕培養箱:上海精宏實驗設備有限公司;FroFleX聚合酶鏈式反應(polymerase chain reaction,PCR)儀:美國Life Technologies公司;5424R高速冷凍離心機:Eppendorf中國有限公司;SW-CJ-1F超凈工作臺:蘇州凈化設備有限公司;SMZ800N體式鏡:日本Nikon公司;Imager.M2微分干涉顯微鏡:德國ZEISS公司。
1.3 方法
1.3.1 產低溫蛋白酶酵母菌株的篩選
初篩[12]:室溫下將分離純化得到的酵母菌點接于蛋白酶平板篩選培養基上,于28℃恒溫培養7~14d后觀察菌落生長狀況與培養基變化情況。記錄有透明水解圈的酵母菌,編號并拍照,采用十字交叉法記錄水解圈直徑(D)與菌落直徑(d)的比值D/d。將具有透明水解圈的菌株點接轉板,于20℃重復上述觀察記錄過程以篩選產低溫蛋白酶酵母菌。
復篩[13-15]:在超凈臺中,于活化斜面取一環初步篩選得到的產低溫蛋白酶酵母菌株接種到100 mL種子液培養基中,在20℃或28℃(依據初篩培養溫度)、150 r/min的恒溫搖床中培養48 h。取2 mL種子液,10 000 r/min離心20 min,所得的上清液即為粗酶液。粗酶液稀釋10倍后,根據國標GB/T 23527—2009《蛋白酶制劑》測定蛋白酶活力,其中反應溫度降至20℃或28℃。
1.3.2 形態學和生理生化鑒定
形態學鑒定:將篩選到的產低溫蛋白酶的菌種劃線接種于YEPD培養基平板上,28℃培養2~5 d,進行菌落形態觀察,并在體視顯微鏡和微分干涉顯微鏡下進行細胞形態觀察。
生理生化鑒定:鑒定方法參考文獻[16]。
1.3.3 分子生物學鑒定[17-18]
酵母菌基因組的提取:采用DP307酵母基因組提取試劑盒提取酵母菌株的DNA。
PCR擴增:以酵母菌基因組DNA為模板,采用26SrRNA基因的通用引物(NL-1:5'-GCATATCAATAAGCGGAG GAAAAG-3';NL-4:5'-GGTCCGTGTTTCAAGACGG-3')進行PCR擴增。PCR反應體系:50×SYBRGreen 0.3μL、ROX Reference Dye0.1μL、10×cDNA 1μL、10×Taq buffer 2.5μL、25 mmol/L MgCl22.5μL、10 mmol/L脫氧核糖核苷三磷酸(deoxy-ribonucleosidetriphosphate,dNTP)0.5 μL、5 U/μL Taq DNA polymerase0.2μL、10μmol/L上下游引物各0.5μL,補雙蒸水(ddH2O)至總體積25μL。PCR反應條件:95℃1min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 40 s,40個循環;72 ℃ 10 min。
測序及系統發育樹分析:將擴增出的26SrRNA基因序列克隆送至上海生工測序。登錄美國國立生物技術信息中心(national center for biotechnology information,NCBI)網站,采用BLAST程序進行序列比對,通過Mega6.06軟件中的鄰接(neighbor-joining,NJ)法構建系統進化樹,進行系統發育樹分析。
1.3.4 產低溫蛋白酶酵母菌株發酵培養基的優化
碳源種類優化:于活化斜面取一環初步篩選得到的產低溫蛋白酶酵母菌株WLY1接種至100mL種子液體培養基中,20℃、150r/min條件下培養48h得到種子液。按2%(V/V)接種量將種子液接種至YEPD培養基中,20℃、150 r/min條件下培養時間48h。以不添加葡萄糖的YEPD培養基為對照,考察碳源種類(蔗糖、甘油、乳糖、可溶性淀粉、檸檬酸)對酵母菌株WLY1產低溫蛋白酶的影響,碳源添加量為2%。
無機氮源種類優化:選取最優碳源后,考察無機氮源種類(酪素、硝酸鉀、硝酸鈉、尿素粉)對酵母菌株WLY1產低溫蛋白酶的影響,無機氮源添加量為1.5%[19-21]。
響應面分析[22]:在前期單因素試驗的基礎上,利用響應面分析法(responsesurfacemethodology,RSM)中的Box-Behnken試驗方案進行設計,考察酵母浸粉含量(A)、蛋白胨含量(B)和干酪素含量(C)對菌株WLY1產低溫蛋白酶的影響,通過試驗數據擬合得到二階響應面模型,初步確定最優發酵培養基配方,并進行驗證。
1.3.5 數據處理
用Excel 2013計算樣品的平均值±標準差,用SPSS19.0軟件對數據進行單因素方差分析,采用Duncan法進行組間多重比較。
2 結果與分析
2.1 產低溫蛋白酶酵母菌株的篩選結果
產低溫蛋白酶酵母菌的D/d值及酶活力測定結果見表1。表中除菌株WLY1、WLY1、MLY1于20℃條件下培養外,其他菌株均在28℃條件下培養。
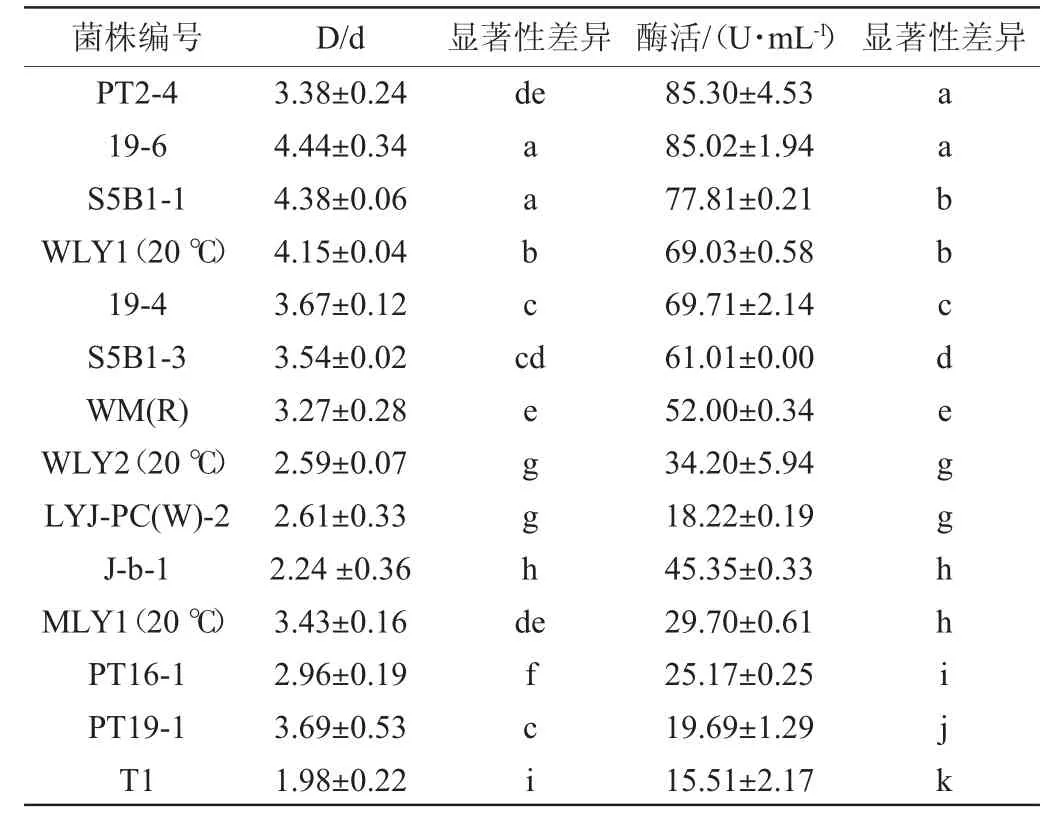
表1 不同菌株的D/d值、蛋白酶活力測定結果Table 1 Determination results of D/d values and protease activity of different strains
由表1可知,從新疆本地分離獲得的200株酵母菌中篩選出14株產低溫蛋白酶的菌株,其中菌株WLY1、WLY2和MLY1在20℃條件下均能產蛋白酶,蛋白酶活分別為69.03 U/mL、34.20 U/mL、29.70 U/mL,故選取該3株酵母菌進行菌種鑒定。且在3株酵母菌株中,菌株WLY1在20℃條件下所產的低溫蛋白酶酶活力較高。因此,對其產低溫蛋白酶發酵培養基配方進行優化。
2.2 產低溫蛋白酶酵母菌株的鑒定
2.2.1 形態觀察
酵母菌株WLY1、WLY2和MLY1的菌落形態及細胞形態觀察結果見圖1。

圖1 產低溫蛋白酶酵母菌WLY1、WLY2和MLY1的菌落(A,B,C)和細胞形態(a,b,c)Fig.1 Colony(A,B,C)and cell morphology(a,b,c) of low-temperature protease-producing yeasts WLY1,WLY2 and MLY1
由圖1可知,菌株WLY1菌落呈粉紅色,圓形,中間凸起,表面及邊緣光滑濕潤,其單細胞為橢圓形或球形,可觀察到出芽生殖形成的藕節狀假菌絲;菌株WLY2菌落呈白色、圓形,中間凸起,表面及邊緣粗糙規整,其單細胞成典型球狀;菌株MLY1菌落呈米黃色,表面潤滑,中部凹陷有褶皺,邊緣凸起不規則,其單細胞體積較小,橢圓形或球形,單個或成對出現。
2.2.2 生理生化特征
酵母菌株WLY1、WLY2和MLY1的生理生化鑒定結果見表2~表4。
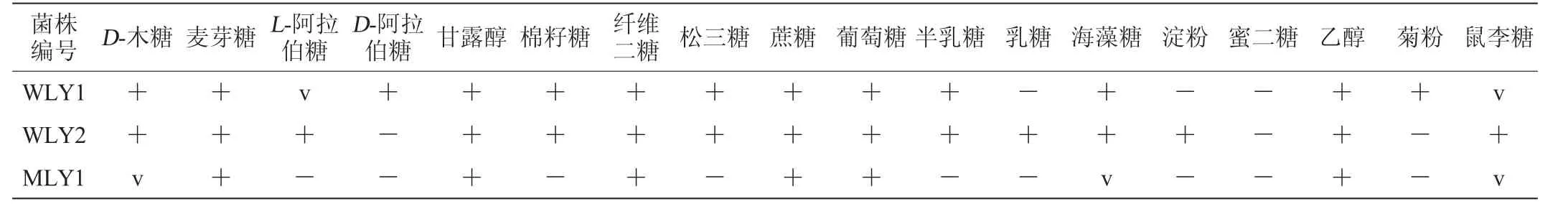
表2 3株產低溫蛋白酶酵母菌的同化試驗結果Table 2 Results of assimilation tests of 3 yeasts producing low-temperature protease

表3 3株產低溫蛋白酶酵母菌糖發酵結果Table 3 Results of the sugar fermentation tests of 3 yeasts producing low-temperature protease

表4 3株產低溫蛋白酶酵母菌其他生理生化鑒定結果Table 4 Identification results of other physiological and biochemical of 3 yeasts producing low-temperature protease
由表2~表4可知,菌株WLY1不能利用乳糖、淀粉以及蜜二糖作為碳源,在無維生素環境下可以生長,不產胞外類淀粉化合物,產尿素酶,可在40℃條件下生長;菌株WLY2不能利用D-阿拉伯糖、蜜二糖以及菊粉作為碳源,在無維生素環境下可以生長,產胞外類淀粉化合物、尿素酶,可在40℃條件下生長;菌株MLY1在上述3種菌株中的可利用碳源最少,生長需要維生素,產胞外類淀粉化合物、尿素酶,最高生長溫度僅28℃。
經形態觀察和生理生化鑒定,初步鑒定菌株WLY1、WLY2、MLY1分別為紅冬孢酵母屬(Rhodosporidium)、隱球菌屬(Cryptococcus)、Barnettozyma。
2.2.3 分子生物學鑒定
酵母菌株WLY1、WLY2和MLY1的26SrRNA測序結果在NCBI上進行BLAST比對搜索,選取同源性較高的菌株構建系統發育樹,結果見圖2。

圖2 3株產低溫蛋白酶酵母菌基于26S rDNA的D1/D2區序列構建的進化樹Fig.2 Phylogenetic tree of 3 yeasts producing low-temperature protease based on the D1/D2 sequences of 26S rDNA
由圖2可知,菌株WLY1、WLY2和MLY1分別與紅冬孢酵母屬(Rhodosporidium)、隱球酵母屬(Cryptococcus)、Barnettozyma聚于一支,初步判定酵母菌株WLY1為Rho dosporidium、WLY2為Cryptococcus、MLY1為Barnettozyma。結合形態學和生理生化鑒定結果,最終鑒定產低溫蛋白酶酵母WLY1、WLY2、MLY1分別為雙倒卵形紅冬孢酵母(Rhodosporidium diobovatum)、Cryptococcus adeliensis、Barnettozymacalifornica。
2.3 菌株WLY1產低溫蛋白酶發酵培養基配方優化
2.3.1 碳源種類對菌株WLY1產低溫蛋白酶的影響
以YEPD培養基為對照,考察碳源種類對菌株WLY1產低溫蛋白酶的影響,結果見圖3。

圖3 碳源種類對菌株WLY1產低溫蛋白酶的影響Fig.3 Effect of type of carbon source on low-temperature protease production by strain WLY1
由圖3可知,在不添加葡萄糖的YEPD培養基中,菌株WLY1產蛋白酶水平最高,達72.49 U/mL。因此,本試驗選則無葡萄糖添加的YEPD培養基為最佳培養基。
2.3.2 無機氮源種類對菌株WLY1產低溫蛋白酶的影響
在無葡萄糖添加的YEPD培養基基礎上,考察無機氮源種類對菌株WLY1產蛋白酶的影響,結果見圖4。
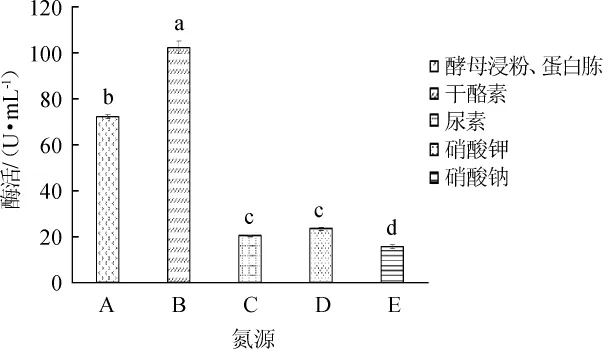
圖4 無機氮源種類對菌株WLY1產低溫蛋白酶的影響Fig.4 Effect of type of inorganic nitrogen source on low-temperature protease production by strain WLY1
由圖4可知,采用添加有干酪素的培養基進行發酵,菌株WLY1所產的低蛋白酶活力最高,為102.20 U/mL,因此選用在無葡萄糖添加的YEPD培養基基礎上添加干酪素為最佳培養基。
2.4 響應面分析結果
通過前期單因素試驗得出,三種氮源的最優添加量均為1.5%,因此,以單因素為基礎進行響應面試驗。以蛋白酶活力(Y)為響應指標,考察酵母浸粉(A)、蛋白胨(B)和干酪素(C)對菌株WLY1產低溫蛋白酶的影響,Box-Behnken響應面優化試驗結果見表5,方差分析結果見表6,各因素交互作用對蛋白酶活力的影響結果見圖5。
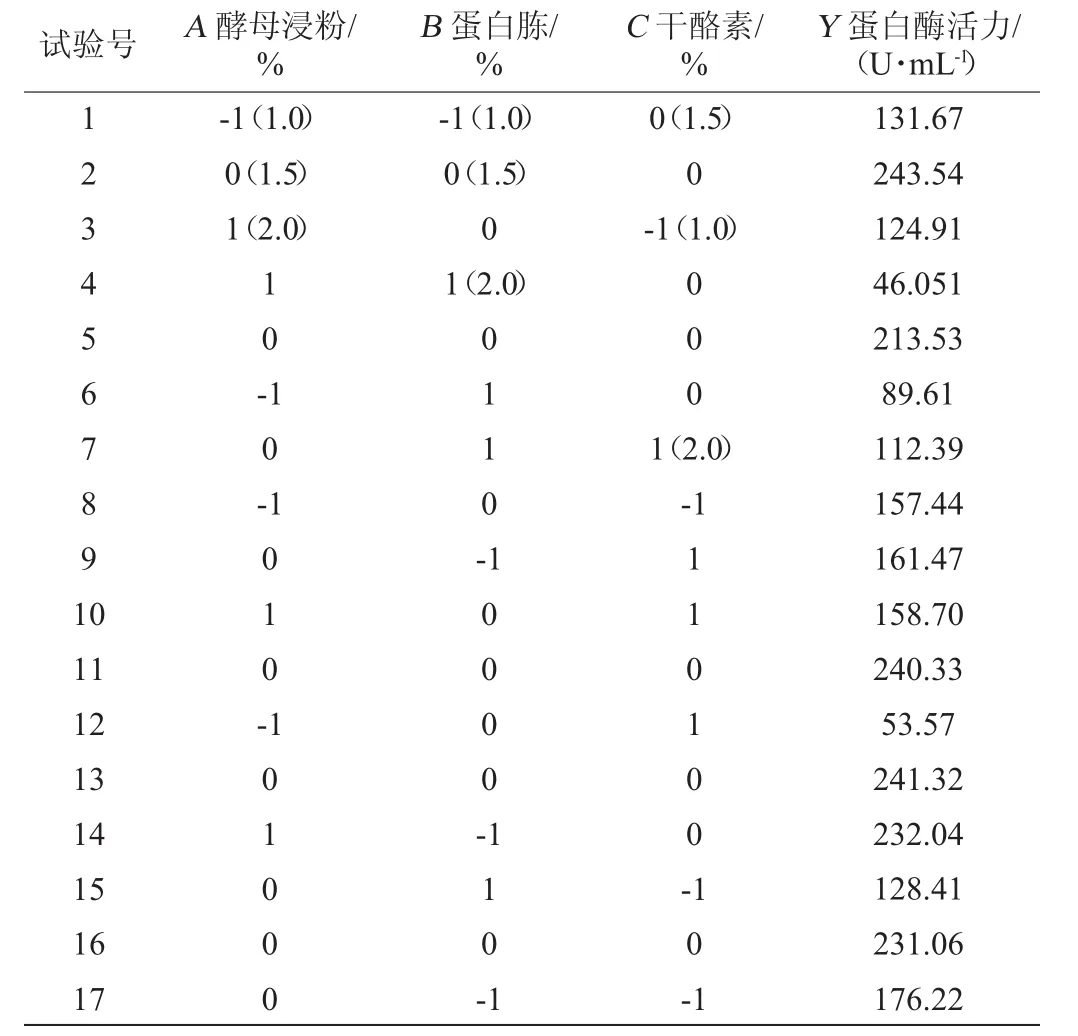
表5 Box-Behnken試驗設計與結果Table 5 Design and results of Box-Behnken tests

表6 回歸模型的方差分析Table 6 Variance analysis of the regression model
通過Design Expert軟件對表5試驗數據進行二次多項式回歸擬合,獲得蛋白酶活力(Y)對酵母浸粉(A)、蛋白胨(B)和干酪素(C)的二次多項式回歸方程:


圖5 酵母浸粉、蛋白胨和干酪素交互作用對菌株WYL1的低溫蛋白酶活力影響的響應曲面及等高線Fig.5 Response surface plots and contour line of effects of interaction between yeast extract powder,peptone and casein contents on low-temperature protease activity of strain WYL1
由表6和圖5可知,3個因素的二次項及蛋白胨對蛋白酶活力的影響極顯著(P<0.01);酵母浸粉分別與蛋白胨、干酪素的交互作用對蛋白酶活力影響顯著(P<0.05);其他因素對蛋白酶活力影響不顯著(P>0.05)。分析該二次多項模型及其各項的方差結果表明,該回歸模型的P值為0.000 6,極顯著(P<0.01),變異系數(coefficient of variation,CV)值較低為12.81%,有效信號與噪聲的比值>10.95,決定系數R2值達到0.956,說明回歸方程的擬合程度較好,預測值和實測值之間具有高度的相關性,因而該模型可以用于菌株WLY1產低溫蛋白酶酶發酵培養基優化的理論分析和預測。
通過響應面優化得出酵母菌株WLY1產低溫蛋白酶的最佳培養基配方為酵母浸粉1.64%、蛋白胨1.21%、干酪素1.48%。在此最優條件下,得出實際蛋白酶活力平均值為251.51 U/mL,與預測值248.01 U/mL接近,說明模型可靠性很高。
3 結論
本研究從新疆本地分離獲得的200株酵母中篩選出14株產低溫蛋白酶的酵母菌株。其中3株酵母(WLY1、WLY2和MLY1)在20℃條件下產蛋白酶,且蛋白酶活力依次為69.03 U/mL、34.20 U/mL、29.70 U/mL。通過形態觀察、生理生化和分子生物學鑒定菌株WLY1、WLY2和MLY1分別為雙倒卵形紅冬孢酵母(Rhodosporidium diobovatum)、Cryptococcus adeliensis、Barnettozyma californica。通過響應面分析法,優化得出菌株WLY1產低溫蛋白酶的最佳培養基配方為酵母粉1.64%、蛋白胨1.21%、干酪素1.48%。在此最優條件下,蛋白酶活力為251.51 U/mL,約為優化前(69.03 U/mL)的4倍,具有較大的蛋白酶潛在應用價值。

