鷹嘴豆蛋白酶解動力學研究
葉健明,石寧蕙,周建中,楊海燕*
(新疆農(nóng)業(yè)大學 食品科學與藥學學院,新疆 烏魯木齊 830052)
鷹嘴豆(chickpea)是世界第二大消費豆類,產(chǎn)量居世界豆類第三,是目前世界上栽培面積較廣的食用豆類作物之一[1]。目前,中國對鷹嘴豆的食用以干制和鮮食為主,對鷹嘴豆蛋白的利用較少。鷹嘴豆蛋白富含人體所需的18種氨基酸,且必需氨基酸種類齊全、組成均衡[2-3],NEWMANCW等[4]研究發(fā)現(xiàn),鷹嘴豆蛋白的功效比值在2.8左右,消化率79%~88%,與大豆蛋白相似,是一種優(yōu)質(zhì)植物蛋白。應用蛋白酶水解蛋白質(zhì),可有效增強原料蛋白的生理功效,提高人體吸收。近年來,研究者依靠酶解技術(shù)從多種蛋白原料中獲得降血壓[5-6]、降血脂[7-8]、抗氧化活性[9-10]的小肽產(chǎn)物。生物活性肽的獲得離不開對酶促反應進程的研究,研究其酶解動力學可有效控制酶解過程,進而提高生物活性肽得率,控制酶解成本。
植物蛋白酶解動力學的研究主要集中在蕎麥蛋白[11]、小麥面筋蛋白[12]、豌豆分離蛋白[13]、大豆蛋白[14]、青稞蛋白質(zhì)[15]。而鷹嘴豆蛋白酶解動力學鮮有報道,為了得到鷹嘴豆蛋白酶解最優(yōu)的條件,更好地擬合實際生產(chǎn)條件,使其最大限度發(fā)揮酶促反應的高效性,了解酶促反應的作用機理[16-17],需要對酶促反應的速率進行研究,因此,研究鷹嘴豆蛋白的酶解動力學具有重要的理論研究和實際應用價值。試驗以堿溶酸沉提取的鷹嘴豆蛋白為原料,從酶解反應機理出發(fā),結(jié)合數(shù)學模型的擬合和驗證,建立鷹嘴豆蛋白的酶解反應動力學模型,模擬反應進程,旨在為鷹嘴豆生物活性肽的酶解制備提供可量化的、準確的控制方法。
1 材料與方法
1.1 材料與試劑
鷹嘴豆:木壘縣鷹哥生物科技有限公司;鷹嘴豆蛋白:實驗室自制;石油醚(沸點30~60℃):天津市致遠化學試劑有限公司;堿性蛋白酶(Alcalase2.4L,酶活2.65×105U/g):丹麥Novozymes公司;牛血清蛋白、福林-酚試劑:北京市索萊寶科技有限公司;其他試劑均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
UV-1200型紫外可見分光光度計:上海美譜達儀器有限公司;HH-S4數(shù)顯恒溫水浴鍋:金壇市醫(yī)療儀器廠;AL204天平:梅特勒-托利多儀器(上海)有限公司;TDL-5-A離心機:上海安亭科學儀器廠;FW-100高速萬能粉碎機:北京市永光明醫(yī)療儀器廠;PHS-3CPH計:上海儀電科學儀器股份有限公司;CHRIST凍干機ALPHA 1-2LDPlus:北京五洲東方科技發(fā)展有限公司。
1.3 方法
1.3.1 鷹嘴豆蛋白的制備
脫脂鷹嘴豆粉(石油醚脫脂,萬能粉碎機粉碎,過80目篩)→堿溶(料液比1∶10(g∶mL)、30 ℃、90 min、pH 10.0)→離心(3 500 r/min,25 min)→上層清液→酸沉(pH4.5)→離心(4 000 r/min,10 min)→真空冷凍干燥[18]。
1.3.2 鷹嘴豆蛋白酶解反應
鷹嘴豆蛋白與水按一定比例(g∶mL)混合均勻,水浴鍋中90℃預處理10 min,冷卻后加0.5 mol/L NaOH溶液調(diào)至酶解最適pH,55℃攪拌至pH穩(wěn)定后加入酶水解,反應結(jié)束后90℃滅酶10 min,在4 000 r/min條件下離心10 min,取上清液放入冰箱冷藏備用。
1.3.3 酶活力測定
酶活力的測定采用改進的Folin-酚法[19]。
稱取堿性蛋白酶1.0 g,然后用硼酸緩沖溶液(pH=10.5)溶解并稀釋到一定濃度,加入1 mL(10.0 g/L)酪蛋白溶液于40℃下反應10 min,加入2 mL三氯乙酸溶液(65.4 g/L)終止反應。取1 mL上層清液,加入5.0 mL(42.4 g/L)Na2CO3溶液混合均勻后加入1 mL福林酚試劑(福林酚與水體積比1∶2配制)。在波長680 nm處測定吸光度值。
1.3.4 水解度的測定
水解度(degree of hydrolysis,DH)的測定采用pH-Stat法[20]。計算公式如下:

式中:DH為水解度,%;B為堿液體積,mL;Nb為堿液當量濃度,mol/L;?為氨基的解離度;Mp為底物中蛋白質(zhì)總量,g;Htot為底物中蛋白質(zhì)中肽鍵總數(shù),mmol/g。(鷹嘴豆蛋白Htot=7.22)。
2 結(jié)果與分析
2.1 酶解反應機理和動力學模型的推導
蛋白質(zhì)酶法水解反應符合雙底物順序反應機理[21-23]。
由Henri中間復合物學說可得(1)、(2),式中:E為堿性蛋白酶;S為底物;ES為復合物;P為產(chǎn)物;k1,k-1為速度常數(shù)。

在水溶液中,第二步反應為限速步驟,并且逆過程可忽略。由酶促水解反應速率決定其不可逆反應階段的速率,應速率用R來表示,S0代表初始底物濃度,可得

酶解反應過程中,產(chǎn)物和底物的抑制可導致蛋白酶在酶解過程中失活,失活機制如(4)所示(其中Ea表示具有活力的蛋白酶,Ei表示鈍化的蛋白酶,kd為抑制常數(shù))

則上述反應過程的動力學方程式為(e表示總蛋白酶)

將方程(3)與方程(5)相除,可得到方程(6)

蛋白酶在水解體系中以游離狀態(tài)E和復合物ES的形式存在,游離狀態(tài)和復合物的和應當是總蛋白酶。因此得到方程(7)

根據(jù)Briggs-Haldane假設(shè):實際上,許多酶的催化常數(shù)很高,即ES分解為產(chǎn)物這個過程對酶反應速度的影響不能忽略[24-25]。
穩(wěn)態(tài)通常在反應初期的數(shù)毫秒內(nèi)建立,當反應進行一段時間后,可認為ES的生成速度和分解速度相同,這一假設(shè)對大多數(shù)酶促反應是合理的。當反應體系中酶與酶底復合物濃度保持不變時,則有產(chǎn)生的復合物與分解的復合物相等,對于反應(1)根據(jù)假設(shè)可有:
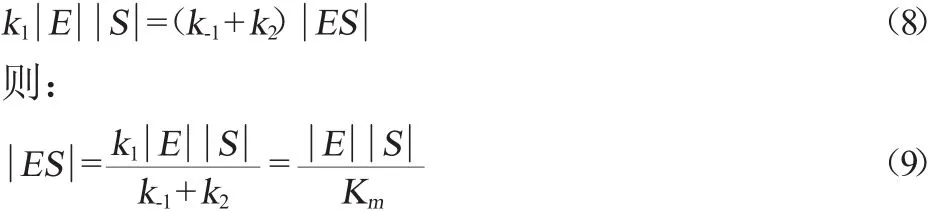
由(9)可得

將方程(9)代入方程(7),因為底物濃度遠高于酶濃度,可認為 S ≈s0,則可得到方程(11)

米氏常數(shù)(Km)可以判斷酶的專一性和天然底物,Km表示酶和底物之間的親和能力,Km值越小,即達到最大酶促反應速度一半所需要的底物濃度越小,親和能力越強,反之亦然。酶活性測定體系中一般保證Km<<s0,公式(11)可以簡化為:

把方程(12)代入方程(6),可得:

對公式(13)兩邊進行積分,水解度的積分上限值為DH,下限值為0,總酶量的積分上限值為e,下限值為e0,其積分方程為:

對(14)兩邊進行積分可得:

將(15)簡化:

通過整理方程(3)、(9)、(12)和(16),得到

方程(16)代入方程(3),則可得方程(18)
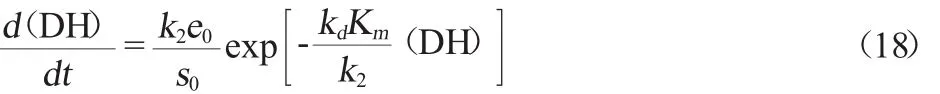
設(shè)定:

由方程(19)可知,a的大小只與酶解體系初始底物濃度和初始蛋白酶濃度有關(guān);在恒溫水解反應中,b的大小應為一個常數(shù)。則得蛋白質(zhì)酶解過程中水解速率的動力學模型:

由方程(19)可知,由于k2只與水解溫度有關(guān),在恒溫水解反應中k2為定值,a的大小隨著初始底物濃度的上升而減小,隨著初始蛋白酶濃度的上升而增大;b的大小與初始底物濃度和初始蛋白酶濃度無關(guān),但與水解溫度的高低有關(guān),在恒溫水解反應中,b的大小應為一個常數(shù),當a為負值時,其水解速率也為負,此時鷹嘴豆蛋白無法水解[15,26]。
對方程(20)積分可得水解度與水解時間的關(guān)系方程式如下:

2.2 酶解動力學參數(shù)的確定
通過研究不同初始底物濃度和初始蛋白酶濃度對水解度的影響,來確定動力學模型中的參數(shù)。以鷹嘴豆蛋白為底物進行水解,確定初始酶解條件為:底物濃度4%,時間120 min,pH 8.0,溫度55 ℃,酶添加量4 000 U/g,在此基礎(chǔ)之上考察不同底物濃度2%(20 g/L)、4%(40 g/L)、6%(60 g/L)、8%(80 g/L)、10%(100 g/L)和酶添加量2 000 U/g(0.30 g/L)、3 000 U/g(0.45 g/L)、4 000 U/g(0.60 g/L)、5 000 U/g(0.75 g/L)、6 000 U/g(0.90 g/L)對水解度的影響。試驗結(jié)果如圖1,圖2所示。
由圖1,圖2可知,在固定初始底物濃度和酶濃度的條件下,鷹嘴豆蛋白水解度隨酶解時間的增加而升高,而酶解速率逐漸降低,其原因可能是隨酶解時間的增加,底物中的蛋白質(zhì)易被水解的肽鍵數(shù)量減少和酶活降低[27]。當酶解時間達到60 min后,增速放緩,這可能與酶解體系中的pH改變和底物抑制有關(guān)[27],同時蛋白酶活力會隨水解時間增加而降低,相同水解時間條件下,高底物濃度水解液的水解度要低于低底物濃度的水解度,且底物質(zhì)量濃度較高時,酶失活速率較快。
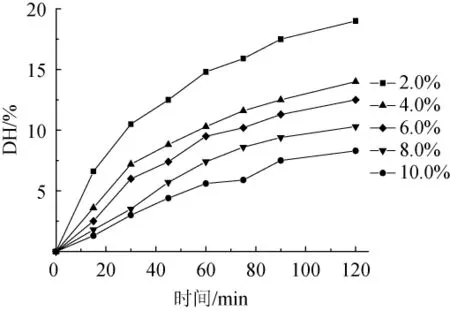
圖1 初始底物濃度對水解度的影響Fig.1 Effect of original substrate concentration on the hydrolysis degree

圖2 初始酶濃度對水解度的影響Fig.2 Effect of original enzyme concentration on the hydrolysis degree
將圖1,圖2的試驗結(jié)果代入公式(21)進行非線性擬合,得到不同初始底物濃度(S0)和初始酶濃度(E0)所對應的動力學參數(shù)a與b,結(jié)果見表1所示。
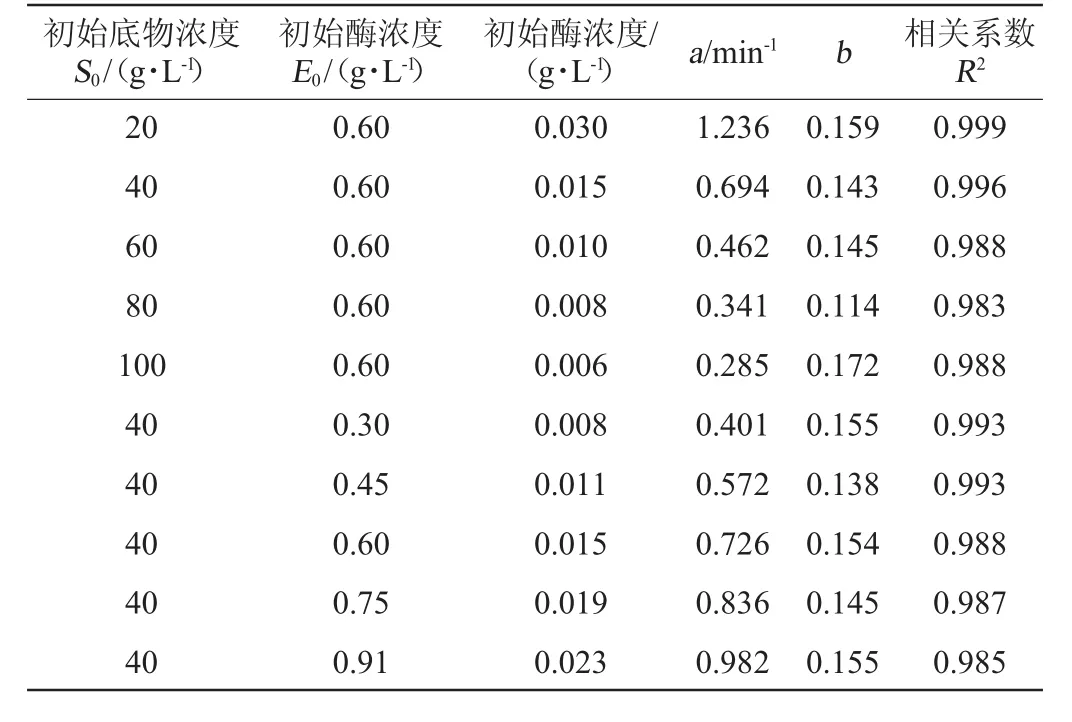
表1 酶解動力學參數(shù)Table 1 Kinetic parameters of enzymatic hydrolysis
由表1可知,參數(shù)a隨著初始底物濃度的增加而減小,隨著初始蛋白酶濃度的增大而增大。動力學參數(shù)b不受初始底物濃度和酶濃度的影響,其數(shù)值在一個狹窄的范圍里波動,幾乎接近一個常數(shù),這分別與已有報道大米蛋白[28]和蕎麥蛋白[11]的酶解動力學參數(shù)b值的變化趨勢一致。因而在本研究中,鷹嘴豆蛋白的酶解動力學參數(shù)b值用其平均值0.148表示,這與模型推導所得結(jié)論一致。
2.3 酶解反應速率常數(shù)的確定
為了得到酶解反應速率常數(shù)k2,以a為縱坐標,E0/S0值為橫坐標作圖,并驗證方程的擬合情況,結(jié)果如圖3所示。

圖3 a值隨著不同的E0/S0值的變化趨勢Fig.3 Change trend of a value with different E0/S0 values
從圖3所得到的線性關(guān)系式,y=39.522x-0.080 4,R2=0.984 0,可知a值隨著E0/S0值關(guān)系曲線所對應的方程(22):

酶解反應速率常數(shù)k2=39.522 min-1,水解速率的動力學模型:
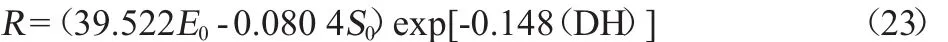
水解度的動力學模型:

由動力學模型(23),(24)可知,水解速率隨著初始蛋白酶濃度的增加而上升,但隨著初始底物濃度和水解度的上升而下降。其原因可能是水解度的增大,底物中的蛋白易被水解的肽鍵數(shù)量減少和酶活降低,從而導致水解反應速率下降,這與圖1和圖2中的試驗結(jié)果相符。由圖3可知,a值與E0/S0值有良好的線性關(guān)系,與反應機理推導所得的公式一致,再次證明動力學模型的有效性[29]。酶解反應速率常數(shù)k2=39.522 min-1。
2.4 蛋白酶失活常數(shù)的確定
將方程(9)、(10)、(12)代入方程(5),可得:

式中:k4為水解反應過程中堿性蛋白酶的失活常數(shù)。
將a與b相乘得到關(guān)系式:

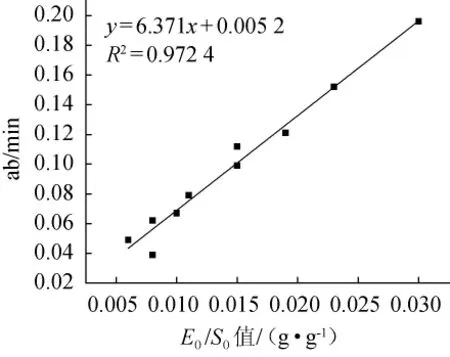
圖4 ab值隨著不同的E0/S0值的變化趨勢Fig.4 Change trend of ab value with different E0/S0 values
由y=6.371x+0.005 2,R2=0.972 4,可知a值隨著E0/S0值關(guān)系曲線所對應的方程(28):

可知鷹嘴豆蛋白水解過程中堿性蛋白酶的失活常數(shù)為k4=6.371 min-1。
2.5 鷹嘴豆蛋白酶解動力學模型驗證
為了驗證上述動力學模型的準確性,將動力學模型的結(jié)果與實際水解結(jié)果進行對比。確定初始酶解條件為底物濃度3%,酶濃度4 000 U/g,pH8.0,溫度55℃,結(jié)果如圖5所示。

圖5 實際水解度與模型預測水解度Fig.5 Hydrolysis degree of actual and predicted model
如圖5所示,在水解初始階段,試驗值略低于擬合值,可能由于不同肽鏈長度的酶解產(chǎn)物對水解反應速率的抑制作用,同時底物中的蛋白質(zhì)肽鏈解聚與肽鏈斷裂使肽鏈解聚不充分,導致酶與底物結(jié)合不充分,所以擬合值比試驗值略高[30]。從整體來看,動力學模型的預測值與試驗值吻合較好,表明所建動力學模型對實際酶解過程具有一定的指導作用。
3 結(jié)論
(1)基于米氏方程理論,應用數(shù)學推導結(jié)合試驗研究的方法得到鷹嘴豆蛋白酶解動力學模型。
(2)通過試驗發(fā)現(xiàn):鷹嘴豆蛋白水解過程中酶解速率隨水解時間升高而降低;在一定濃度范圍內(nèi),鷹嘴豆蛋白的水解度隨堿性蛋白酶質(zhì)量濃度的升高而增大,隨初始鷹嘴豆蛋白質(zhì)量濃度的升高而降低,在水解過程中同時存在產(chǎn)物和底物抑制現(xiàn)象。
(3)鷹嘴豆蛋白水解速率的動力學模型:R=(39.522E0-0.080 4S0)exp[-0.148(DH)],水解度-水解時間的動力學模39.522E0/S0-0.080 4,b=0148。根據(jù)酶反應動力學的基本理論及相關(guān)試驗結(jié)果,得出堿性蛋白酶水解過程酶失活的動力學常數(shù)Kd=6.371 min-1。通過動力學模型的驗證試驗,得出試驗結(jié)果與模型擬合度很好,說明所建鷹嘴豆蛋白酶解動力學模型可用于指導和優(yōu)化酶解工藝。

