巖藻糖環(huán)境對膠質(zhì)細胞Aβ42蛋白內(nèi)化過程的影響
張郃
?
巖藻糖環(huán)境對膠質(zhì)細胞Aβ42蛋白內(nèi)化過程的影響
張郃
100053 北京,首都醫(yī)科大學(xué)宣武醫(yī)院藥學(xué)部,Email:zhanghe0718@sina.com
探討巖藻糖環(huán)境對膠質(zhì)細胞內(nèi)化不同形態(tài) Aβ42蛋白過程的影響。
分別測定巖藻糖富集及缺失兩種環(huán)境中小鼠小膠質(zhì)細胞及大鼠星型膠質(zhì)細胞對單體及寡聚體 Aβ42蛋白的攝取量,檢測被巖藻糖活化后小膠質(zhì)細胞的 MAPK 激酶磷酸化程度變化,探明清道夫家族 SRA 受體及 SRB 受體在兩種膠質(zhì)細胞中的表達差異。
小鼠小膠質(zhì)細胞在巖藻糖預(yù)處理及巖藻糖環(huán)境持續(xù)作用下對 Aβ42單體攝取量均顯著增加,巖藻糖預(yù)處理導(dǎo)致大鼠星型膠質(zhì)細胞單體Aβ42攝入量降低。巖藻糖預(yù)處理導(dǎo)致小鼠小膠質(zhì)細胞和大鼠星型膠質(zhì)細胞對寡聚體 Aβ42攝取量下降,巖藻糖持續(xù)作用后,該趨勢出現(xiàn)反轉(zhuǎn)。基因檢測表明兩種膠質(zhì)細胞中 SRB 受體高表達,SRA 受體在星型膠質(zhì)細胞無表達。巖藻糖持續(xù)作用引起小鼠小膠質(zhì)細胞 p38-MAPK 信號通路的激活,該信號可能引發(fā)小膠質(zhì)細胞細胞吞飲過程。
巖藻糖與膠質(zhì)細胞清道夫受體的作用模式對細胞的 Aβ42的內(nèi)化過程產(chǎn)生影響,SRA 受體可能參與小膠質(zhì)細胞吞噬過程中 p38-MAPK 激酶的激活過程而增強小膠質(zhì)細胞對病理蛋白的攝取。為尋找阿爾茨海默病中膠質(zhì)細胞相關(guān)的潛在免疫治療靶標(biāo)提供了理論依據(jù)。
小神經(jīng)膠質(zhì)細胞; 星型細胞; 內(nèi)化; 巖藻多糖; 表面吞噬受體; 阿爾茨海默病
阿爾茨海默病(AD)是老年期癡呆最常見的類型,也是老年人致殘致死的第四位病因[1]。其病理特征為腦內(nèi)病理性蛋白 Aβ 大量沉積形成斑塊,圍繞其四周的高激活態(tài)小膠質(zhì)細胞喪失了原有的 Aβ 蛋白清除能力,同時釋放大量炎癥因子導(dǎo)致腦內(nèi)神經(jīng)元損傷及進一步的認(rèn)知障礙[2-4]。膠質(zhì)細胞在 AD 的進程中占據(jù)核心地位[5-6],可通過其表面清道夫家族受體清除腦內(nèi)不同聚集形態(tài)的 Aβ,上述受體結(jié)構(gòu)上并不同源,但進化上高度保守[7],通過與病原相關(guān)分子模式(入侵的病原體或病理性蛋白構(gòu)象)相互作用來激活或抑制膠質(zhì)細胞活性,從而調(diào)節(jié)腦內(nèi)免疫環(huán)境,如 SRA、SRB 受體。巖藻糖(fucoidan)是一種具有抗腫瘤活性的多聚陰離子結(jié)構(gòu)多糖[8],其分子結(jié)構(gòu)正是膠質(zhì)細胞模式識別受體家族的典型識別結(jié)構(gòu),被認(rèn)為是清道夫家族受體的非特異性配體[9],在對細胞表面受體產(chǎn)生占位性阻滯作用的同時可引發(fā)細胞信號級聯(lián)并誘導(dǎo)細胞進一步的生物學(xué)功能,該多糖的存在環(huán)境可能對不同聚集形式的 Aβ 蛋白進入膠質(zhì)細胞造成影響。Aβ 蛋白進入細胞消化清除的途徑由該蛋白的聚集形態(tài)決定[10]。內(nèi)吞作用被廣義地分為兩類,吞噬作用和胞飲作用,吞噬作用是指內(nèi)吞大于 200 nm 的顆粒物質(zhì);胞飲是內(nèi)吞的一種形式,與其他內(nèi)吞形式的吞噬直徑相比,巨胞飲體直徑較大,在某些因素刺激下,細胞膜皺褶形成大且不規(guī)則的原始內(nèi)吞泡,直徑可達 5 μm。膠質(zhì)細胞胞膜蛋白肌動蛋白重組過程依賴 p38-MAPK 信號級聯(lián)的激活,因此 p38-MAPK 的激活可能參與膠質(zhì)細胞對單體 Aβ42的胞飲過程,本研究采用巖藻糖作為研究工具,探討膠質(zhì)細胞表面模式識別受體內(nèi)化不同形式 Aβ 蛋白的分子機制。
1 材料與方法
1.1 材料
單體Aβ42(mAβ42)和寡聚體 Aβ42(oAβ42)微量蛋白檢測試劑盒購自日本IBL 公司;Aβ 蛋白 4G8 抗體購自美國 Covance 公司;大鼠抗小鼠 SRA 抗體購自英國 AbD Serotec公司;Trizol RNA 提取試劑購自美國 Invitrogen 公司;反轉(zhuǎn)錄試劑盒K1621 購自美國 Fermentas 公司;BCA 蛋白檢測試劑盒購自美國Pierce 公司;ABI9700 型和OpticonMonitor2 型PCR 擴增儀分別購自美國 ABI 公司和Bio-Rad 公司;甘氨酸、過硫酸銨、丙烯酰胺、Tris 鹽、十二烷基磺酸鈉(SDS)、四甲基乙二胺(TEMED)、TMB 顯色底物購自天根生化科技(北京)有限公司;胰蛋白酶購自美國 Amresco 公司;低糖 DMEM 培養(yǎng)液、胎牛血清購自美國 Hyclone 公司;蛋白酶抑制劑購自德國 Calbiochem 公司;蛋白磷酸化檢測試劑盒購自英國 Abcam 公司;25 cm 細胞培養(yǎng)瓶、6 孔板、96 孔板購自美國 Corning 公司;DL2000 marker 購自上海源葉生物科技有限公司;Aβ42蛋白購自美國 Peptide 公司;巖藻多糖購自美國 Sigma 公司;SpectraMax M5 酶標(biāo)儀購自美國 Molecular Devices 公司;BV2 小膠質(zhì)細胞購自通派(上海)生物科技有限公司;大鼠星型膠質(zhì)細胞購自美國 Sciencell 公司;DAPI、山羊血清、FITC 標(biāo)記羊抗鼠二抗均購自北京中杉金橋生物技術(shù)有限公司;HRP 標(biāo)記羊抗大鼠二抗、ECL 發(fā)光試劑購自上海碧云天生物技術(shù)公司;胞膜蛋白提取試劑盒購自美國 Merck Millipore 公司。
1.2 方法
1.2.1 mAβ42和 oAβ42的制備 mAβ42制備:用 HFIP 將 Aβ42溶解至 1 mg/ml,水浴超聲 10 min 后,分裝于離心管,待 HFIP 揮發(fā)過夜后–20 ℃凍存。使用時每 30 μg 的 Aβ42用 1 μl 的 DMSO 溶解,水浴超聲 5 min 后按實驗所需濃度加入細胞培養(yǎng)基。
oAβ42制備:將 Aβ42用 DMSO 溶至5 mmol/L,水浴超聲后用培養(yǎng)基稀釋至 100 μmol/L,在 4 ℃孵育 24 h[11]。
1.2.2 蛋白磷酸化水平測定 于 96 孔板接種 BV2 小鼠小膠質(zhì)細胞,密度 3 × 105個/孔,加入巖藻糖(100 μg/ml)或 oAβ42(1 μmol/L)后孵育2 h,對照組不做處理。免疫熒光法測定 MAPK 激酶家族磷酸化水平,按試劑盒說明,每孔加入 50 μl 混有顯色增強劑的裂解液進行裂解。各孔裂解物轉(zhuǎn)移至相應(yīng)磷酸化蛋白檢測孔板。加入相應(yīng)磷酸化蛋白的捕獲抗體與檢測抗體的等體積混合物,經(jīng)孵育后用 0.05% PBST 洗 3 遍。各孔加入 100 μl 的 ADHP 顯色底物,300 r/min 孵育 10 min 后加入停止液終止反應(yīng),以 530 ~ 540 nm 為激發(fā)光波長,于 590 ~ 600 nm 處檢測各組熒光信號強度,表示為蛋白磷酸化水平。
1.2.3 膠質(zhì)細胞攝取 Aβ 蛋白量的測定 于 6 孔板中完成該細胞實驗操作,接種密度約 106個/孔,于BV2 小膠質(zhì)細胞(或星型膠質(zhì)細胞)培養(yǎng)基中加入 mAβ42(1 μg/ml)或 oAβ42(1 μmol/L)約4.5 μg/ml,孵育 3 h,分別檢測細胞中mAβ42和 oAβ42的量。巖藻糖試驗組加入巖藻糖(100 μg/ml)孵育細胞 30 min(預(yù)處理)或 3 h(持續(xù)孵育),其中巖藻糖預(yù)處理組在 30 min 時吸去原有培養(yǎng)基,PBS 洗 3 次后,加入 mAβ42(1 μg/ml)或 oAβ42(1 μmol/L)繼續(xù)孵育細胞至 3 h。按蛋白微量檢測試劑盒說明測出各組細胞裂解并高速離心后上清部分 mAβ42及 oAβ42的蛋白濃度,同時按 BCA 試劑盒操作步驟測定各組細胞實際蛋白濃度,用 mAβ42及 oAβ42的蛋白濃度除以各組蛋白的實際濃度,得到該實驗組單位細胞蛋白中具有的 Aβ42濃度。以對照組(單獨 oAβ42孵育)細胞測得的 oAβ42含量為 100% 換算成百分比形式,即代表被 BV2 細胞吞噬的 oAβ42的量。
1.2.4 細胞免疫熒光 BV2 小膠質(zhì)細胞及大鼠星型膠質(zhì)細胞以每孔 5 × 105的密度接種至 12 孔板過夜,加入 mAβ42(1 μg/ml)孵育 5 h。于12 孔板接種 BV2 小膠質(zhì)細胞,用單獨 mAβ42;mAβ42+ 巖藻糖(30 min)、mAβ42+ 巖藻糖(3 h)三個條件作用 BV2 小膠質(zhì)細胞,之后 PBS 洗細胞兩次,樣品經(jīng) 4% 多聚甲醛室溫固定 30 min 后,PBS 洗滌 2 次,用 5% 山羊血清室溫封閉 2 h。加入抗 Aβ424G8 抗體(1:500)4 ℃孵育過夜。PBS 洗細胞 5 遍,加入羊抗鼠 FITC 熒光二抗(1:1000)室溫孵育 2 h,PBS 洗 5 遍。加入 DAPI 室溫孵育 2 h 進行細胞核染色,加入封片劑,4 ℃避光保存。對照組細胞的一抗用 PBS 代替,其余操作同前,利用激光共聚焦顯微鏡觀察 mAβ42在膠質(zhì)細胞內(nèi)的分布(激發(fā)波長 488 nm,發(fā)射波長525 nm),圖像處理采用 ZEN lite(Carl Zeiss)軟件,用 image J2X 軟件進行 FITC 熒光的強度對比。
1.2.5 小膠質(zhì)細胞與星型膠質(zhì)細胞受體表達量測定 用 Trizol 試劑按照說明書提取 BV2 小膠質(zhì)細胞及大鼠星型膠質(zhì)細胞總 RNA,用反轉(zhuǎn)錄試劑盒,使用六核苷酸隨機引物將提取的 RNA 反轉(zhuǎn)錄為 cDNA。42 ℃ 1 h,70 ℃ 5 min 為反應(yīng)條件。PCR 檢測兩種細胞的 SRA 及 SRB 基因表達。引物如下:小鼠:SRA-F(RT)ACAACATCACCAACGACC TCAG;SRA-R(RT)GTCCAGTAAGCCCTCTGTC TCC;SRB-F(RT)ACCTCCCAGACATGCTTCCCA TAA;SRB-R(RT)CGATCTTGCTGAGTCCGTTCCA;GAPDH-F ACGGCAAGTTCAACGGCACAG;GAPDH-R CGCCAGTAGACTCCACGACAT;大鼠:SRA-F(RT)TCGTCTGTAGGAGCTTGGGATAC;SRA-R(RT)TGAGCAGCGATTTCATAGTTGTG;SRB1-F(RT)CCCATCCTCACTTCCTCAACG;SRB1-R(RT)CTCAATCTTCCCAGTTTGTCCAAT;GAPDH-F CAAGGGCATCCTGGGCTACACT;GAPDH-R CTCTCTCTTCCTCTTGTGCTCTTGC,95 ℃預(yù)熱 3 min;95 ℃ 10 s,60 ℃ 1 min,35 個循環(huán)。溶解曲線分析:60 ~ 92 ℃,每 1 ℃讀取數(shù)據(jù)。
1.2.6 Western blot 檢測 BV2 細胞膜蛋白中的 SRA 受體表達 提取 BV2 小膠質(zhì)細胞富集的膜蛋白成分用于 Western blot 蛋白檢測,按膜蛋白提取試劑盒說明用提取試劑 2A(柔和)或 2B(強烈)各 0.1 ml,各自與膜提取液等體積混合為膜蛋白提取工作液備用。將 BV2 細胞用冰冷 PBS 洗滌后集中于離心管,4 ℃ 1000 ×離心 5 min 后用1 ml 含有蛋白酶抑制劑的細胞裂解液重懸,4 ℃孵育 10 min。4 ℃、1000 ×離心 5 min,上清即為胞漿(可溶)蛋白部分,沉淀部分為胞膜蛋白成分,即加入細胞膜提取工作液,搖床室溫孵育45 min。于4 ℃、16 000 ×離心 15 min,棄去沉淀,上清部分即為富集的膜蛋白成分。BCA 法測定膜蛋白成分的蛋白濃度后,置于–80 ℃?zhèn)溆谩?/p>
將提取的細胞膜蛋白與 2 倍體積的 SDS 上樣緩沖液混合,按每孔 20 μl 體積上樣進行蛋白電泳,95 V 濕轉(zhuǎn) 45 min 至 NC 膜,NC 膜用 5%脫脂奶室溫封閉 2 h 后,0.1% PBST 洗 1 遍,加入大鼠抗 SRA(1:1000)一抗,4 ℃孵育過夜,次日 0.1% PBST 洗膜 3 遍,加入 HRP-羊抗大鼠二抗(1:3000)37 ℃孵育 2 h,0.1% PBST 洗膜4 遍,進行 ECL 發(fā)光檢測。
1.3 統(tǒng)計學(xué)處理
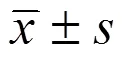
2 結(jié)果
2.1 巖藻糖對 BV2 小膠質(zhì)細胞內(nèi)化不同形態(tài) Aβ42的影響
按試劑盒要求,用ELISA 方法測細胞裂解液中 mAβ42和 oAβ42的含量,實驗重復(fù) 3 次,結(jié)果表示為相對對照組(mAβ42或 oAβ42單獨孵育)的百分比(圖 1)。
2.2 巖藻糖對大鼠星型膠質(zhì)細胞內(nèi)化不同形態(tài) Aβ42的影響
將 3 組大鼠星型膠質(zhì)細胞按方法 1.2.3 中實驗步驟相同操作,結(jié)果見圖 2。
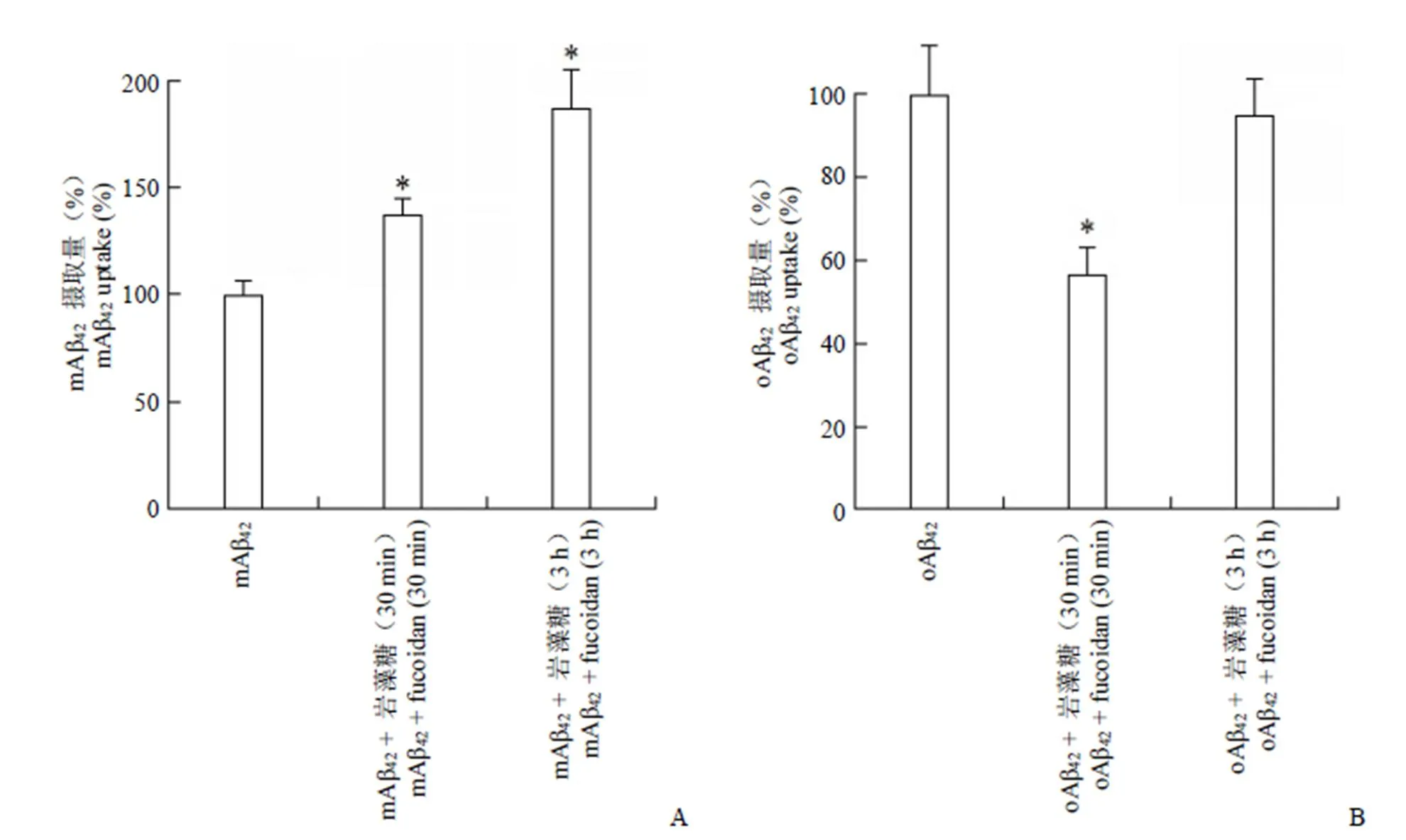
圖 1 巖藻糖對小膠質(zhì)細胞攝取 mAβ42(A)及 oAβ42(B)的影響(與Aβ42單獨處理組相比,*P < 0.05)
Figure 1 Effects of fucoidan on mAβ42(A) and oAβ42(B) uptake in BV2 microglia (compared with Aβ42treatmentalone,*< 0.05)
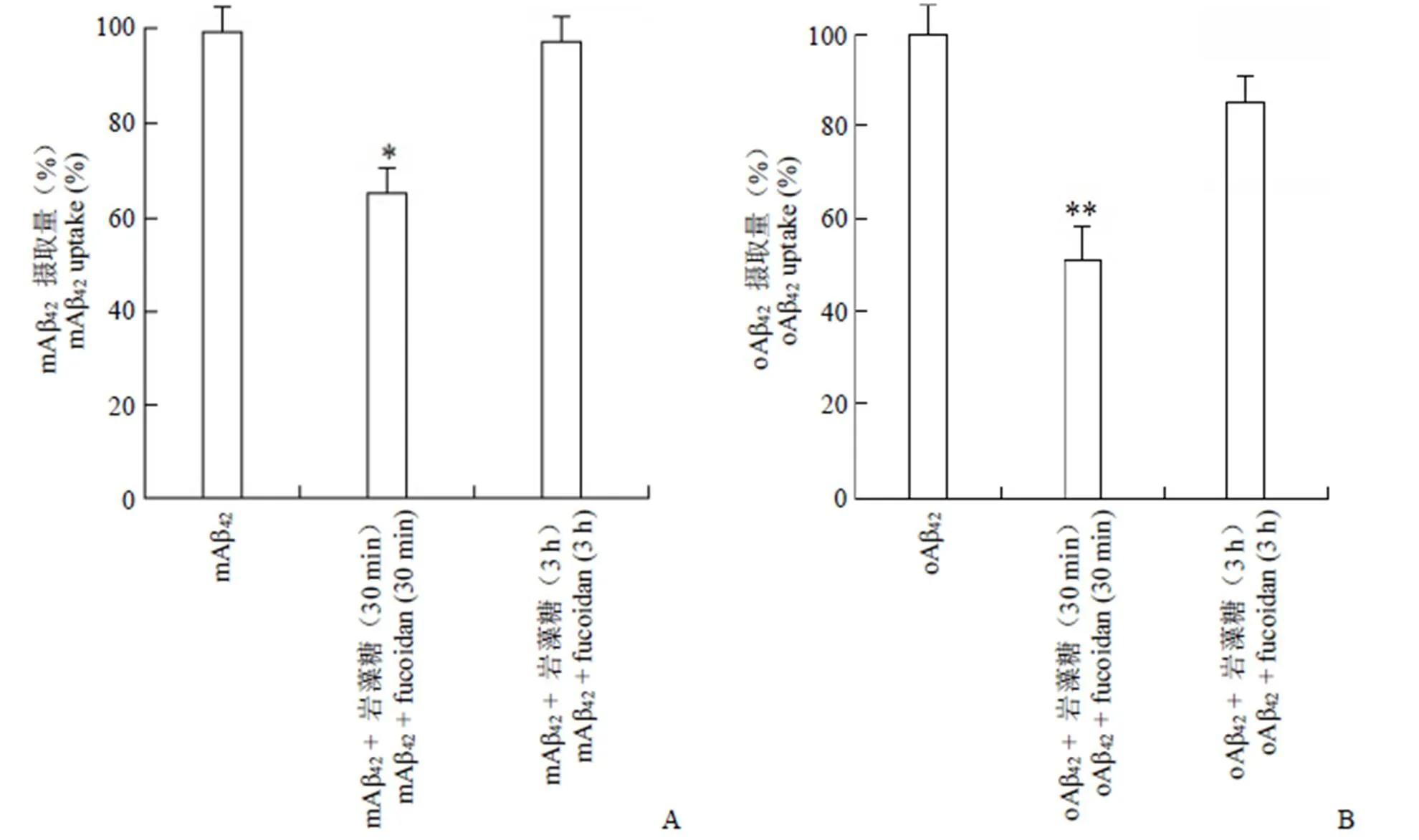
圖 2 巖藻糖對星型膠質(zhì)細胞攝取 mAβ42(A)及 oAβ42(B)的影響(與Aβ42單獨處理組相比,*P < 0.05,**P < 0.01)
Figure 2 Effects of fucoidan on mAβ42(A) and oAβ42(B) uptake in astrocytes (compared with Aβ42treatmentalone,*< 0.05,**< 0.01)
2.3 Aβ42蛋白進入膠質(zhì)細胞的細胞免疫熒光
為查明 Aβ42在小膠質(zhì)細胞及星型膠質(zhì)細胞攝入后的胞內(nèi)分布情況,用 mAβ42孵育小膠質(zhì)細胞及星型膠質(zhì)細胞 5 h,用共聚焦顯微鏡對mAβ42進行細胞定位(圖 3A 和3B),并檢測了mAβ42處理兩種膠質(zhì)細胞 3 h,Aβ42孵育及Aβ42+ 巖藻糖持續(xù)阻斷 3 h 組的 Aβ42熒光(圖 3C),并做熒光強度對比(圖 3D)。結(jié)果顯示,清道夫受體阻斷劑巖藻糖不能阻止 mAβ42進入小膠質(zhì)細胞,在巖藻糖持續(xù)存在的條件下,BV2 小膠質(zhì)細胞攝取 mAβ42的熒光相比對照組顯著增強。
2.4 巖藻糖作用 BV2細胞后 MAPK 激酶家族磷酸化水平的測定
巖藻糖的存在使 BV2 小膠質(zhì)細胞吞入 mAβ42顯著增加,經(jīng)過巖藻糖(100 μg/ml)預(yù)處理的膠質(zhì)細胞攝取oAβ42的量呈現(xiàn)顯著的下降趨勢,而巖藻糖持續(xù)存在于實驗體系的情況下,這種趨勢出現(xiàn)了明顯反轉(zhuǎn),推測是巖藻糖作用導(dǎo)致細胞內(nèi)吞形式的轉(zhuǎn)變所致。因此在小膠質(zhì)細胞中測定了巖藻糖持續(xù)存在實驗體系的條件下,MAPK 激酶家族(p38-MAPK、JNK、ERK)磷酸化的水平,以單獨細胞條件下細胞的磷酸化測定水平作為對照,結(jié)果(圖4)顯示巖藻糖環(huán)境下,應(yīng)激激活的蛋白激酶 p38-MAPK、JNK 磷酸化水平顯著高于空白細胞組及 oAβ42處理組。
2.5 膠質(zhì)細胞中清道夫家族受體表達量測定
小膠質(zhì)細胞與星型膠質(zhì)細胞在巖藻糖環(huán)境中表現(xiàn)出不同的mAβ42吞噬規(guī)律,推測是由于這兩種細胞中吞噬受體的表達差異造成[12-13],于是分別測定了實驗中兩種膠質(zhì)細胞主要司職病理蛋白吞噬的 SRA 與 SRB 受體[7]表達量。結(jié)果顯示,SRA、SRB 兩種清道夫受體在小膠質(zhì)細胞中均高度表達,而星型膠質(zhì)細胞中僅檢測到 SRB 受體表達(圖5)。
2.6 小膠質(zhì)細胞 SRA 蛋白的檢測
進一步對在 BV2 細胞中表達的 SRA 受體進行 Western blot 檢測,該受體屬于同源三聚體跨膜糖蛋白,由于在 RIPA 裂解液中只能檢測到極微弱的 SRA 條帶,采用膜蛋白提取試劑盒得到富集的 BV2 小膠質(zhì)細胞膜蛋白進行 Western blot 檢測,GADPH 為內(nèi)參蛋白。結(jié)果顯示,60 kD 處的 SRA 受體單個亞基條帶,及 190 kD 左右為 SRA 受體全長條帶。在2B提取液中可以檢測到富集的 SRA 受體條帶以及 190 kD 處的 SRA 全長條帶,在作用柔和的2A提取液中,僅能觀察到 SRA亞基條帶,證實了該受體為典型的胞膜蛋白成分(圖 6)。
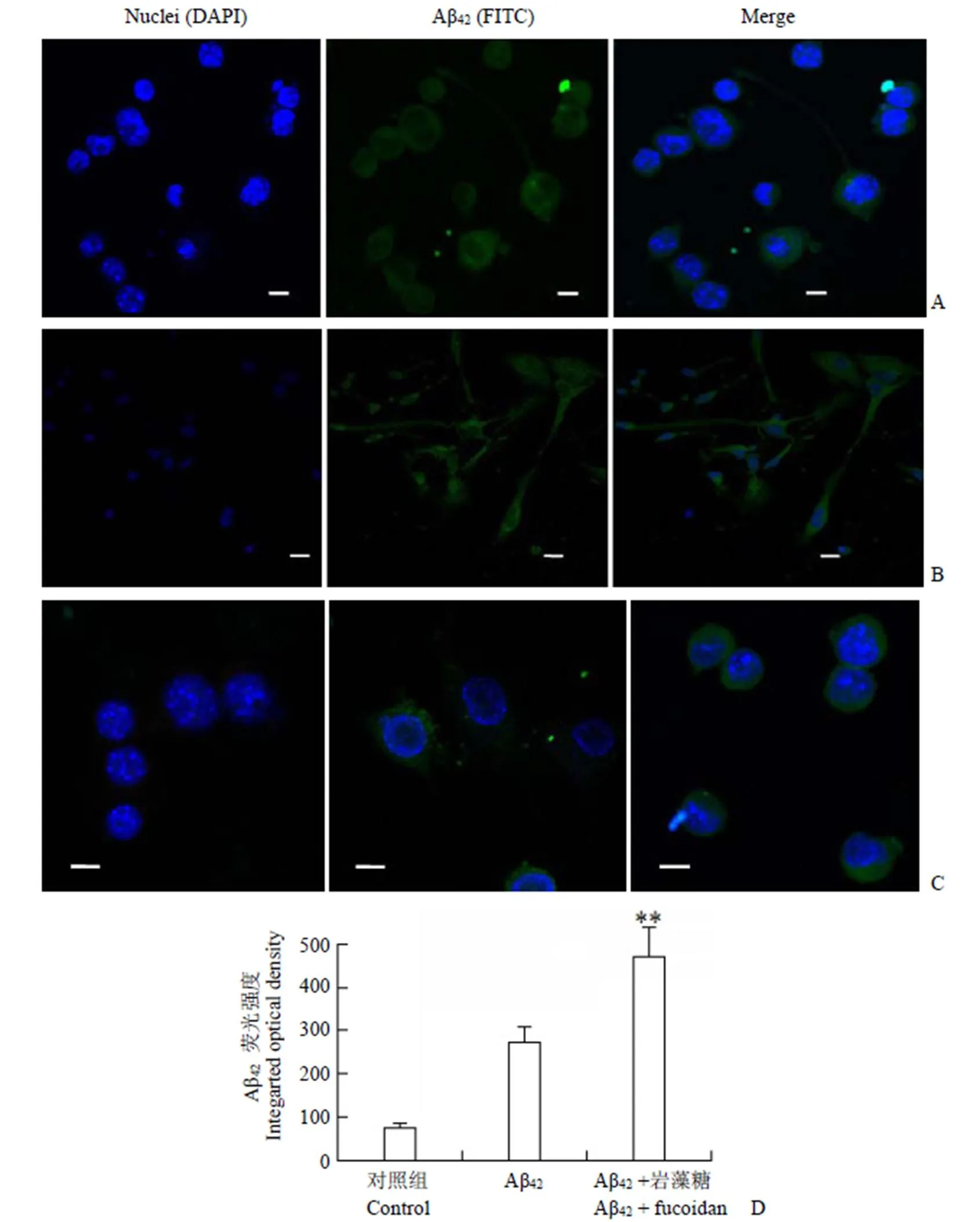
圖 3 共聚焦成像顯示 mAβ42在膠質(zhì)細胞的分布(A:小膠質(zhì)細胞;B:星型膠質(zhì)細胞;C:小膠質(zhì)細胞對照組 + Aβ42孵育 + Aβ42巖藻糖共同孵育,比例尺 10 μm;D:圖 3C 的各組細胞Aβ42熒光強度對比,**P < 0.01)
Figure 3 Confocal laser scanning of mAβ42in glia cells (A: Microglia; B: Astrocytes; C: Control /Aβ42/Aβ42+ Fucoidan, scale bars = 10 μm; D: Optical density of figure 3C, compared with Aβ42,**< 0.01)
3 討論
僅 5% 的早發(fā)性 AD(遺傳因素造成)為患者腦內(nèi) Aβ 生成增加所致[14],其余 95% 的晚發(fā)性 AD 中,如何使腦內(nèi) Aβ 的生成與清除達到平衡是治療的關(guān)鍵[15]。膠質(zhì)細胞一方面可吞噬降解 Aβ,另一方面造成吞噬后過度激活產(chǎn)生致炎因子引發(fā)炎癥,從而造成神經(jīng)元損傷[16],將膠質(zhì)細胞保持在趨化性和激活程度適中的、未衰老的有益狀態(tài)對于 AD 的免疫治療至關(guān)重要[17]。
本研究通過巖藻糖對膠質(zhì)細胞表面清道夫受體的占位性阻滯和細胞信號激活的雙重作用探討了其對膠質(zhì)細胞吞入 Aβ42蛋白的影響:巖藻糖作為膠質(zhì)細胞表面清道夫家族受體的占位性配體,并不能單純依靠受體阻斷作用阻止mAβ42進入 BV2 小膠質(zhì)細胞,進一步地,持續(xù)存在實驗體系中(3 h)的巖藻糖致使近對照組兩倍的 mAβ42攝入細胞,提示mAβ42并不完全由受體激發(fā)的吞噬途徑介導(dǎo)進入小膠質(zhì)細胞:該實驗條件下應(yīng)激相關(guān)的激酶 p38-MAPK 與 JNK 磷酸化程度顯著升高,上述激酶同時出現(xiàn)在膠質(zhì)細胞胞飲信號通路中 PI3 激酶的下游[18],膠質(zhì)細胞肌動蛋白重組過程依賴 p38-MAPK 信號級聯(lián)的激活[19],因此 p38-MAPK的激活參與了膠質(zhì)細胞對mAβ42的巨胞飲過程,該結(jié)果與并不表達 SRA 受體的大鼠星型膠質(zhì)細胞相反,推測 SRA 受體的存在是上述結(jié)果的主要原因。兩種膠質(zhì)細胞經(jīng)巖藻糖預(yù)處理后,對oAβ42的吞噬量均顯著下降,說明即使巖藻糖被從實驗環(huán)境洗脫,該分子仍可能黏附于膠質(zhì)細胞表面清道夫家族受體起到占位性阻斷作用,使得高聚集形態(tài)的 Aβ42進入細胞的過程受到抑制。
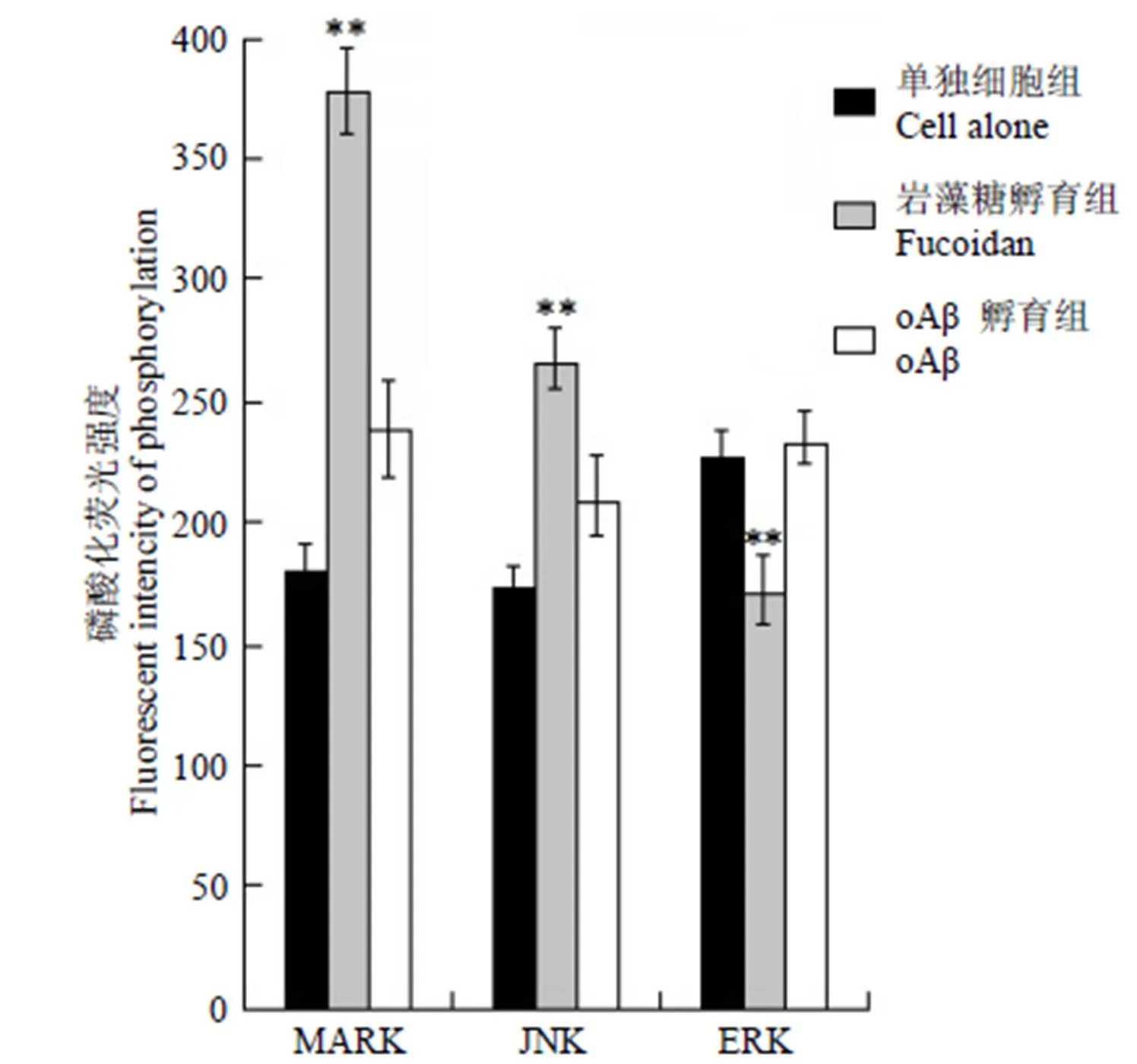
圖 4 巖藻糖或 oAβ42作用 BV2小膠質(zhì)細胞后對細胞MAPK 磷酸化水平的影響(與單獨細胞測定組及 oAβ42孵育組相比,**P < 0.01)
Figure 4 Level of MAPK-phosphorylation after sustain-incubate by fucoidan or oAβ42(compared with cell alone and cells treated with oAβ42,**< 0.01)
膠質(zhì)細胞在 AD 進程中扮演的角色一直備受爭議[20]。AD 晚期患者腦組織內(nèi)可存在大量圍繞小膠質(zhì)細胞的不溶性 Aβ 蛋白斑塊并伴隨慢性的炎癥狀態(tài):小膠質(zhì)細胞一方面可吞噬降解 Aβ,另一方面造成吞噬后過度激活產(chǎn)生致炎因子引發(fā)炎癥,從而造成神經(jīng)元損傷,衰老的膠質(zhì)細胞喪失了吞噬和消化病理蛋白的能力[21],導(dǎo)致其攜帶吞入的病理蛋白斑塊聚集使病灶擴展,當(dāng)膠質(zhì)細胞表面吞噬受體與帶有病原相關(guān)分子模式(細菌或病理性蛋白的特定結(jié)構(gòu))的配體結(jié)合并經(jīng)清道夫 SRA 受體途徑迅速吞入,可降低胞膜表面 TLR4 等感應(yīng)性受體介導(dǎo)的炎癥反應(yīng),使得膠質(zhì)細胞在吞噬異物時不至于過度激活而留存活力[22]。膠質(zhì)細胞對單體形態(tài) Aβ的內(nèi)化過程將有助于腦脊液外周沉沒機制對于腦實質(zhì)內(nèi) Aβ 高聚物負(fù)載的清除[23]。本研究證實,MAPK 激酶活化水平的提高可增強 Aβ42由胞飲作用進入小膠質(zhì)細胞的過程,腦內(nèi)此過程的發(fā)生將有益于不溶性 oAβ42的清除,巖藻糖的預(yù)阻斷作用占位性抑制mAβ42進入星型膠質(zhì)細胞,但在高度表達 SRA 受體的小膠質(zhì)細胞中,推測巖藻糖預(yù)處理引發(fā)的 MAPK 信號級聯(lián)誘發(fā)的吞飲過程掩蓋了小膠質(zhì)細胞表面黏附的巖藻糖分子對 mAβ42吞入阻斷作用,且?guī)r藻糖的持續(xù)存在可使此吞飲過程進一步增強,而缺失 SRA 受體的星型膠質(zhì)細胞中沒有觀察到此實驗現(xiàn)象。該實驗條件下與細胞生長分化相關(guān)的胞外調(diào)節(jié)蛋白激酶 ERK 磷酸化程度顯著降低,展現(xiàn)與同家族應(yīng)激激活的蛋白激酶 p38-MAPK 及 JNK 激酶的磷酸化程度變化相反的趨勢,其具體意義有待進一步查明。SRA 受體是清除腦內(nèi) Aβ42的主要受體,隨著年齡的增長,SRA 基因的腦內(nèi)表達量會漸進性下調(diào),而細胞在體外受到前炎性介質(zhì)刺激時,SRA 基因也會出現(xiàn)下調(diào)[24],提示該受體是衰老相關(guān)的炎癥狀態(tài)與 AD 發(fā)病間的紐帶。本實驗中,兩種膠質(zhì)細胞受體表達譜的差異是造成兩種膠質(zhì)細胞吞入 Aβ42蛋白規(guī)律存在顯著差異的原因。
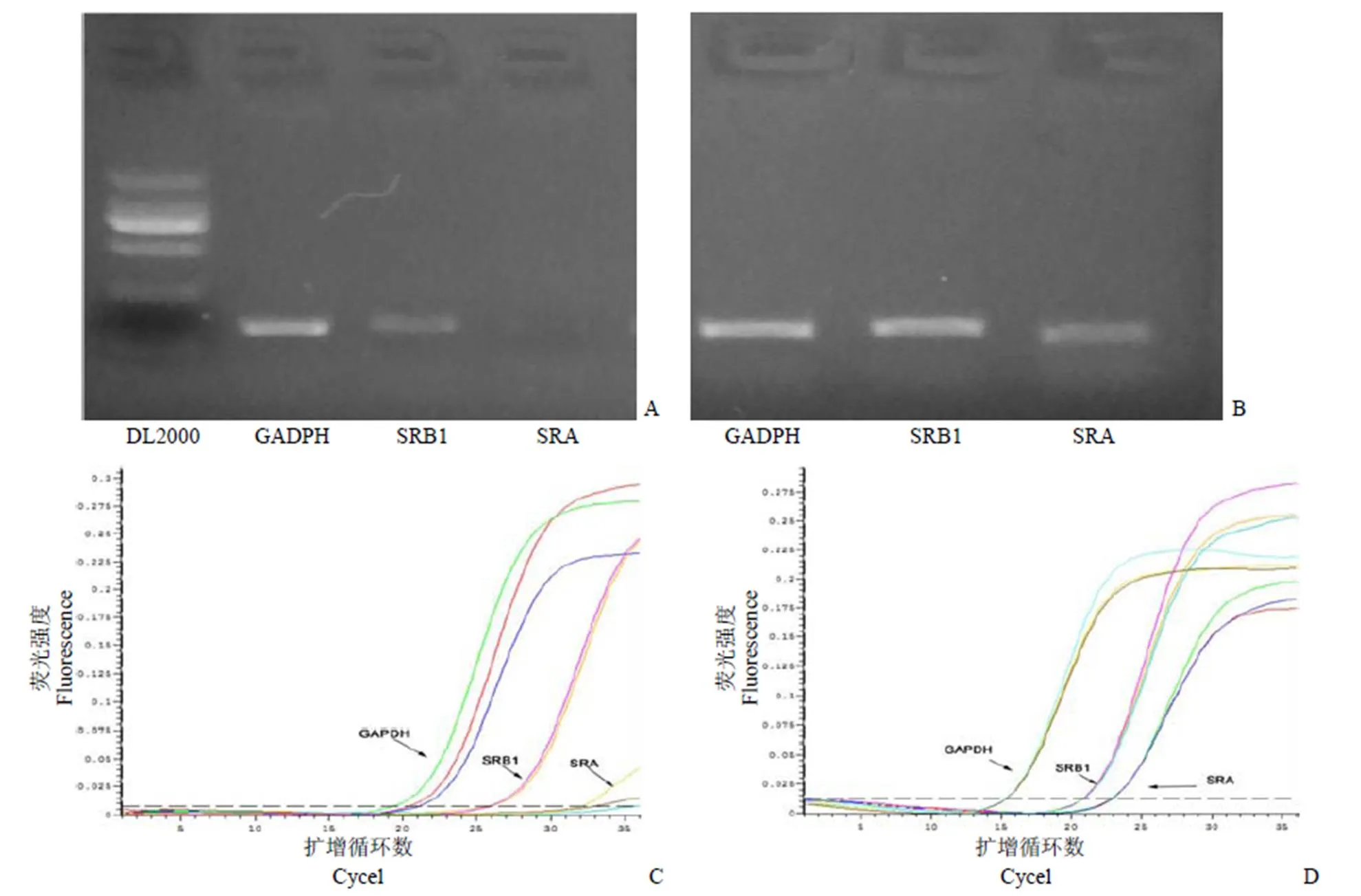
圖 5 反轉(zhuǎn)錄PCR 檢測大鼠星型膠質(zhì)細胞及小膠質(zhì)細胞的SRA、SRB 基因表達(A:大鼠星型膠質(zhì)細胞;B:小膠質(zhì)細胞;C:大鼠星型膠質(zhì)細胞擴增曲線;D:小膠質(zhì)細胞擴增曲線)
Figure 5 Gene expression and amplification curve of SRA,SRB in glia cells detected by reverse transcriptional PCR (A: Rat astrocytes; B: BV2 microglia; C: Amplification curve of rat astrocytes; D: Amplification curve of BV2 microglia)
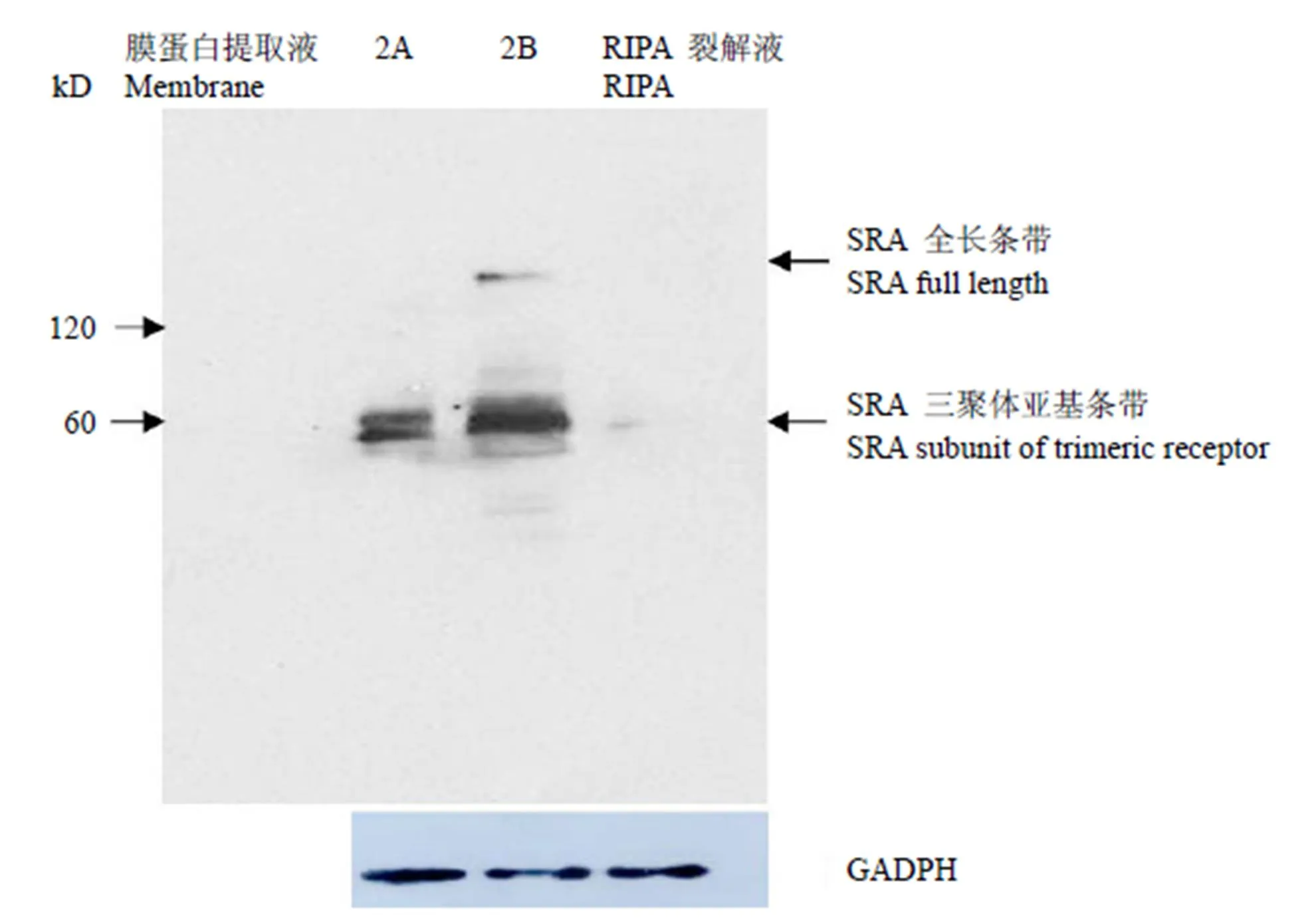
圖 6 膜蛋白提取液與 RIPA 裂解液中的 SRA 受體檢測
Figure 6 Prepared membrane protein extractions of BV2 cells were identified by Western blot for mouse SRA
本研究利用巖藻糖為研究工具探索了兩類膠質(zhì)細胞與 Aβ42蛋白的相互作用及攝取機制,在膠質(zhì)細胞中證實了巖藻糖作為其表面清道夫受體阻斷劑與吞飲過程激活劑的雙重作用及其效應(yīng)隨作用時間的變化,具體實驗操作過程中應(yīng)用的提前洗脫受體阻斷劑的實驗操作方式尚未見國內(nèi)外文獻報道,可為膠質(zhì)細胞吞噬病理性蛋白相關(guān)的受體理論研究提供參考。
[1] Wang YJ, Gao CY, Yang M, et al. Intramuscular delivery of a single chain antibody gene prevents brain Abeta deposition and cognitive impairment in a mouse model of Alzheimer's disease. Brain Behav Immun, 2010, 24(8):1281-1293.
[2] Lee JH, Espiera AR, Chen D, et al. Neonatal inflammatory pain and systemic inflammatory responses as possible environmental factors in the development of autism spectrum disorder of juvenile rats. J Neuroinflammation, 2016, 13(1):109.
[3] Chen Z, Jalabi W, Hu W, et al. Microglial displacement of inhibitory synapses provides neuroprotection in the adult brain. Nat Commun, 2014, 5:4486.
[4] Robinson M, Lee BY, Hane FT, et al. Recent progress in Alzheimer's disease research, part 2: genetics and epidemiology. J Alzheimers Dis, 2017, 57(2):317-330.
[5] Griciuc A, Serrano-Pozoa, Parrado AR, et al. Alzheimer's disease risk gene CD33 inhibits microglial uptake of amyloid beta. Neuron, 2013, 78(4):631-643.
[6] Gandy S, Heppner FL. Microglia as dynamic and essential components of the amyloid hypothesis. Neuron, 2013, 78(4):575-577.
[7] Yu Y, Ye RD. Microglial Aβ receptors in Alzheimer's disease. Cell Mol Neurobiol, 2015, 35(1):71-83.
[8] Atashrazm F, LowenthaL RM, Woods GM, et al. Fucoidan and cancer: a multifunctional molecule with anti-tumor potential. Mar Drugs, 2015, 13(4):2327-2346.
[9] Bateman DA, Chakarabarytty A. Two distinct conformations of Abeta aggregates on the surface of living PC12 cells. Biophys J, 2009, 96(10):4260-4267.
[10]Bateman DA, Chakarabarytty A. Cell surface binding and internalization of abeta modulated by degree of aggregation. Int J Alzheimers Dis, 2011, 2011:962352.
[11] Chromy BA, Nowak RJ, Lambert MP, et al. Self-assembly of Abeta(1-42) into globular neurotoxins. Biochemistry, 2003, 42(44): 12749-12760.
[12] Xu Z, Han K, Chen J, et al. Vascular endothelial growth factor is neuroprotective against ischemic brain injury by inhibiting scavenger receptor A expression on microglia. J Neurochem, 2017, 142(5):700- 709.
[13] Eugenin J, Vecchiola A, Murgas P, et al. Expression pattern of scavenger receptors and amyloid-beta phagocytosis of astrocytes and microglia in culture are modified by acidosis: implications for Alzheimer's disease. J Alzheimers Dis, 2016, 53(3):857-873.
[14] Roduit C, Frei R, Depner M, et al. Phenotypes of atopic dermatitis depending on the timing of onset and progression in childhood. JAMA Pediatr, 2017, 171(7):655-662.
[15] Bertsch M, Franchi B, Marcello N, et al. Alzheimer's disease: a mathematical model for onset and progression. Math Med Biol, 2017, 34(2):193-214.
[16] Gold M, El Khoury J. β-amyloid, microglia, and the inflammasome in Alzheimer's disease. Semin Immunopathol, 2015, 37(6):607-611.
[17] Floden AM, Combs CK. Microglia demonstrate age-dependent interaction with amyloid-β fibrils. J Alzheimers Dis, 2011, 25(2):279- 293.
[18] Hsu HY, Chiu SL, Wen MH, et al. Ligands of macrophage scavenger receptor induce cytokine expression via differential modulation of protein kinase signaling pathways. J Biol Chem, 2001, 276(31): 28719-28730.
[19] Ferreira R, Santos T, Viegas M, et al. Neuropeptide Y inhibits interleukin-1β-induced phagocytosis by microglial cells. J Neuroinflammation, 2011, 8:169.
[20] Hanisch UK, Kettenmann H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nat Neurosci, 2007, 10(11):1387-1394.
[21] Glat M, Skaat H, Menkes-caspi N, et al. Age-dependent effects of microglial inhibition in vivo on Alzheimer's disease neuropathology using bioactive-conjugated iron oxide nanoparticles. J Nanobiotechnology, 2013, 11:32.
[22] Yu X, Yi H, Guo C, et al. Pattern recognition scavenger receptor CD204 attenuates Toll-like receptor 4-induced NF-kappaB activation by directly inhibiting ubiquitination of tumor necrosis factor (TNF) receptor-associated factor 6. J Biol Chem, 2011, 286(21):18795- 18806.
[23] Menendez-Gonzalez, Padilla-Zambrano HS, Alvarez G, et al. Targeting beta-amyloid at the CSF: a new therapeutic strategy in Alzheimer's disease. Front Aging Neurosci, 2018, 10:100.
[24] Hickman SE, Allison EK, El Khoury J. Microglial dysfunction and defective beta-amyloid clearance pathways in aging Alzheimer's disease mice. J Neurosci, 2008, 28(33):8354-8360.
Effects of fucoidan on the internalization of Aβ42in glia cells
ZHANG He
Department of Pharmacy, Xuanwu Hospital of Capital Medical University, Beijing 100053, China, Email: zhanghe0718@sina.com
This research aims to demonstrate the internalization process of different Aβ42aggregation forms in glia cells upon the influence of fucoidan.
Aβ42uptake quantity in glia cells with or without fucoidan influence were measured. MAPK phosphorylation level was detected in fucoidan-activated microglia. The expression of scavenger receptor A and scavenger receptor B in two lines of glias were explored.
The intracellular monomer Aβ42(mAβ42) was significantly increased in fucoidan pre-treated and persistently-treated BV2 microglia. The mAβ42uptake in rat astrocytes and oligomer Aβ42uptake in BV2 microglia and rat astrocytes were reduced upon pre-treatment with fucoidan, while the above-mentioned effects were restored following persistent treatment of fucoidan. The expression of SRA and SRB scavenger receptor were observed in BV2 microglia, while only SRB expression was found in rat astrocytes, based on PCR analysis. p38-MAPK phosphorylation was increased and pinocytosis process of Aβ42wasenhanced in BV2 microglia following persistent treatment of fucoidan.
The interaction mode between fucoidan and heterogeneous glia receptors might exert influence on internalization process of different Aβ42aggregate forms in the glia cells. SRA may be involved in Aβ42phagocytosis promoted by p38-MAPK. These findings describe a common molecular cue important for Aβ phagocytosis in glia cells and provide insight into the glia-related immunotherapy in Aβ clearance.
Microglia; Astrocytes; Internalization; Fucoidan; Surface phagocytic receptor; Alzheimer disease
北京市衛(wèi)生和計劃生育委員會“老年重大疾病關(guān)鍵技術(shù)研究”(PXM 2018-026283-000002)
2018-07-11
10.3969/j.issn.1673-713X.2018.06.005

