和厚樸酚對小鼠膿毒癥心肌損傷的保護作用
翟蒙恩,張 彬,李凱峰,夏 麟,李俊峰,李步瀠,劉振華,梁宏亮,金振曉,段維勛,俞世強
(1.空軍軍醫大學 西京醫院心血管外科,陜西 西安 710032;2.空軍軍醫大學 天然藥物研究所,陜西 西安 710032)
膿毒癥是由感染引起的全身炎癥反應綜合征,持續發展,將導致多器官衰竭和死亡[1]。盡管近幾十年來在抗生素治療和及時生命支持方面取得了重大進展,但是膿毒癥仍然是重癥監護室主要死因[2]。巨噬細胞和嗜中性粒細胞過度產生炎癥分子所引發的高炎癥狀態是免疫反應的主要特征[3-4]。因此,大多數研究注重于改善膿毒癥高炎癥反應。然而,臨床試驗證實抗炎治療并不能減少膿毒癥總死亡率[5]。膿毒癥患者中超過40%的患者伴隨有心血管損害[6],且心血管功能障礙與患者預后不良密切相關。研究證實,且伴隨心臟功能障礙的患者死亡率高達40~70%[7]。因此,探索有效的治療手段改善膿毒癥引起心功能不全,對于改善膿毒癥愈后具有非常重大的臨床意義。
和厚樸酚(honokiol,HKL)是中藥厚樸的有效成分之一,屬于聯苯酚類化合物,具有抗氧化、抗炎、抗腫瘤和神經保護等多種生物學活性[8-10]。以往研究表明,HKL可通過減輕氧化應激損傷和炎癥反應來緩解膿毒癥肺損傷和腎損傷[11-12],但是HKL對于膿毒癥心肌損傷是否有保護作用及其具體機制尚無人報道。本研究旨在評價HKL處理對膿毒癥心肌損傷的保護作用以及對膿毒癥心肌氧化應激和凋亡的影響。
1 材料和方法
1.1 實驗材料
1.1.1 主要試劑 和厚樸酚、二甲基亞砜(DMSO)、蛋白酶抑制劑、磷酸酶抑制劑(Sigma公司,美國);抗Bax,Bcl-2,Caspase-3抗體(Cell signaling公司,美國);抗β-actin抗體(Santa-Cruz公司,美國);BCA蛋白定量試劑盒(Pierce公司,美國);TUNEL試劑盒(Roche公司,瑞士);羊抗兔、羊抗鼠二抗(北京中杉金橋公司,中國); 二氫乙錠(dihydroethidium, DHE)檢測試劑盒(Invitrogen公司,美國);丙二醛(malonaldehyde, MDA)含量、超氧化物歧化酶(SOD)活性、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活性檢測試劑盒(南京建成生物工程研究所,中國)。
1.1.2 實驗動物 8~10周齡雄性C57BL/6小鼠,體重20~22 g,購買自空軍軍醫大學實驗動物中心。
1.2 實驗方法
1.2.1 動物模型的建立 如前所述,通過盲腸結扎和穿刺(cecal ligation and puncture,CLP)誘導小鼠膿毒血癥[11]。具體操作流程如下:①手術前禁食24h以保證各小鼠腸內容物一致;②腹腔注射戊巴比妥鈉(50 mg/kg)麻醉小鼠;③剔除小鼠腹部毛發;④消毒鋪巾;⑤行剖腹術并暴露盲腸;⑥在回盲瓣下方結扎盲腸并用18號針刺穿兩次,擠出小鼠腸內容物;⑦將盲腸放回腹腔并關腹。假手術小鼠除了不進行盲腸結扎穿孔,其他手術操作完全相同。
1.2.2 實驗分組及給藥方式 將60只C57BL/6小鼠隨機分為4組,每組15只,即假手術組(Sham組);單純HKL處理組(HKL組);盲腸結扎穿孔組(CLP組);盲腸結扎穿孔+HKL處理組(CLP+HKL組)。CLP+HKL組小鼠盲腸結扎穿孔后腹腔注射溶解于DMSO中的和厚樸酚(5 mg/kg)。對照小鼠腹腔注射相似體積的溶劑。
1.2.3 心臟功能檢測 盲腸結扎穿孔24 h后,剔除小鼠胸前毛發。用VEVO 770(VisualSonics公司,加拿大)小動物超聲儀和30-MHz超聲探頭(型號:RMV707B)檢測左室射血分數(left ventricular ejection fraction,LVEF)與左室短軸縮短率(left ventricular fractional shortening,LVFS)等心功能指標[13]。
1.2.4 血清LDH水平檢測 盲腸結扎穿孔24 h后,解剖分離左側頸動脈,離斷動脈并取血,待血液自然凝固后,離心3 000 r/min,3 min。取血清,嚴格按照試劑盒說明書檢測血清中LDH水平。
1.2.5 心肌組織ROS含量檢測 盲腸結扎穿孔24 h后,用預冷的PBS洗滌心臟,在液氮中快速冷凍并切成5 μm厚度組織切片。然后,用DHE和DAPI染料對組織切片進行染色。用Olympus FV1000激光共聚焦顯微鏡(Olympus公司,日本)檢查組織切片。使用Image-Pro Plus軟件(NIH,美國)測定每組中的乙錠熒光。
1.2.6 心肌組織SOD活性、GSH-Px活性以及MDA含量檢測 盲腸結扎穿孔24 h后,迅速取下心臟,用生理鹽水(1∶9)制備蛋白勻漿。按照說明書分別檢測心肌組織中抗氧化酶SOD和GSH-Px活性以及脂質過氧化產物MDA含量。
1.2.7 心肌組織末端脫氧核苷酸轉移酶dUTP缺口末端標記(TUNEL)檢測 盲腸結扎穿孔24 h后,用PBS從冠狀動脈主動脈口處逆行灌注預冷的PBS,并取出心臟。將心臟用4%(體積分數)多聚甲醛固定48 h,石蠟包埋并縱切。使用TUNEL試劑盒照制造商的說明進行TUNEL分析以測量細胞凋亡的程度。在TUNEL反應后進行DAPI染色以顯示細胞核。TUNEL陽性的心肌細胞百分比由凋亡心肌細胞數目/心肌細胞總數×100%來表示。
1.2.8 心肌組織Bax,Bcl-2和Caspase-3蛋白表達測定 盲腸結扎穿孔24 h后,迅速取下心臟,提取蛋白樣品并進行蛋白電泳,具體操作流程如前所述[14]。在電泳加樣孔內蛋白樣品經電泳、轉膜、封閉等步驟后于4℃孵育抗Bax(1∶1 000),Bcl-2(1∶1 000),Caspase-3(1∶1 000)和β-actin(1∶1 000)一抗,過夜;繼而室溫孵育相應二抗(1∶5 000)1.5 h。使用BioRad成像系統檢測蛋白質條帶并使用Image Lab軟件定量。
1.3 統計分析

2 結 果
2.1 HKL處理改善膿毒癥小鼠心臟收縮功能障礙和心肌損傷
小鼠盲腸結扎穿孔24 h后用小動物超聲檢測小鼠心臟功能。與Sham組小鼠相比,CLP組小鼠心臟功能顯著受損,表現為LVEF與LVFS顯著降低(P< 0.05)。與CLP組相比,HKL處理(CLP+HKL組)能顯著提高LVEF與LVFS(P< 0.05)。與Sham組小鼠相比,單純給予HKL處理對于小鼠心臟功能無顯著影響(見圖1A-C,P> 0.05)。此外,檢測了各組小鼠血清中LDH水平。結果顯示,膿毒癥小鼠血清中LDH水平較Sham組小鼠顯著升高,而給予HKL處理。可以顯著降低血清中LDH水平(P< 0.05)。與Sham組小鼠相比,單純給予HKL處理對于小鼠血清中LDH水平無顯著影響(見圖1D,P> 0.05)。
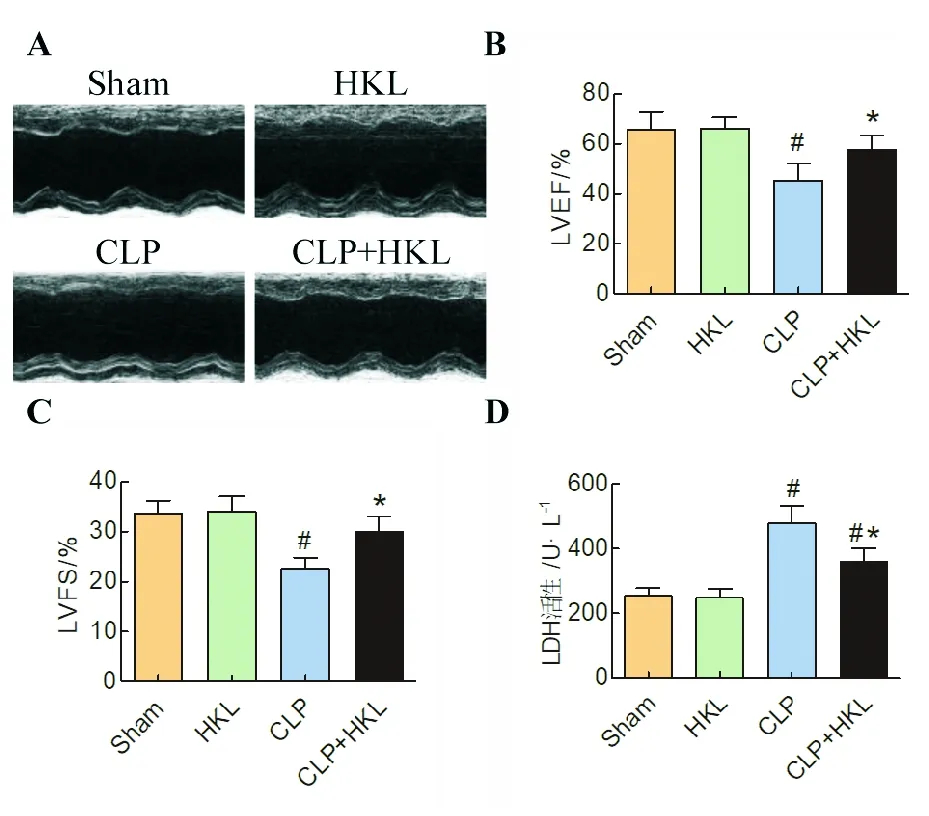
圖1 HKL處理對盲腸結扎穿孔后心臟功能和血清LDH水平的影響(#P < 0.05, 與Sham組相比;*P<0.05,與CLP組相比)Fig.1 The effects of honokiol treatment on cardiac contractile function and serum LDH level following cecal ligation and puncture
2.2 HKL處理減輕膿毒癥小鼠心肌組織氧化應激損傷
盲腸結扎穿孔24 h后,首先采用心肌組織冰凍切片DHE染色法檢測了心肌組織內ROS產量。結果顯示,與Sham組小鼠相比,CLP組小鼠心肌組織內ROS產量顯著上升,而HKL處理可以顯著降低膿毒癥小鼠心肌組織ROS產量(P< 0.05)。與Sham組小鼠相比,單純給予HKL處理對于小鼠心肌組織ROS產量無顯著影響(見圖2A,P> 0.05)。以往研究發現,過量ROS可以進一步誘發脂質發生過氧化反應,進而損害心肌細胞[14]。本實驗通過檢測脂質過氧化產物MDA發現,與Sham組小鼠相比,CLP組小鼠心肌組織內MDA含量顯著上升,而HKL處理可以顯著降低膿毒癥小鼠心肌組織MDA含量(P< 0.05)。與Sham組小鼠相比,單純給予HKL處理對于小鼠心肌組織MDA含量無顯著影響(見圖2B,P> 0.05)。SOD是機體抗氧化應激的關鍵分子之一[15],可以將體內過量的過氧化物還原為過氧化氫[16]。與Sham組小鼠相比,CLP組小鼠心肌組織內SOD的活性顯著下降,而HKL處理可以顯著提高膿毒癥小鼠心肌組織SOD活性(P< 0.05)。與Sham組小鼠相比,單純給予HKL處理可以輕度增加小鼠心肌組織SOD活性(見圖2C,P< 0.05)。此外,GSH-Px也是機體抗氧化應激主要酶之一,可將過氧化氫還原為水以及將脂質氫過氧化物還原為相應醇類[17]。與Sham組小鼠相比,CLP組小鼠心肌組織內GSH-Px活性顯著下降,而HKL處理可以顯著提高膿毒癥小鼠心肌組織GSH-Px活性(P< 0.05)。與Sham組小鼠相比,單純給予HKL處理可提高小鼠心肌組織GSH-Px活性,但無統計學意義(見圖2D,P> 0.05)。

圖2 HKL處理對盲腸結扎穿孔后心肌氧化應激水平的影響(#P < 0.05, 與Sham組相比;*P<0.05,與CLP組相比)Fig.2 The effects of honokiol treatment on myocardial oxidative stress following cecal ligation and puncture
2.3 HKL處理抑制膿毒癥小鼠心肌組織凋亡
盲腸結扎穿孔24 h后通過TUNEL染色檢測心肌組織凋亡率。結果顯示,與Sham組小鼠相比,CLP組小鼠心肌組織凋亡率顯著上升,而HKL處理可以顯著降低膿毒癥小鼠心肌組織凋亡率(P< 0.05)。與Sham組小鼠相比,單純給予HKL處理對于小鼠心肌組織凋亡率無顯著影響(見圖3A~B,P> 0.05)。此外,檢測了凋亡相關蛋白的表達情況。結果顯示,與Sham組小鼠相比,CLP組小鼠心肌組織中Bax與Caspase-3的表達量顯著增高,而Bcl-2的表達量顯著下降(P< 0.05)。與CLP組相比,HKL處理可以顯著提高心肌組織Bcl-2的表達,降低Bax與Caspase-3的表達(P< 0.05)。與Sham組小鼠相比,單純給予HKL處理對于小鼠心肌組織中Bax,Bcl-2,Caspase-3的表達量無顯著影響(P> 0.05,見圖3C-E)。
3 討 論
膿毒癥是重癥監護病房的主要死因。臨床觀察發現,膿毒癥具有雙相死亡分布特征[18-19]。心臟功能障礙是膿毒癥引起的多器官功能衰竭的重要表現,是導致膿毒癥患者死亡的重要因素。因此,尋找有效治療藥物緩解膿毒癥心臟損害對于改善膿毒癥患者愈后具有重要臨床意義。
以往研究表明,和厚樸酚對于緩解膿毒癥引起的多種器官損害發揮了積極作用。Li等發現和厚樸酚可以顯著改善膿毒癥大鼠的生存情況、減輕CLP后大鼠腎組織病理學改變、氧化應激、炎性因子的產生以及抑制NF-κB信號傳導通路的激活,從而減輕膿毒癥引起的急性腎損傷[12]。Weng 等發現和厚樸酚可以顯著降低膿毒癥小鼠血清TNF-α、一氧化氮和高遷移率族蛋白1(HMGB1)的產量、降低膿毒癥小鼠血脂過氧化和硝基酪氨酸、緩解膿毒癥小鼠肺水腫、肺部病理變化并改善膿毒癥小鼠生存情況[11]。然而和厚樸酚能否緩解膿毒癥引起的心肌損傷尚未見報道。值得注意的是,近年來研究證實,和厚樸酚具有顯著的心肌保護作用。本課題組前期研究發現,和厚樸酚可通過激活SIRT1-Nrf2信號通路改善心肌氧化損傷損傷和凋亡,從而緩解I型糖尿病小鼠心肌缺血再灌注損傷[20]。此外,多項研究表明,和厚樸酚還能夠減輕多柔比星引起的心肌損傷[21]以及壓力負荷引起的心肌肥厚[9]。本研究就和厚樸酚與膿毒癥引起的心臟功能障礙進行研究,首次證實和厚樸酚能夠有效緩解膿毒癥引起的心臟收縮功能障礙和心肌損傷。
目前研究表明,能量代謝受損、能量產生改變以及ROS產生增加引起的氧化應激等線粒體功能障礙參與了膿毒癥心肌損傷的發生發展,其中,氧化應激被認為最主要的啟動因素之一[22]。因此,應用抗氧化劑理論上可有效減輕炎癥并提高膿毒癥患者的存活率。然而,有關抗氧化劑治療膿毒癥的多項臨床試驗卻取得了不一致的結果。其主要原因在于常規抗氧化劑作用范圍過于廣泛、劑量不足和效力過低等。由于線粒體是產生ROS的主要細胞器,特異性地降低線粒體中ROS產量并提高抗氧化酶活性可有效減輕膿毒癥心肌組織氧化應激損傷。最近,Pillai等證實和厚樸酚可以直接結合線粒體內主要去乙酰化酶SIRT3,減輕線粒體氧化應激水平,進而減輕壓力負荷引起的心肌肥厚[9],提示和厚樸酚是一種線粒體抗氧化劑。本研究發現,盲腸結扎穿孔24 h后,小鼠心肌組織內ROS的產量顯著增加,伴隨脂質過氧化產物MDA含量增多。此外,膿毒癥小鼠心肌自身抗氧化酶SOD和GSH-Px的活性也顯著受損。腹腔注射和厚樸酚可以顯著減少膿毒癥小鼠心肌ROS產量,降低MDA含量并且提高抗氧化酶活性。

圖3 HKL處理對盲腸結扎穿孔后心肌凋亡的影響(400×)(#P < 0.05, 與Sham組相比;*P<0.05,與CLP組相比)Fig. 3 The effects of honokiol treatment on myocardial apoptosis following cecal ligation and puncture (400×)
心肌細胞凋亡是人體和動物膿毒癥心肌損傷的顯著特征之一。研究發現,過量ROS的產生能夠導致蛋白、DNA以及脂類發生過氧化反應,破壞細胞膜完整性,進而引起細胞凋亡[14]。充分證據顯示,緩解膿毒癥心肌損傷的治療藥物多與抑制心肌細胞凋亡有關。Peng等發現,激活PPAR-γ主要通過抑制心肌細胞凋亡和程序性壞死,抵抗膿毒癥引起的心肌損傷[23]。An等發現,褪黑素主要聽過激活PI3K/Akt信號通路,抑制心肌細胞凋亡,減輕膿毒癥心功能不全[24]。本研究發現,盲腸結扎穿孔24 h后,小鼠心肌組織凋亡率和促凋亡蛋白的表達量顯著增加,而抗凋亡蛋白表達量顯著降低。而腹腔注射和厚樸酚可以顯著降低凋亡率和促凋亡蛋白表達,并上調抗凋亡蛋白表達。
綜上所述,本研究首次證實和厚樸酚處理能夠顯著改善膿毒癥心肌損傷,其主要機制在于抑制線粒體氧化應激及其誘導的心肌凋亡。本研究為臨床上應用和厚樸酚治療膿毒癥心肌損害提供了新的理論依據。

