明膠海綿顆粒混合糊劑栓塞治療經皮冠狀動脈介入治療術中冠狀動脈穿孔的安全性和療效分析
田原,袁瑩,路航,邱洪,李向東,楊躍進
作者單位:100037 北京市,中國醫學科學院 北京協和醫學院 國家心血管病中心 阜外醫院 冠心病中心(田原、袁瑩、邱洪、李向東、楊躍進);烏魯木齊市友誼醫院 心血管內科(路航)
隨著冠狀動脈介入技術的不斷進步和器械的不斷革新,冠狀動脈穿孔(CAP)已成為經皮冠狀動脈介入治療(PCI)中較為罕見的并發癥[1-3]。CAP的發生率約為0.10%~3.00%,臨床上其預后從自發性閉合至心包填塞、死亡均可能發生[3-6]。根據血管損傷程度的不同,出現CAP的患者死亡率可高達21.2%[5]。CAP的高危因素包括女性、高血壓、高齡、既往冠狀動脈旁路移植術史和復雜冠狀動脈病變(如慢性完全閉塞病變、分叉病變、嚴重迂曲、成角或鈣化病變等)[5,7-9]。引起CAP的原因有導絲穿孔(常見于采用超硬、親水、超滑導絲通過病變時誤入假腔,或穿入小血管分支內等)、斑塊旋切術、球囊或支架型號過大、支架數目過多等[5,8,10]。目前針對CAP普遍使用的處理方法包括:延長球囊擴張、逆轉抗凝、覆膜支架置入、栓塞(如促凝物質栓塞、自體組織栓塞)、心包穿刺引流和急診外科手術等[5,11-16]。
明膠海綿作為促凝物質,常被用于CAP的緊急處理[17],但也存在一定的缺陷:傳統的明膠海綿混懸液通常為單一直徑明膠海綿顆粒與1:1的生理鹽水和對比劑混合配制而成,按此方法配制的混懸液流動性強,在治療過程中易發生血管堵塞,或其分支被混懸液填充而發生無復流或慢血流。而在臨床實踐中我們發現,大、小不同顆粒的明膠海綿混合糊劑與生理鹽水和對比劑混合,注入冠狀動脈后可緊密貼合在冠狀動脈破口處,不易堵塞微血管,較少引起大面積心肌缺血,可減少相關冠狀動脈分支的栓塞和心包積液的發生,可能具有一定的優勢。然而,我們進行系統檢索后發現,相關的文獻十分缺乏。為此,我們進行該研究,旨在比較大、小兩種明膠海綿顆粒的混合糊劑與單一大、小顆粒明膠海綿混懸液栓塞治療CAP的安全性和療效的差別,探討處理CAP更為安全、有效的方法。
1 資料與方法
研究對象:中國醫學科學院阜外醫院2015-01至2016-12期間冠心病中心所有行PCI的患者。納入標準:行PCI時發生Ⅱ型和Ⅲ型CAP且使用明膠海綿栓塞治療的患者。排除標準:Ⅰ型CAP或未采用明膠海綿處理的CAP患者。根據患者使用的明膠海綿顆粒大小將所有患者分為三組:大顆粒組、小顆粒組、混合顆粒組。
資料收集:收集三組患者的基線臨床資料,包括年齡、性別及冠心病危險因素、既往心臟病史以及冠狀動脈病變等;記錄三組中栓塞成功、無復流或慢血流的患者比例;在PCI術前及術后次日清晨檢測三組患者的血小板(PLT)計數、血紅蛋白(Hb)、肌酸激酶(CK)、肌酸激酶同工酶(CKMB)等相關生化指標水平。
介入治療:所有患者術前均采用雙聯抗血小板(阿司匹林聯合氯吡格雷或替格瑞洛)治療至少5天,否則在術前給予負荷劑量。患者均未使用低分子肝素或血小板膜糖蛋白Ⅱb/Ⅲa受體拮抗劑。若無禁忌證,所有患者均常規口服硝酸酯類藥物、他汀類藥物、β受體阻滯劑、血管緊張素轉換酶抑制劑或血管緊張素Ⅱ受體拮抗劑等藥物。在行PCI的過程中,常規采用右橈動脈穿刺路徑。術中肝素采用動脈內給藥,總量為1 mg/kg,其中25 mg在冠狀動脈造影前給予,其余劑量在介入治療前補足。介入手術均應用等滲或低滲對比劑。術畢所有患者均在導管室內即刻拔除右橈動脈6F動脈鞘管,加壓包扎后返回病房。CAP患者術后即刻、次日及出院前常規復查超聲心動圖,以明確有無心包積液及其變化情況。
CAP栓塞方法:患者使用的明膠海綿來自于杭州艾力康醫藥科技公司。小顆粒組將150~350 μm明膠海綿顆粒1支(100 mg)加入到5 ml對比劑和5 ml生理鹽水配制的稀釋液中,攪拌均勻制成糊劑;大顆粒組將350~560 μm的明膠海綿顆粒1支(100 mg)加入到5 ml對比劑和5 ml生理鹽水配制的稀釋液中,攪拌均勻制成糊劑;混合顆粒組將150~350 μm和350~560 μm 的明膠海綿顆粒各 1支(100 mg)同時加入到5 ml對比劑中,攪拌均勻制成混合糊劑。術中發現CAP后,先將低壓(6~8 atm)擴張的球囊嵌頓在破口的近端,經導絲將微導管送入封堵球囊遠端的CAP處,注入配制好的明膠海綿糊劑或混懸液1~2 ml,1~2 min后將球囊去充盈,造影檢查封堵效果。
指標及定義:根據Ellis分型方法[1]將CAP分為三型:Ⅰ型,對比劑呈“龕影”突出于血管腔外,但無滲漏;Ⅱ型,對比劑漏至心包或心肌,但無噴射狀漏出;Ⅲ型,對比劑通過直徑>1 mm的破口且呈噴射狀外滲。Ⅲ型可進一步分為兩種亞型:Ⅲa型,孔道向心包破潰,容易導致心臟壓塞;Ⅲb型,孔道向心腔或冠狀靜脈破潰,不易導致心臟壓塞。本研究主要觀察指標為栓塞治療是否成功以及無復流和慢血流的發生情況等。進行栓塞治療后若冠狀動脈造影示CAP被封堵住,無對比劑外滲,且心包積液無進行性增多,則認為栓塞治療成功。若栓塞后造影示冠狀動脈病變無夾層、血栓、痙攣和明顯的殘余狹窄,但冠狀動脈遠端無充盈或充盈不完全[心肌梗死溶栓治療臨床試驗(TIMI)0~1級]認為出現無復流,若冠狀動脈完全充盈但血流速度減慢(TIMI 2級)則認為出現慢血流[18]。
統計學方法:所有數據分析均使用SPSS 22.0版軟件操作完成。分類變量以頻數來描述,采用卡方檢驗或Fisher精確檢驗進行兩組間的比較;連續變量以均數±標準差或中位數(P25,P75)描述,組間比較采用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 三組患者的基線臨床資料比較(表1)
59 957例行PCI治療的患者中,共45例(0.08%)出現Ⅱ型或Ⅲ型CAP且使用明膠海綿處理。患者平均年齡(60.2±10.6)歲,男性39例(86.7%)。大顆粒組11例(24.4%),小顆粒組22例(48.9%),混合顆粒組12例(26.7%)。三組患者在年齡、性別及冠心病危險因素、既往心臟病史以及冠狀動脈病變等方面的差異均無統計學意義(P均>0.05)。45例CAP患者中,Ⅱ型和Ⅲ型CAP患者分別有37例(82.2%)和8例(17.8%),Ⅲa型和Ⅲb型CAP患者各4例(8.9%)。三組間Ⅱ型、Ⅲa型及Ⅲb型CAP患者比例差異均無統計學意義(P均>0.05)。

表1 三組患者的基線臨床資料比較[例(%)]
2.2 三組患者的介入及栓塞治療結果(表2)
45例CAP患者中,41例(91.1%)經明膠海綿顆粒栓塞成功。8例(19.5%)Ⅲ型CAP封堵的總成功率為50%。4例(8.9%)栓塞失敗的患者均為Ⅲa型CAP,且破口相對其他病例更大;其中1例位于左前降支中遠段,2例位于右冠狀動脈中段,另外1例位于第一對角支近段。4例(8.9%)Ⅲb型CAP破口相對較小,均封堵成功。
大顆粒組11例患者中,8例(72.7%)栓塞成功。1例(9.1%)Ⅲa型CAP患者出現大量心包積液,血液動力學不穩定,給予心包穿刺引流和主動脈內球囊反搏治療;同時栓塞CAP,失敗后緊急行覆膜支架置入,后病情逐漸穩定。另外2例(18.2%)Ⅲa型CAP栓塞失敗的患者置入覆膜支架后CAP愈合。3例(27.3%)患者術中出現胸痛,胸前導聯ST段壓低,術后均完全緩解。分別有2例(18.2%)和3例(27.3%)患者于術中出現栓塞血管主支無復流和慢血流現象(總發生率45.5%),給予硝酸甘油冠狀動脈內反復注射后,血流恢復正常。
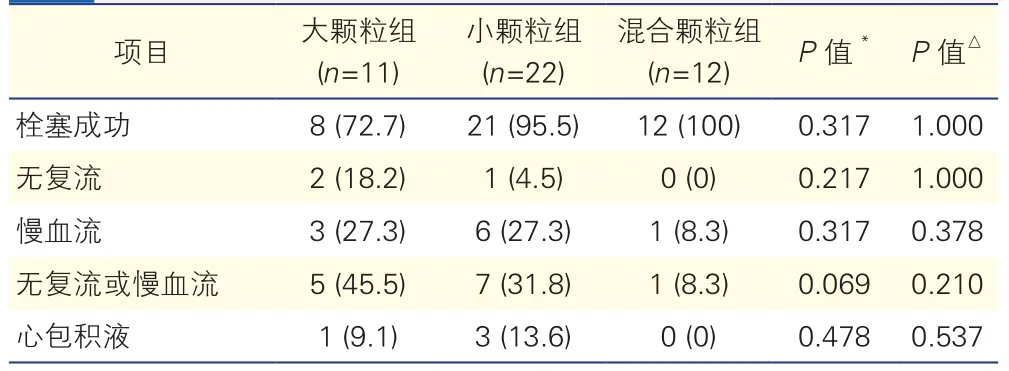
表2 三組患者的介入及栓塞治療結果[例(%)]
小顆粒組22例患者中,21例(95.5%)栓塞成功。1例(4.5%)Ⅲa型CAP患者栓塞失敗,行覆膜支架置入后CAP愈合。分別有1例(4.5%)和6例(27.3%)患者出現栓塞血管主支無復流和慢血流現象(總發生率31.8%),1例經導管抽吸血栓,5例均給予冠狀動脈內反復注射硝酸甘油后血流恢復。3例(13.6%)出現中大量心包積液,給予心包穿刺引流后穩定;7例(31.8%)出現胸痛,胸前導聯ST段明顯壓低,術后完全恢復。
混合顆粒組12例患者中,12例(100%)均栓塞成功。1例(8.3%)患者出現主支血管及分支血管慢血流,冠狀動脈內注入硝酸甘油后恢復。1例(8.3%)出現胸痛,胸前導聯ST段輕度壓低,術后完全恢復。混合顆粒組較大顆粒組和小顆粒組成功率更高,無復流和慢血流的發生率更低,但差異均無統計學意義(P均 >0.05)。
所有患者術中均未使用魚精蛋白,術后未停用阿司匹林和氯吡格雷。出院后隨訪3個月期間,上述患者均未發生嚴重不良事件。
2.3 三組患者介入手術前后主要生化指標變化(表3)
與術前相比,術后次日大顆粒組Hb水平下降,小顆粒組Hb水平和PLT計數均下降,而CKMB水平升高,上述差異均有統計學意義(P均<0.05);三組其余指標手術前后的差異均無統計學意義(P均>0.05)。混合顆粒組與大顆粒組或小顆粒組相比,CK、CKMB、Hb水平和PLT計數手術前后差值的差異均無統計學意義(P均>0.05)。
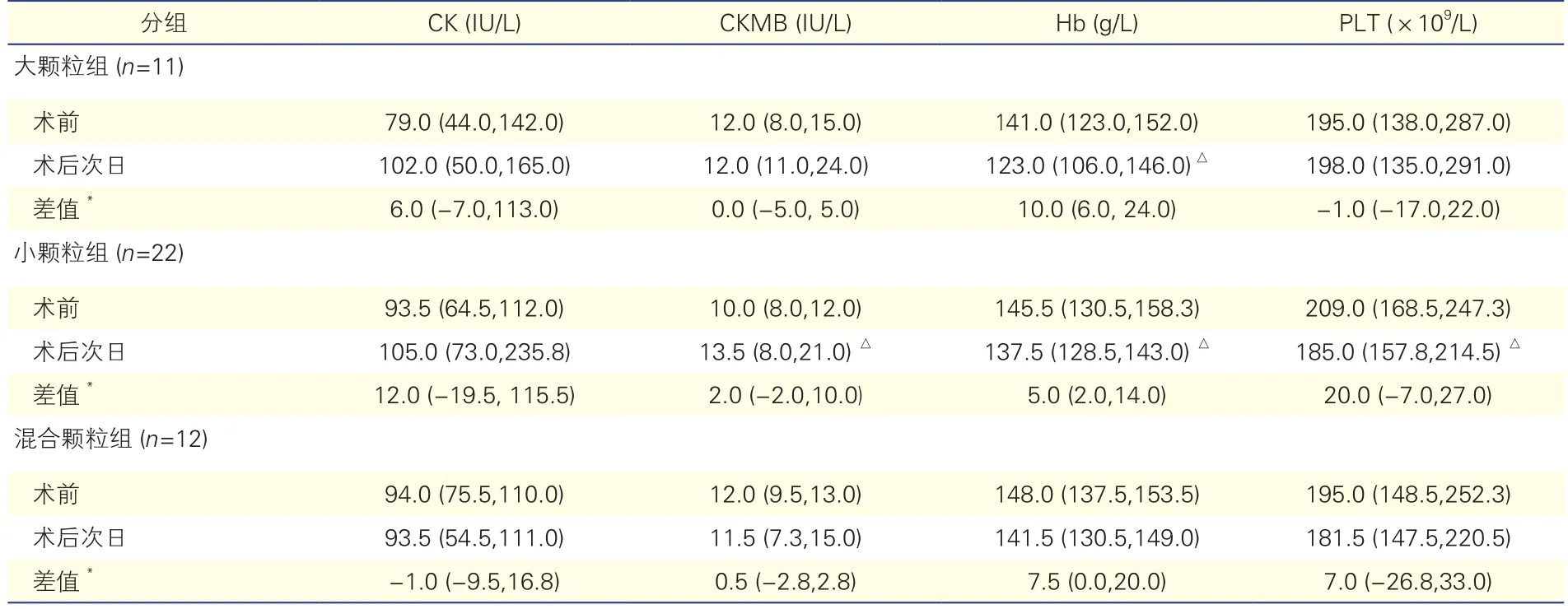
表3 三組患者介入手術前后主要生化指標變化情況[中位數(P25,P75) ]
3 討論
CAP是PCI治療的嚴重并發癥,可導致急性心包填塞、急性心肌梗死等嚴重不良事件,若發現不及時或處理不恰當可導致患者死亡。CAP的處理取決于穿孔大小、出血量、出血速度以及患者的血液動力學狀況。一旦懷疑或明確CAP,應嚴密觀察,迅速做出判斷并立即進行相應處理。Ⅱ型、Ⅲ型CAP如不及時處理,會引起急性心包填塞,導致患者死亡。報道顯示,Ⅲ型CAP患者的死亡率為7%~44%,高達40%的病例可出現心包填塞,20%~40%的患者需緊急行冠狀動脈旁路移植術[7,19,20]。明膠海綿顆粒在介入治療中已經運用多年,不僅在冠心病、肥厚型心肌病介入治療領域常用,在外周血管、腫瘤的介入治療中也都起著重要的作用。
在本研究中,明膠海綿顆粒栓塞治療CAP的總成功率為91.1%,Ⅱ型CAP栓塞治療成功率100%。Ⅲ型CAP的成功率為50%,其中Ⅲa型CAP均封堵失敗。Ⅲb型CAP破口面向心肌或者靜脈,明膠海綿相對不易移位,因而更易封堵;而Ⅲa型CAP破口朝向心包,血流壓差更大,同時穿孔后動脈破口通常更大,因此封堵難度增加,同時存在心包填塞的風險,搶救時間較短,會限制栓塞嘗試的頻次。本研究中混合組無Ⅲa病例,因此不能很好地評估混合顆粒對Ⅲa型CAP的療效。
單一大顆粒明膠海綿混懸液、單一小顆粒明膠海綿混懸液和大、小兩種顆粒明膠海綿混合糊劑栓塞治療的成功率分別為72.7%、95.5%和100%,栓塞術后無復流的發生率分別為18.2%、4.5%和0%,慢血流的發生率分別為27.3%、27.3%和8.3%,慢血流和無復流總發生率分別為45.5%、31.8%和8.3%,中大量心包積液的發生率分別為9.1%、13.6%和0%。明膠海綿混合糊劑較單純大顆粒或小顆粒明膠海綿混懸液的安全性和療效似乎更好,尤其是在術中無復流和慢血流的發生率方面,但差異均無統計學意義,考慮主要是樣本量較小的緣故。隨著技術和器械的發展,PCI術中已少見CAP發生。本中心為全國乃至全世界PCI數量最多的中心,2年僅收集45例CAP明膠海綿栓塞病例。因此后續可考慮進行多中心研究,進一步增加樣本量,以期能得到更為明確的結論。
用大、小顆粒明膠海綿混合糊劑封閉CAP的方法有以下優點:(1)經導絲引導,輸注栓塞劑的微導管可以超選擇到達穿孔分支近段,精準定位封堵冠狀動脈破口,適用于Ⅱ型CAP以及小血管、中遠段血管穿孔的治療;(2)與單純大、小顆粒相比,混合糊劑因兩種直徑顆粒能產生互補作用,使其內部結構更加緊密,流動性大大下降,粘附性增加,可緊密貼合在冠狀動脈破口上,減少穿孔出血時間,這也可能是混合顆粒組術后Hb水平未明顯下降的原因(大顆粒和小顆粒組術后Hb水平較術前均顯著下降);同時不易移位至遠端,也較少反流至主干,從而降低相關冠狀動脈分支及主干栓塞風險;(3)與覆膜支架及彈簧圈相比,不易丟失小分支;(4)可不使用魚精蛋白中和肝素,降低了術中發生血栓的風險;(5)栓塞成功后可不停用抗血小板藥物,可減少術后支架內血栓形成的風險;(6)明膠海綿顆粒本身無任何藥理作用,無排異性,與局部凝血酶注射比較更有優勢,避免了局部凝血酶注射操作不當造成血管穿孔處近段血栓形成的風險;(7)明膠海綿顆粒是一種無菌、細胞毒性輕微(Ⅰ級)、無致敏反應、無皮內刺激反應、無亞慢性毒性、無遺傳毒性的中期栓塞物質,完全降解時間為14~90 d,可于90 d內在人體內降解吸收;(8)使用明膠海綿顆粒成功封閉CAP破口,方法簡便易行,避免了外科開胸止血,減少了手術并發癥,減輕了患者的經濟負擔。
當然,明膠海綿顆粒治療CAP也存在一定的缺點。對于冠狀動脈主干及大分支近端部位的穿孔,或穿孔破口較大的患者,明膠海綿栓塞可能并不能有效封堵破口,且一旦造成主要分支受累,將導致嚴重并發癥。如本研究中4例Ⅲa型穿孔的患者,因破口較大,使用明膠海綿封堵均未成功;但由于術者快速識別并緊急進行補救性治療,最終均未引起嚴重的不良事件。因此,對于Ⅲa型CAP,因存在封堵失敗的可能,如破口較小,患者病情平穩,可考慮先嘗試使用明膠海綿封堵(更推薦混合糊劑);而破口較大的患者,應直接進行覆膜支架置入,或采用其他補救性措施,否則可能使病情加重,錯過最佳治療時機。
本研究存在一定的局限性:首先,采取回顧性研究的方式,可能在數據采集等方面存在一定的偏倚;其次,本研究均入組使用明膠海綿栓塞的CAP病例,因此不能很好地與處理CAP的其他方式進行比較;另外,本研究著重分析了不同明膠海綿顆粒制劑栓塞治療CAP的臨床情況,但對于具體機制沒有做進一步的研究分析;最后,本研究樣本量不夠大,雖然混合顆粒組較大顆粒組、小顆粒組冠狀動脈無復流和慢血流的發生率顯著下降,但差異卻無統計學意義,從而不能得出確切的結論。
我們的研究表明,對于PCI術中出現的CAP,使用大、小兩種顆粒明膠海綿混合糊劑進行栓塞治療安全、有效,與單純大顆粒或小顆粒明膠海綿混懸液栓塞相比,可能有助于降低術中無復流和慢血流的發生,但需要進一步開展大樣本量臨床研究來驗證。

