雙腔起搏器植入術后心房顫動發生率及相關因素分析
劉倩,劉亞寧,趙彥蕾,謝瑞芹
作者單位:050000 河北省石家莊市,河北醫科大學第二醫院 心內科
雙腔起搏器能夠發揮心房、心室輔助泵功能,維持房室傳導的同步性,一直被稱為生理性起搏模式,其植入的主要適應證為病態竇房結綜合征(病竇)和房室阻滯[1]。然而,長期起搏治療改變了正常心臟激動順序,使雙心房、雙心室、房室間收縮不同步,引起心房壓力增高,心房顫動(房顫)時有發生。隨著起搏器診斷技術不斷發展,有研究報道,起搏器植入術后房顫年發生率高達20%~50%[2]。房顫是缺血性腦卒中與系統性栓塞的重要危險因素,使腦卒中的風險增加4~5倍[3],房顫患者發生腦卒中預后較差,死亡率和永久性致殘率更高[4,5]。近年來,國內外研究分析了臨床資料、心臟結構以及心房起搏比例(AP%)、心室起博比例(VP%)對于起搏器植入術后新發房顫的影響,然而結論尚不明確。本研究將在此基礎上進一步分析起搏器四種基本工作模式與起搏器術后新檢出房顫的關系,為尋找降低雙腔起搏器術后房顫發生率方法提供依據。
1 資料與方法
1.1 研究對象
回顧性分析2014-03至2017-10期間于河北醫大二院心內一科植入雙腔起搏器的患者。納入標準:(1)年齡≥18周歲;(2)符合病竇或房室阻滯診斷標準;(3)入院后經心電圖或24 h動態心電圖證實有雙腔起搏器植入的Ⅰ類和Ⅱa類適應證。排除標準:(1)曾更換起搏器的患者;(2)既往房顫病史患者或入院后經心電圖、24 h動態心電圖發現房顫患者;(3)既往有風濕性心臟病、先天性心臟病、肥厚型心肌病、擴張型心肌病病史或者既往有心臟外科手術史患者;(4)合并有甲狀腺功能亢進癥、急性心肌梗死、血液系統疾病及多器官功能不全者。共獲得樣本85例(樣本中可能包含部分無癥狀但漏診的房顫患者)。
1.2 雙腔起搏器植入
所有入選患者均經右鎖骨下靜脈穿刺植入雙腔起搏器(設定模式均為DDD/DDDR)。右心室電極放置在右心室流出道低位間隔或中位間隔,右心房電極均放置在右心耳。術后常規啟用雙腔起搏器房性心動過速檢測功能和模式轉換功能,記錄并存儲心房高頻事件發作時的心電圖。將起搏器記錄到的心房高頻事件發作頻率≥190次/min,持續時間≥6 min定義為房顫負荷[6]。考慮到術后心肌損傷可能影響房性心律失常結果,故從雙腔起搏器植入6周后統計資料。
1.3 超聲心動圖檢查
所有患者術前采用iE33彩色超聲診斷儀(荷蘭飛利浦公司)進行超聲心動圖檢查,常規記錄心臟各腔室大小,包括左心房、左心室及左心室射血分數(LVEF)。
1.4 起搏器程控及隨訪
所有患者均于術后3、6、12個月,此后每年1次定期于我科程控起搏器,如有不適立即隨訪,在每次程控時對設備參數進行常規設置。分別采用St Jude Medical公司3650程控儀或 Medtronic公司2090程控儀進行起搏器程控,隨訪內容包括心房高頻事件的發作頻率及持續時間,到達房顫負荷患者調取腔內心電圖,排除假陽性可能;記錄AP%、VP%、起搏器基礎頻率以及心房感知-心室感知(AS-VS)模式、心房感知-心室起搏(AS-VP)模式、心房起搏-心室感知(AP-VS)模式、心房起搏-心室起搏(AP-VP)模式所占百分比,若隨訪過程中起搏器參數發生改變,以最后一次程控參數為準。收集的臨床資料包括年齡、性別、起搏器植入指征、既往病史(包括高血壓、糖尿病、高脂血癥、冠心病、心力衰竭、腦梗死)、用藥史[包括血管緊張素轉化酶抑制劑/血管緊張素Ⅱ受體拮抗劑(ACEI/ARB)、β受體阻滯劑、鈣拮抗劑、他汀類藥物]等。
1.5 統計學方法
數據分析采用SPSS 22.0軟件。近似服從正態分布的定量資料以均數±標準差表示,呈偏態分布的定量資料用中位數(P25,P75)表示,均數間比較采用t檢驗,定性資料采用檢驗。根據AIC準則篩選出擬合Logistic回歸的最優變量(AIC=65.31),并進行Logistic回歸分析檢驗房顫的獨立危險因素,P值<0.05認為差異有統計學意義。
2 結果

表1 患者基本資料與新檢出心房顫動的單因素分析[例(%)]
2.1 研究人群的基本特征(表1)
納入85例患者,平均年齡(63.53±12.16)歲,女性53例(62.4%),男性32例(37.6%),平均隨訪時間為(386.73±285.73)d,19例患者新檢出房顫,房顫發生率為22.35%。房顫患者中男性比例高于無房顫患者(P=0.039),且服用鈣拮抗劑的患者比例低于無房顫患者(P=0.03),左心房內徑和左心室內徑均高于無房顫患者(P均<0.05)。而且房顫患者的AP-VP模式比例高于無房顫患者(P=0.027)。
為進一步探究左心房內徑與房顫的關系,繪制出曲線圖后發現二者呈線性相關,左心房內徑每增加1 mm,房顫發生的風險增加1.38%(圖1)。將AP-VP模式比例與房顫發生率繪制成曲線圖,發現AP-VP模式比例與房顫發生率呈曲線相關(圖2)。
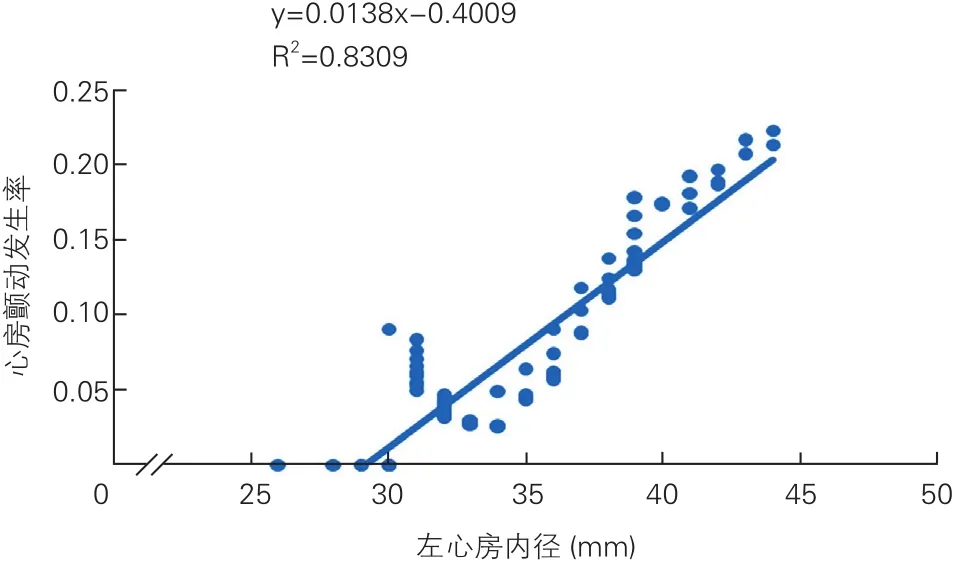
圖1 左心房內徑與心房顫動的關系
2.2 多因素Logistic回歸分析(表2)
應用Logistic回歸模型對性別、年齡、AS-VS模式、AP-VP模式、他汀類藥物、鈣拮抗劑、左心房內徑、冠心病進行多因素相關性分析(根據AIC準則篩選出自變量,AIC=65.31),結果顯示 AP-VP 模 式(OR=1.042,95%CI:1.006~1.078,P=0.021)、 左 心 房 內 徑(OR=1.359,95%CI:1.124~1.644,P=0.002) 以 及 服 用 鈣 拮 抗 劑(OR=0.073,95%CI:0.012~0.458,P=0.005)是術后房顫發生的獨立影響因素。

圖2 AP-VP模式與心房顫動的關系
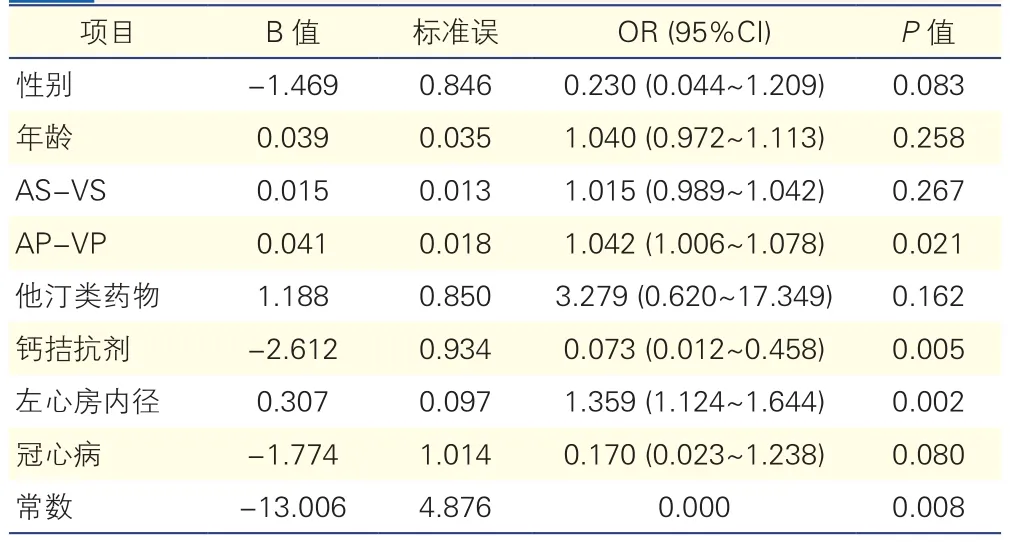
表2 心房顫動發生的多因素Logistic回歸分析
3 討論
起搏器植入術逐漸成為糾正緩慢性心律失常、預防惡性快速性心律失常的重要治療技術,數十年來,許多研究分析了起搏器AP%、VP%對于新發房顫的影響,然而至今尚無明確定論,本研究將在此基礎上進一步探討AS-VS、AS-VP、AP-VS、AP-VP模式是否與房顫發生有關并預測術后房顫發生率。
本研究經過(386.73±285.73)d隨訪發現雙腔起搏器植入術后新檢出房顫率為22.35%,與Cheung等[7]和Mittal等[8]的研究結果相似。起搏器植入術后男性房顫的發生率是女性的2.28倍,與以往的研究結論相似[9,10],但是導致男性高房顫發生率的因素尚不明確,既往有研究表明雌激素是延緩冠心病、高血壓、心力衰竭發展的保護性因素[11-13],本研究中未絕經女性8例,同年齡段男性3例,樣本量小,無法比較雌激素是否與術后房顫相關。
本研究發現左心房增大是術后新檢出房顫的獨立危險因素,這已經是國內外公認結論[14-16],考慮其原因為:各種原因導致左心房容量和壓力升高,使心房擴大發生電重構和結構重構,左心房內傳導時間延長、收縮延遲,增加房顫發生的風險。房顫發生后改變心房原有的電學及組織學特征,維持房顫持續發生或終止后復發,加重左心房增大。左心房增大與房顫發生互為因果,惡性循環。本研究還發現左心房內徑與術后新檢出房顫率呈線性相關,左心房內徑每增加1 mm,房顫發生的風險增加1.38%。
本研究結果顯示新檢出房顫患者中服用鈣拮抗劑的患者比例低于無房顫患者。本研究中患者服用的鈣拮抗劑為二氫吡啶類,對心臟的作用較小,因此考慮其預防房顫的原因可能是通過降低外周血壓進而減輕左心房壓力間接起效的。有研究顯示,服用氨氯地平可以通過降低血壓有效減少陣發性房顫的房顫負荷[17,18]。
本研究結果發現,AP-VP模式是術后新檢出房顫的獨立危險因素。心房起搏時心房去極化使心房傳導時間延長、收縮延遲,左心房充盈量減少、壓力升高進而增加房顫發生風險[19,20];此外,右心耳起搏使雙房間傳導延遲,為快速性折返性心律失常提供條件。右心室起搏引起心室異常電-機械活動,將心室分為早期激活和晚期激活區[21],導致心室非同步收縮,二尖瓣反流增多、心房壓力增大,增加房顫發生的風險[22]。AP-VP模式工作時,心房、心室順序起搏,血流動力學同時發生非生理性改變,使上述心房、心室導致房顫風險增加的負面因素相互疊加,房顫發生風險進一步增加。我們假設由于AP-VP模式比例增加,心房、心室非生理性收縮,導致左心房擴大,進而增加了房顫發生的風險。然而本研究不支持上述觀點,對左心房內徑與AP-VP模式進行相關性分析,沒有發現兩者之間有顯著的相關性(P=0.318),這些發現提示AP-VP模式對房顫發生的有害影響可能與心房壓力增高和收縮性損傷有關,而不是心房擴大本身。本研究還發現AP-VP模式比例與房顫發生率呈曲線相關,隨著AP-VP模式比例增加,房顫發生率趨于穩定,這可能是由于長期起搏治療使患者對心臟起搏有更好的耐受性。因此,臨床上應盡量減少AP-VP模式比例,從而降低房顫發生率。目前,具有房室搜索功能和心室起搏管理功能(MVP)的起搏器可以有效降低AP-VP模式比例,在Xiao等[23]研究中發現,在傳統雙腔頻率適應性起搏器(DDDR)、具有房室搜索功能和具有MVP功能的起搏器中,AP-VP的中位時間百分比分別為42.8%、33.9%、6.4%。
總之,心臟起搏器患者房顫的發生是一個非常復雜的問題,本研究發現高比例AP-VP模式、左心房內徑增大是雙腔起搏器植入術后房顫發生的獨立危險因素,應用鈣拮抗劑可以減少房顫發生。臨床上應盡量采用具有房室搜索功能或MVP功能的起搏器以降低AP-VP模式百分比,從而減少術后房顫的發生。
本研究是一項回顧性研究,樣本量較小,且隨訪時間尚短,因此只能說明一種趨勢。確切結論尚待大規模臨床試驗進一步驗證。入組患者僅依據心電圖或24 h動態心電圖排除既往房顫病史,由于檢查資料可能存在缺失、患者可能存在無癥狀房顫等影響因素,術前無房顫病史患者數據可能被高估;而起搏器植入術后房顫發生的記錄相對準確,因此本研究的設計可能高估起搏器植入術后新發房顫率。

