高效微波輻射制備Fe-MSB對磷的吸附
,,,,
(安徽工業大學能源與環境學院,安徽 馬鞍山 243032)
1 前 言
磷作為富營養化的元素之一,排放標準越來越嚴格,尤其是國家對磷排放標準提高到一級A標準(0.5mg/L)后,各企業和該領域研究者對磷處理更加重視。相比其他除磷方法,吸附法除磷具有無可比擬的優點:高效低耗、操作簡單和無二次污染等[1]。
膨潤土是以蒙脫石為主要礦物成分的非金屬礦產,全球分布甚廣,主要以鈉基膨潤土為常見工業品,且具有良好的吸附性能,價格低廉[2]。但由于膨潤土的親水性極強,致使其對廢水中污染物的吸附性能較差,因此通過對膨潤土進行改性來改善其吸附性能具有重大意義。微波輻射改性法相比傳統的水熱合成法[3]具有升溫迅速、受熱均勻、加熱效率高和節約能源等優點[4]。利用微波輻射法制備改性膨潤土吸附劑,并將其用于吸附磷的研究已有報道[5-6,8]。宋珍霞等[5]采用先恒溫攪拌后微波輻射的方法,利用十六烷基三甲基溴化銨改性膨潤土,制得有機改性膨潤土,但有機物改性使天然無毒的膨潤土附帶了毒性,有悖綠色環保這一原則。范恒等[6]采用微波輻射,以季銨鹽和Al3+鹽為改性劑對鈉基膨潤土進行改性,制備有機無機復合改性膨潤土,研究復合改性膨潤土對磷的吸附,但制備過程復雜,而且由于Al3+的存在,在制備過程中可能產生破壞蒙脫石陽離子交換性能的keggin離子,影響膨潤土的吸附性能[7]。聶錦旭等[8]先利用攪拌浸泡的方式混合鈉基膨潤土和FeSO4溶液,再將其烘干后置于微波爐中輻射制得改性膨潤土(制備周期約為24h),并用其吸附磷,但制備周期長,且低價鐵鹽也不穩定。除了以上不足之處,已有的改性膨潤土吸附磷研究往往僅限于反應條件對吸附影響的研究,缺乏對磷吸附規律和機理的探討。
為了制備性能良好且穩定的環保吸附磷材料,探索簡化制備過程、縮短制備周期和磷的吸附規律,本研究以較為穩定的三價鐵鹽作為改性劑,高效利用微波能量直接輻射Fe2(SO4)3和鈉基膨潤土混合液,制備Fe-MSB(制備周期約為12h),并對改性前后鈉基膨潤土進行XRD和SEM表征。探討吸附劑投加量、初始pH、溫度和振蕩時間對Fe-MSB吸附磷性能的影響,通過吸附動力學和熱力學分析,找到吸附規律,闡述吸附機理,為膨潤土在含磷廢水處理的工業化應用方面提供吸附模型和數據。
2 實 驗
2.1 實驗材料與儀器
原料與試劑:鈉基膨潤土為工業級,硫酸鐵、磷酸二氫鉀、四水合鉬酸銨、酒石酸銻氫鉀、抗壞血酸、硫酸和氫氧化鈉均為分析純。
主要儀器:722s型可見分光光度計、P70D20N1P-G5型格蘭仕微波爐、SHZ-B型水浴恒溫振蕩器和JW-3021H型高速離心機,Ultima IV型X射線衍射儀和JSM-6490LV型掃描電子顯微鏡。
2.2 實驗方法
2.2.1Fe-MSB的制備方法 取0.8g改性劑Fe2(SO4)3·xH2O溶于50mL蒸餾水中,待改性劑溶解后形成溶液A,然后向溶液A中投加10g鈉基膨潤土(經105℃烘1.5h預處理后的鈉基膨潤土),搖勻使其完全溶解形成溶液B,靜置30min,將溶液B置于微波爐中,經微波低火輻射6min后,水洗3~4次直到洗出液澄清,隨后將其置于干燥箱中,在110℃烘干,研細。
2.2.2表征方法 采用Rigaku Ultima IV型XRD對吸附材料進行表征,測定條件:入射光源為Cu-Kα靶,入射波長λ=1.54178?,電壓V=40kV,電流I=120mA,掃描速率v=10°/min,掃描范圍(2θ)3~50°。
取少許吸附材料,置于噴鉑金的小銅片上,于JSM-6490LV型SEM下,放大2000倍,觀察吸附材料的微觀形貌。
2.2.3吸附實驗 (1)操作步驟與測定方法 取50mL模擬含磷廢水(用磷酸二氫鉀和蒸餾水配制,其pH≈6、磷含量C=25mg/L,現配現用)置于250mL錐形瓶中,加入若干吸附劑,置于水浴恒溫振蕩器中,在一定水浴溫度下,振蕩一段時間。取出部分吸附后的溶液移入15mL離心管中,在離心機轉速為4000r/min下離心5min,取上清液,依據《鉬酸銨分光光度法》(GB 11893-89)測定溶液中殘余磷濃度。
按下式計算去除率R(%)及平衡吸附量qe(mg/g):
R=[(C0-Ce)/C0]×100%
(1)
qe=(C0-Ce)V/m
(2)
式中,C0為磷的初始濃度(mg/L),Ce為平衡濃度(mg/L),V為溶液體積(L),m為吸附劑投加量(g)。
(2)吸附實驗方案 采用單因素實驗探討Fe-MSB投加量、pH值、溫度和振蕩時間對去磷效果的影響。各因素具體水平取值見表1。

表1 吸附實驗方案設計Table 1 Adsorption experiment scheme
2.2.4吸附等溫實驗 分別取50mL初始濃度為20、25、30、40和50mg/L的模擬含磷廢水置于250mL錐形瓶中,向每個錐形瓶中加入1.0g Fe-MSB,將錐形瓶放入水浴恒溫振蕩器中,分別在水浴溫度為293、303、313和323K下,振蕩120min。取出部分吸附后的溶液移入15mL離心管中,在離心機轉速為4000r/min下離心5min,取上清液測定溶液中的殘余磷濃度。
3 結果與討論
3.1 吸附劑的表征
3.1.1XRD分析 由圖1可以看出,Fe-MSB和鈉基膨潤土的XRD圖譜相似,說明Fe3+的引入并沒有破壞鈉基膨潤土內部原有的基本構架[9]。但可以看出Fe-MSB的d001處峰所對應的2θ比鈉基膨潤土的d001處峰所對應的2θ明顯減小。
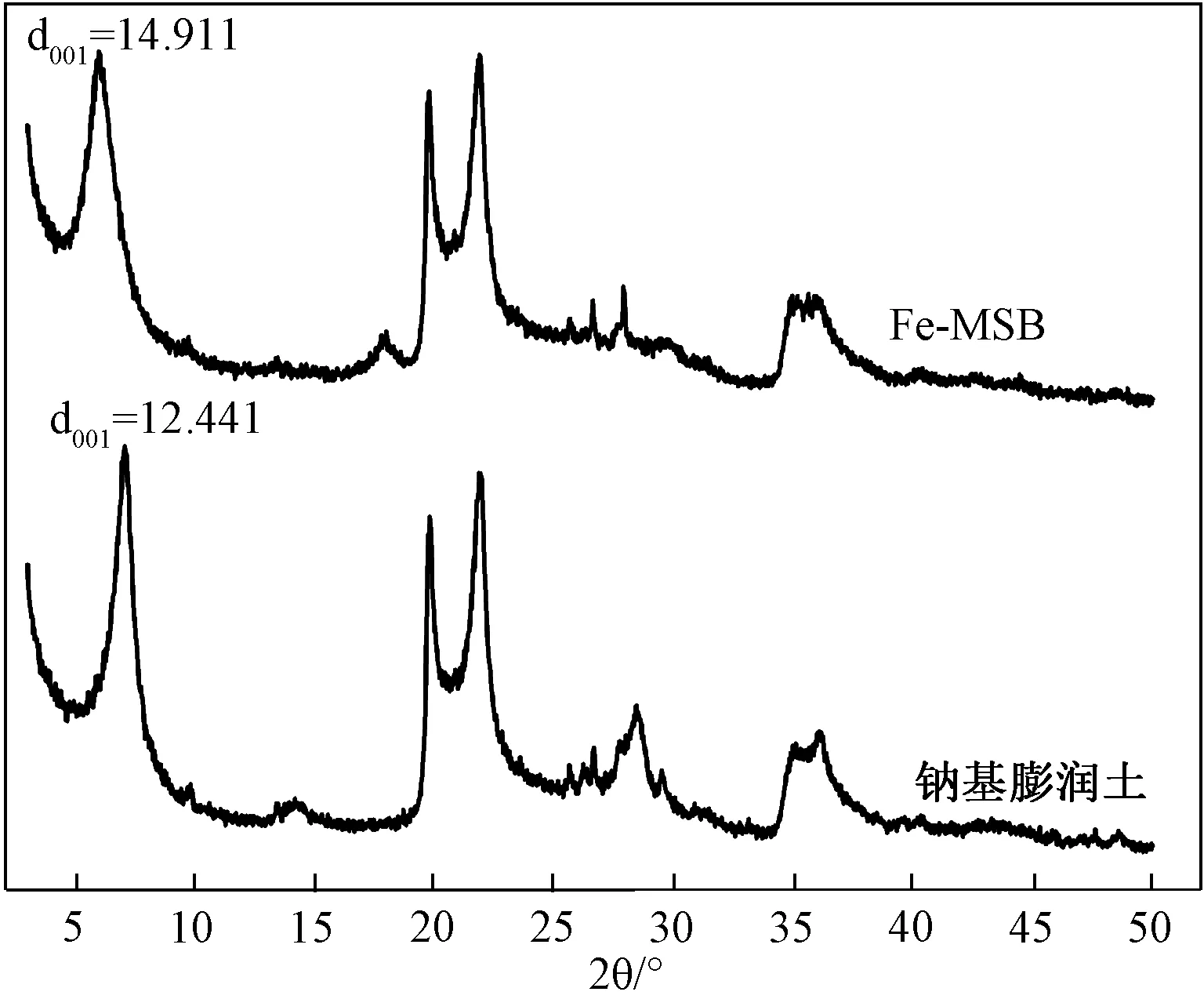
圖1 吸附劑的XRD圖譜Fig.1 XRD patterns of adsorbents
根據Bragg公式[10]:
2dsinθ=nλ
(3)
式中:d為晶面間距(?),θ為入射X射線與相應晶面的夾角(°),n為衍射級數。由圖1得到的Fe-MSB的d001=14.911大于鈉基膨潤土d001=12.441。d001越大,說明鈉基膨潤土的分子層間被撐得越開,吸附性能就越好[11]。XRD表征表明Fe3+進入到了鈉基膨潤土的分子層間,成功改性了鈉基膨潤土,改變了鈉基膨潤土的層狀結構[12],使鈉基膨潤土層間距變大,可使其吸附性能提高[11]。
3.1.2SEM觀察 分別對鈉基膨潤土和Fe-MSB進行SEM表征,分析其微觀結構,結果如圖2所示。圖2(a)中鈉基膨潤土表面光滑,而圖2(b)中Fe-MSB表面粗糙、疏松、多孔,其原因可能是因為Fe3+取代鈉基膨潤土中的鈉離子導致鈉基膨潤土表面電荷發生變化,負電性增強;此外在改性過程中,將Fe2(SO4)3、膨潤土和蒸餾水混合溶解,除了大部分Fe3+取代了鈉離子連接在鈉基膨潤土表面外,一小部分的Fe3+可與水形成Fe—OH鍵,插入鈉基膨潤土層間,產生片層翻起的現象,經微波輻射,在鈉基膨潤土層間進行了陽離子交換,鈉基膨潤土中雜質以及無定性相被置換出來,因此鈉基膨潤土的插層和其中無定形相減少,造成了改性后的Fe-MSB的片層與孔隙[13]。這樣的結構改變可使吸附劑的吸附能力得到增強[9,14-15]。結合XRD分析進一步說明Fe3+成功進入到了鈉基膨潤土的分子層間,改善了鈉基膨潤土的孔道和孔隙結構[16],從而提高了鈉基膨潤土的吸附性能。

圖2 吸附劑的SEM圖像 (a) 鈉基膨潤土;(b) Fe-MSBFig.2 SEM patterns of adsorbents (a) Sodium bentonite; (b) Fe-MSB
3.2 Fe-MSB吸附磷的影響因素
3.2.1Fe-MSB投加量對吸附的影響 由圖3可知,隨著Fe-MSB投加量的增加,磷的去除率先迅速增加后趨于穩定。在Fe-MSB投加量在10~20g/L內,去除率隨投加量的增加而迅速增大;此后繼續增加投加量,磷的去除率趨于穩定。當Fe-MSB投加量為20g/L時,Fe-MSB對磷的去除率高達98.72%,此時出水磷濃度為0.32mg/L,已達到排放標準(0.5mg/L),繼續增加投加量對磷的去除率提高并不明顯。胡鳳杰等[17]向100mL模擬含磷廢水(C0=5mg/L)添加6.0g 改性膨潤土,對磷的去除率為70.21%。本研究與胡鳳杰相比,膨潤土投加量明顯減少。因此,將Fe-MSB投加量設定為20g/L。

圖3 Fe-MSB投加量對磷吸附的影響Fig.3 Effect of Fe-MSB dosage on adsorption
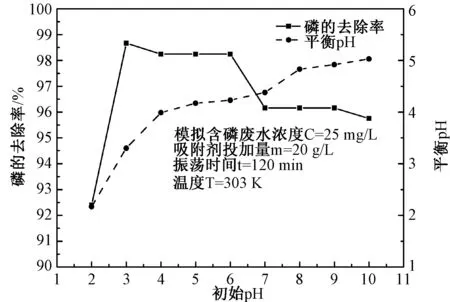
圖4 初始pH值對磷吸附的影響Fig.4 Effect of initial pH on adsorption
3.2.2初始pH值對吸附的影響 由圖4可知,磷的去除率隨初始pH值的增加先增大,后略有降低。在初始pH=2時,Fe-MSB對磷的去除率較低,根據不同pH條件下磷酸鹽的形態分布,當pH≤2時,在強酸環境中,磷酸鹽的主要存在形式為H3PO4,溶液中的H+較多,占據了膨潤土的吸附點位[17],使Fe-MSB對磷的吸附效果下降,吸附后溶液的H+減少導致平衡pH升高;在初始pH=3時,磷去除率達到峰值;初始pH在3~6之間,磷的去除率維持在較高水平;當初始pH>6時,隨著溶液處于的堿性環境越強,溶液中OH-越多,與磷酸根負離子形成競爭吸附,此外由于Fe3+作為Lewis酸酸位點,在溶液的pH值增大時,溶液中OH-與其作用,導致Fe-MSB吸附活性降低,磷去除率降低,同時溶液中OH-就會減少,致使吸附后平衡pH值降低[18]。
由此分析可知,初始pH維持在3~6之間,Fe-MSB對磷的吸附效果較好,Fe-MSB適用于處理弱酸性廢水,而本研究模擬含磷廢水pH≈6,為節約吸附劑,可省去實驗用水pH值的調試。本研究與胡鳳杰[17]和顧偉[19]等的研究結果一致。胡鳳杰[17]等將pH調至6,改性膨潤土對磷的去除率達到最大,為78.41%。顧偉[19]等研究Al3+改性膨潤土對磷的吸附,研究表明在pH為6時,吸附劑對模擬含磷廢水中磷的去除效果最好,為95.1%。
3.2.3溫度對吸附磷的影響 由圖5可知,隨著反應溫度升高,Fe-MSB對磷的去除率先快速增加后趨于平緩。當溫度<303K時,去除率隨著溫度升高明顯增大,當溫度T=303K時,磷的出水濃度已在0.5mg/L以下。繼續升高溫度,Fe-MSB對磷的去除率增加幅度較小。綜合節約能耗和磷含量達標兩因素,實驗將溫度控制在303K。
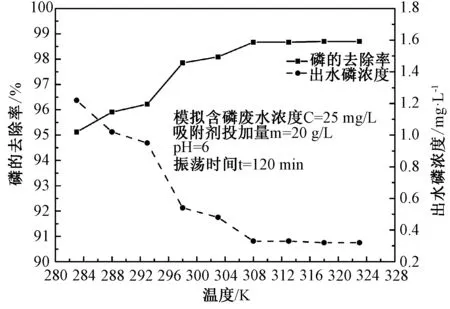
圖5 溫度對磷吸附的影響Fig.5 Effect of temperature on adsorption
3.2.4振蕩時間對吸附的影響及吸附動力學分析 由圖6可見,隨著吸附時間延長,Fe-MSB對磷的吸附量先迅速增加后趨于穩定。吸附過程大致分為兩個階段:第一階段5~60min為快速反應,第二階段60~240min為慢速反應。在t=120min時,吸附基本達到平衡,此時水中磷濃度降至0.32mg/L。因此將吸附時間確定為120min。
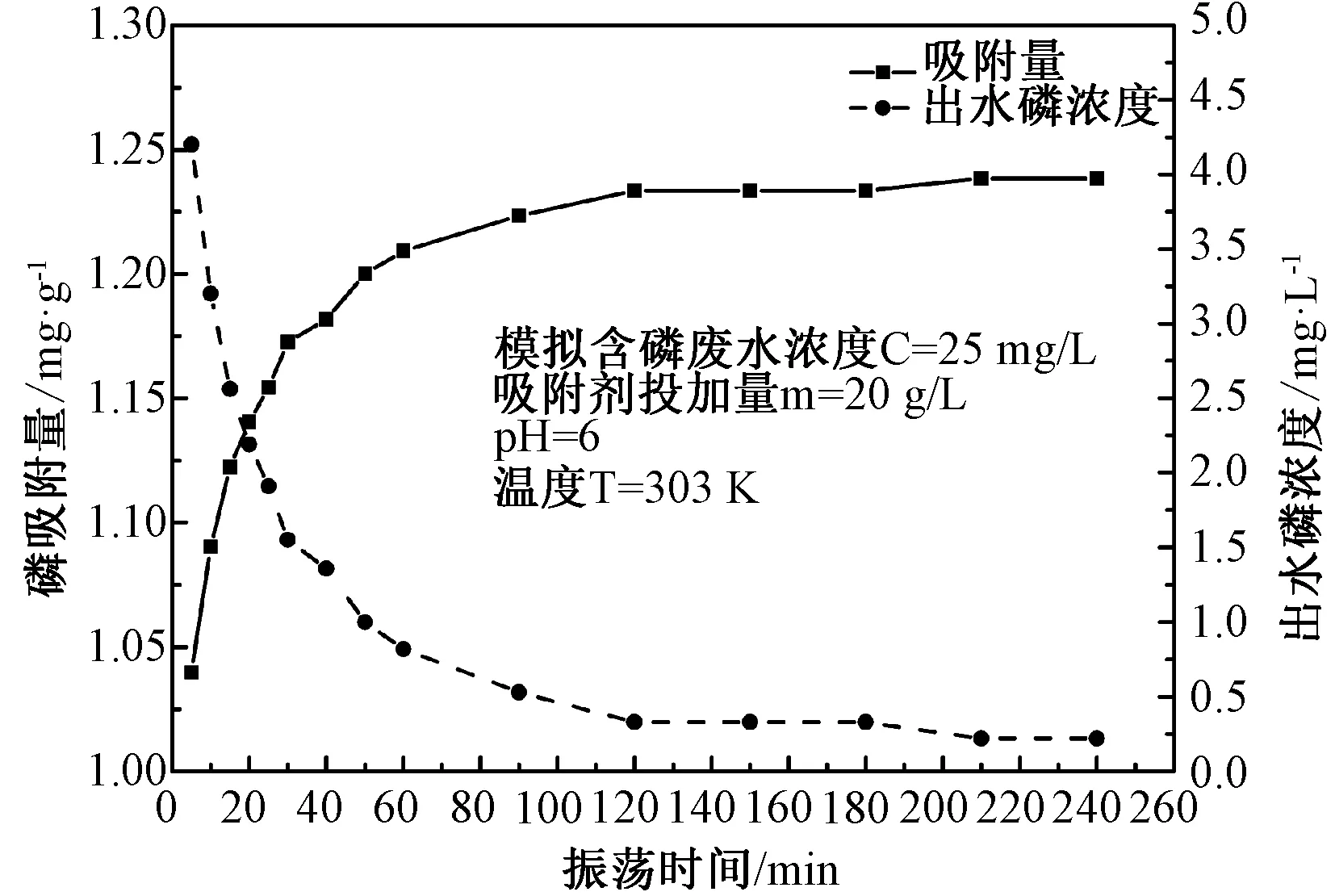
圖6 振蕩吸附時間對磷吸附的影響Fig.6 Effect of reaction time on adsorption
根據圖6中實驗數據對吸附過程的動力學進行擬合,主要采用3個動力學模型方程,包括:
一級動力學模型[20]:
log(qe-qt)=logqe-Kf/2.303t
(4)
準二級動力學模型[21]:
t/q=Ks-1qe-1+qe-1t
(5)
顆粒內擴散模型[22]:
qt=Kidt1/2+C
(6)
式中:qe為平衡吸附量(mg·g-1);qt為t時刻的吸附量(mg/g);Kf為一級吸附速率常數(min-1);Ks為準二級吸附速率常數[(g/mg·min)];Kid為傳質擴散速率[mg/(g·min2)],C為截距(mg/g)。
分別用動力學方程(4)、(5)和(6)對吸附過程中快速反應階段、慢速反應階段和整個吸附過程進行擬合,根據線性化的R2值來判斷擬合的優劣。表2所示的擬合結果表明:以準二級動力學方程描述Fe-MSB吸附磷的吸附過程為最優,且其擬合出的qe與實驗結果極為接近,說明該過程以化學吸附為主[18]。陳泳[18]等在吸附磷的研究中也得到了同樣的結果。

表2 吸附動力學方程及相關系數Table 2 Adsorption kinetic parameters and correlation coefficients
3.3 吸附熱力學分析
吸附等溫線的擬合采用Langmuir和Freundlich兩個吸附等溫方程[23-26]。
Langmuir吸附等溫方程:
(7)
Freundlich吸附等溫方程:
lnqe=lnKF+(1/n)lnCe
(8)
式中:qe為平衡吸附量(mg/g);Ce為吸附平衡濃度(mg/L);qm為最大吸附容量(mg/g);KL為Langmuir常數(L/mg);KF、n為 Freundlich 吸附等溫方程的經驗參數,可以將KF看作是與吸附劑吸附容量有關的參數,n是與吸附質和吸附劑表面作用強度有關的參數。
由圖7可見,隨著磷酸根吸附平衡濃度增大,Fe-MSB對磷的平衡吸附量也隨之增加。采用方程(7)和方程(8)對圖7中實驗數據進行回歸處理,得到表3中Langmuir和Freundlich 等溫方程的相關參數R2,表明Langmuir等溫模型擬合的效果優于Freundlich。Langmuir 方程中參數 KL值隨著溫度的升高而升高,表明吸附是吸熱過程[18]。

圖7 Fe-MSB吸附磷的等溫吸附線Fig.7 Adsorption isotherm of Fe-MSB uptake P

Temperature/KLangmuirFreundlichqm/mg·g-1KL/L·mg-1R2nKF/L·g-1R22931.68691.64170.99747.35291.12890.95413031.81721.83860.99567.33681.22460.94003131.86922.56720.99538.49621.33660.97583231.96463.07180.995010.76431.45820.9456
根據范特霍夫方程[27-29]:
ΔG=-RTlnKa
(9)
(10)
式中:ΔG為標準自由能(kJ·mol-1),ΔH為吸附焓(kJ·mol-1),ΔS為吸附熵(J·mol-1.K-1),R為標準摩爾氣體常數(數值等于8.314J·mol-1·K-1),T為溫度(K),Ka為Langmuir常數,Ka=qmKL。
采用線性回歸的方法,用lnKa對1/T作圖,得到一個線性方程(如圖8):lnKa=-2549.9/T+9.6874,R2=0.9831,擬合效果較好。根據式(9)、(10)以及圖8中直線的斜率和截距可求得熱力學參數,見表4。
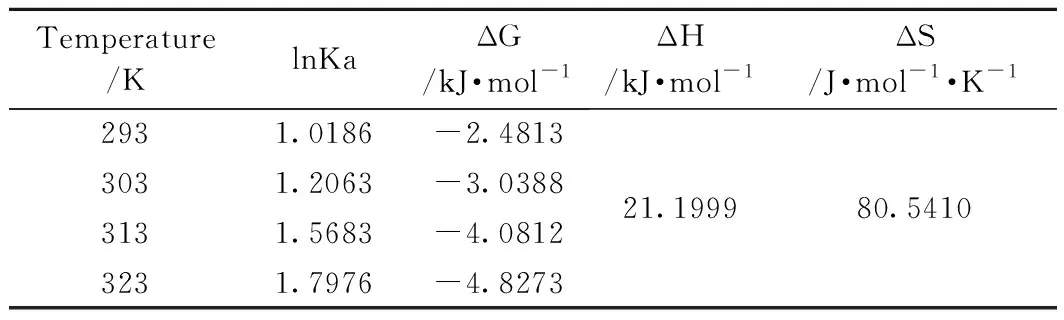
表4 吸附熱力學參數Table 4 Values of adsorption thermodynamic parameters
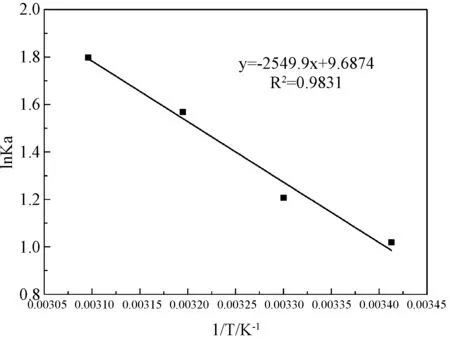
圖8 lnKa與1/T的關系曲線Fig.8 lnKa-1/T curve
由表4可知,自由能ΔG為負值,說明在自然條件下吸附能自發進行。焓變ΔH為正值,說明吸附過程是吸熱過程,升高溫度有利于吸附進行。若焓變ΔH在2.1~20.9kJ/mol之間,吸附為物理吸附;若焓變ΔH在20.9~418.4kJ/mol之間,吸附為化學吸附[30]。Fe-MSB吸附磷的焓變ΔH約為21.2kJ/mol,說明吸附主要以化學吸附為主。離子交換的焓變通常小于8.4kJ/mol[31],Fe-MSB吸附磷的焓變ΔH不在這個范圍內,說明吸附反應還存在離子交換之外的吸附機理[27]。各種作用力引起的吸附熱范圍分別為:范德華力是4~10kJ/mol,偶極間作用力是2~29kJ/mol,氫鍵力是2~40kJ/mol,疏水鍵力約為5kJ/mol,配位基交換約為40kJ/mol,化學鍵力大于60kJ/mol[32]。由此推斷吸附過程作用力是以氫鍵力和偶極作用力為主。ΔS為正值,說明吸附過程不可逆。因此Fe-MSB對磷的吸附主要以化學吸附為主,其吸附過程是一個自發進行、吸熱、不可逆過程,隨著溫度升高,固液界面上的分子運動混亂度會加劇,有利于吸附進行。
4 結 論
采用高效微波輻射法以Fe2(SO4)3為改性劑對鈉基膨潤土進行改性,制備Fe-MSB,通過該吸附劑的XRD和SEM表征分析其吸附性能。采用單因素實驗,探討吸附劑投加量、初始pH值、溫度和振蕩時間對吸附過程的影響,確立最佳吸附條件。并對吸附過程進行吸附動力學和吸附熱力學分析,探索吸附規律和吸附機理,得出以下結論:
1.采用高效微波輻射的方法,以Fe2(SO4)3為改性劑制備的Fe-MSB層間距變大,表面粗糙、多孔、松弛,吸附性能明顯提高;
2.Fe-MSB吸附磷的最佳反應條件為:Fe-MSB投加量為20g/L、初始pH=6、溫度為303K和振蕩吸附時間為120min,在此條件下Fe-MSB對磷去除率為98.72%;
3.準二級動力學模型能夠很好地描述Fe-MSB吸附磷過程,吸附規律符合Langmuir 等溫吸附方程,磷在Fe-MSB上的吸附主要以化學吸附為主,吸附過程是一個可自發進行、吸熱且不可逆的過程。

