PLK1表達對肺鱗癌細胞腫瘤生物學行為的影響的研究
陳 閣,張耀中,米 源,廖海江,王 雷
原發性肺癌目前是全球最常見的癌癥死因之一,每年約有138萬人死于肺癌,占癌癥總死亡人數的18.2%[1]。據統計57%患者在初診時發生了遠處轉移,近年來隨著基因組學相關技術的蓬勃發展,晚期肺癌的治療步入了個體化分子靶向精準治療時代[2],隨著酪氨酸激酶抑制劑等靶向藥物問世,部分肺腺癌患者已經從中受益,但目前肺鱗癌還未找到有效的治療靶點。Polo樣激酶1(polo-like kinase 1,PLK1)作為絲氨酸-蘇氨酸激酶家族之一,在前列腺癌[3]、神經母細胞瘤細胞[4]、急性髓性白血病[5]和宮頸癌[6]等多種惡性腫瘤中高表達,其在啟動、維持和完成有絲分裂的過程中起著重要的作用,并且與生存預后關系密切,抑制PLK1表達可以通過干擾有絲分裂的多個階段導致腫瘤細胞死亡,PLK1有望成為癌癥治療的潛在目標[7]。目前關于PLK1 和肺鱗癌發生發展和上皮-間質轉化關系的研究較少,該研究通過沉默PLK1基因表達,探討其與肺鱗癌細胞生長和侵襲轉移的分子機制,旨在為肺鱗癌的靶向治療提供新思路。
1 材料與方法
1.1材料
1.1.1實驗主要試劑 人肺鱗癌細胞株SK-MES-1由河北省腫瘤研究所提供;胎牛血清購自美國Gemini公司;EMEM細胞培養液購自美國Gibco公司;SilencerTMSelect PLK1、control siRNA、TaqManTMPLK1引物和探針(Hs00983227_m1)、TaqManTMGAPDH(Hs02758991_g1)購自美國Life Technologies公司; LipofectamineTMRNAiMAX 轉染試劑盒和Opti-MEM培養基購自美國Invitrogen公司;iScriptTMcDNA合成試劑盒、2× Laemmli Sample Buffer、 Tris/甘氨酸緩沖液、Tris/甘氨酸/蛋白電泳緩沖液和Mini-PROTEAN TGX 預制膠購自美國Bio-Rad公司;總RNA提取試劑盒購自德國 Qiagen公司;鼠抗人E-cadherin、Vimentin 和GAPDH單克隆抗體以及兔抗人PLK1單克隆抗體購自美國abcam公司;C-myc 兔抗人單克隆抗體購自美國cell signaling公司;West Femto最高靈敏度化學發光底物試劑盒、Pierce-BCA 蛋白分析試劑盒購自美國Thermo Fisher Scientific公司;PVDF 膜購自美國Millipore公司;Transwell膜嵌套、matrigel 膠購自美國BD公司。
1.1.2實驗主要儀器設備 Synergy-HT 多功能酶標儀購自美國BIO-TEK公司;ABI Prism 7900HT型熒光定量PCR儀購自美國applied biosystems公司;小型 Trans-Blot轉印槽購自美國BIO-RAD公司,Falcon細胞培養瓶購自美國BD公司;NanoDrop 8000全光譜紫外-可見光分光光度計購自美國Thermo Scientific公司。
1.2實驗方法
1.2.1細胞培養和轉染 SK-MES-1細胞采用10%EMDM細胞培養液在37 ℃、5% CO2環境下培養,將呈對數生長期且生長狀態良好的細胞接種于6孔板上,每孔3×105個細胞數,融合生長達到60%左右時設空白對照組(Control組)和實驗組(siRNA組),更換2% EMDM培養基,分別將 Lipofectamine 2000和siRNA稀釋于Opti-MEM,輕微混勻靜置5 min后將上述兩種稀釋液均勻混合,室溫放置20 min后加入6孔板內,實驗分兩組:siRNA組和Control組,每組終濃度均為100 nmol/L,每組實驗重復3次。轉染6 h后更換新培養基繼續培養至48 h。
1.2.2實時熒光定量PCR法檢測轉染前后PLK1基因的表達 ① 總RNA的提取:PBS洗滌轉染48 h后的SK-MES-1細胞,參照總RNA提取試劑盒說明書提取每組樣本總RNA,將純化的RNA于NanoDrop 8000分光光度計上檢測RNA濃度;② 逆轉錄合成cDNA:參照iScriptTMcDNA合成試劑盒的說明書進行每組樣本cDNA 的反轉錄,總反應體系40 μl:iScript 逆轉錄酶2 μl、iScript反應混合液8 μl、總RNA 500 ng、其余加R-Nase水,置于Veriti? 96-Well Thermal Cycler儀器中在25 ℃、5min,42 ℃、 30min,85 ℃、5min的條件下進行每組樣本cDNA合成,所得cDNA在-20 ℃保存備用。③ 實時熒光定量PCR擴增:用無R-Nase水將合成的每組cDNA稀釋10倍作為模板,取樣本cDNA 4.5 μl,Taqman 基因表達預混液5 μl, PLK1或GAPDH引物和探針0.5 μl,反應體系共10 μl加到384孔板上(冰上),瞬時離心后放置于ABI 7900HT PCR儀,95 ℃ 10 s;60 ℃ 10 s;72 ℃ 10 s的條件下進行PCR擴增,40個循環。每組實驗重復3次。將實驗數據按照2-ΔCt法進行數據分析。
1.2.3Western blot法檢測基因沉默PLK1基因后對肺鱗癌細胞相關蛋白表達的影響 將轉染48 h后SK-MES-1細胞用PBS洗滌,然后將6孔板置于冰上,在每孔中分別加入含有蛋白酶抑制劑的M-PER細胞總蛋白提取試劑100 μl,并收集每組樣本的總蛋白提取液,離心取上清液(樣本的細胞總蛋白),按照BCA 法測定每組樣本的總蛋白濃度。于小型 Trans-Blot轉印槽中加上Tris/甘氨酸/蛋白電泳液后,于Mini-PROTEAN TGX 預制膠中上樣每組樣本蛋白,設置電泳工作條件為200 V、50 min,電泳結束后用水和轉膜緩沖液沖洗凝膠15 min,用三明治法于Tris/甘氨酸緩沖液中轉膜至PVDF膜(冰浴),設置工作條件100 V、1 h。將轉膜后的PVDF膜于5%脫脂奶粉的TBST液封膜1 h(室溫),根據目的蛋白的不同KD值剪膜,分別加入一抗工作液PLK1(1 ∶1 000)、一抗工作液C-myc(1 ∶1 000)、一抗E-cadherin(1 ∶10 000)、一抗Vimentin(1 ∶10 000)、一抗 GAPDH(1 ∶20 000),4 ℃搖床孵育過夜。第2天收集一抗后用TBST洗膜3次,每次10 min,二抗室溫孵育1 h,TBST洗膜3次,每次10 min。每組實驗重復3次。將化學發光底物滴于PVDF膜上5 min后于暗室曝光顯影,以GAPDH作為內參,使用 Image軟件測量目的蛋白(顯影條帶)灰度值。
1.2.4流式細胞術檢測PLK1基因沉默后細胞周期的變化 將轉染48 h后SK-MES-1細胞用PBS洗滌,胰酶消化貼壁細胞,收集細胞制備成單細胞懸液,冷PBS漂洗,加1 ml PBS吹打均勻重懸細胞,緩慢加入4 ℃、70%冰乙醇5 ml(置振蕩器上旋轉攪拌),固定30 min以上。冷PBS漂洗3次去除乙醇,重懸細胞后加含40 μg碘化丙啶和100 μg RNaseA的PBS,避光4 ℃染色30 min。每組實驗重復3次。400目尼龍網過濾,采用MuticycleAV分析軟件對DNA細胞周期進行擬合分析檢測每組樣品的DNA含量,PI 激發波長為488 nm。
1.2.5侵襲實驗檢測PLK1基因沉默后肺鱗癌細胞侵襲能力的變化 將放到4 ℃冰箱變為液態Matrigel膠平鋪于聚碳酸酯膜。收集轉染后的SK-MES-1細胞用無血清培養基懸浮細胞,調整細胞計數后將含1×105個細胞的EMEM 200 μl置于Transwell小室上室。下室加含500 μl 10%FBS的EMEM培養液,然后放置于37 ℃、5% CO2恒濕溫箱內孵育24 h,24 h后用棉棒擦去膜靠近內室一面的基質膠和細胞,甲醇室溫固定30 min,0.1%結晶紫染色10 min,清水漂洗,晾干膜,每組實驗重復3次。顯微鏡下隨機選取4個高倍視野(×400)觀察穿膜細胞數。

2 結果
2.1實時熒光定量PCR檢測PLK1基因沉默后PLK1基因表達量的變化siRNA組PLK1 mRNA表達水平(0.35±0.05)較Control組(1.00±0.02)顯著降低,差異有統計學意義(t=21.827,P<0.001),見圖1。
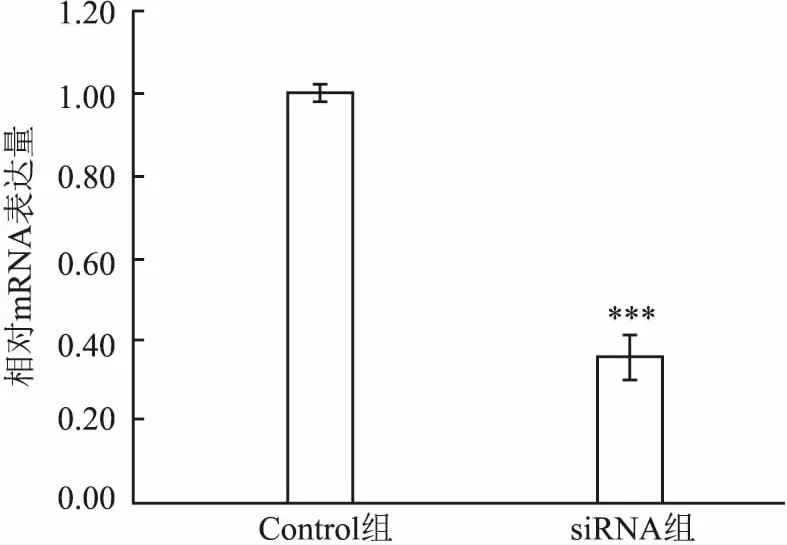
圖1 實時熒光定量PCR法檢測PLK1 mRNA表達與Control組比較:***P<0.001
2.2Westernblot檢測蛋白表達SK-MES-1細胞PLK1、E-cadherin、Vimentin和C-myc蛋白的表達用Image軟件測量:siRNA組PLK1蛋白表達(0.55±0.03)較Control組 (1.00±0.02)顯著減少(t=24.65,P<0.001),E-cadherin蛋白表達(1.79±0.04)較Control組(1.00±0.03)顯著增加(t=-30.60,P=0.000),Vimentin蛋白表達(0.32±0.02)較Control組(1.00±0.02)顯著減少(t=47.03,P<0.001),差異均有統計學意義;C-myc蛋白表達(0.42±0.03)較Control組(1.00±0.04)明顯減少(t=21.42,P<0.001),差異有統計學意義;見圖2。
2.3流式細胞術檢測細胞周期的影響結果顯示:siRNA組G2/M期細胞為(26.27±0.80)%,與Control組(20.67±0.85)%比較顯著增高(t=-8.30,P=0.001);siRNA組S期細胞為(22.70±1.95)%,與Control組(26.93±0.32)%比較顯著降低(t=3.707 ,P=0.021);siRNA組G0/G1期細胞為(51.00±1.15)%,與Control組(52.40±0.62)%比較差異無統計學意義(t=1.849,P=0.138),見表1。

表1 流式細胞術檢測轉染肺鱗癌PLK1后細胞周期的變化
與Control組比較:*P<0.05
2.4Transwell侵襲實驗與Control組穿膜細胞數(73.00±4.51)比較,siRNA組穿膜細胞數(36.00±2.08) 明顯減少,差異有統計學意義(t=12.903,P<0.001),見圖3。

圖2 Western blot法檢測SK-MES-1細胞中PLK1、E-cadherin、Vimentin和C-myc蛋白表達
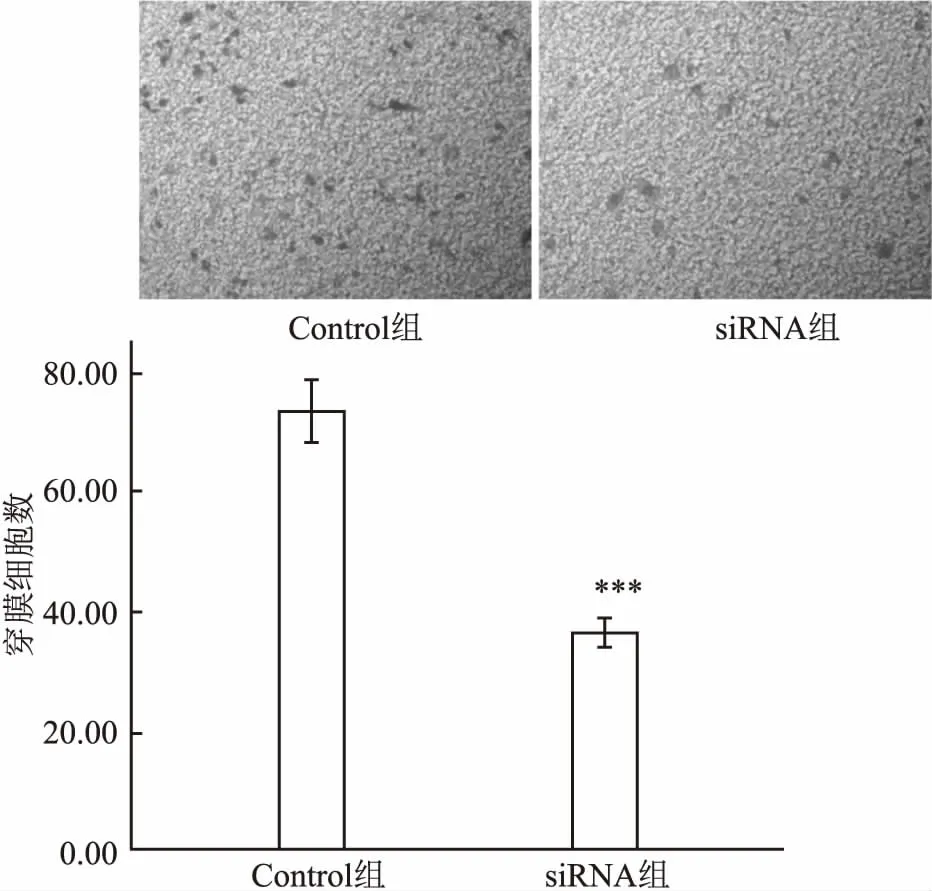
圖3 沉默PLK1基因對SK-MES-1細胞侵襲能力的影響 ×400
3 討論
PLK1是PLK家族成員之一,其作為細胞周期調控網絡中的關鍵蛋白在細胞有絲分裂調節過程中發揮重要作用。目前研究[8- 9]表明PLK1在多種腫瘤組織中存在顯著過表達的現象,這與腫瘤的生物學行為以及患者的預后等密切相關,靶向特異性抑制PLK1基因表達可有效抑制腫瘤細胞增殖并誘導其凋亡,而小RNA干擾技術(small interfering RNA,siRNA)作為雙鏈RNA分子介導序列特異性轉錄后基因沉默技術,因為具有高度特異性和高效性,目前在惡性腫瘤的研究及治療等方面具有廣闊的應用前景。由于預后不良的非小細胞肺癌患者表達高水平的PLK1[10],因此 PLK1可以作為靶向治療很好的候選基因,并可用來作為腫瘤標志物,但目前尚未完全闡明PLK1如何調控肺鱗癌細胞生物學行為,本研究通過應用siRNA沉默SK-MES-1細胞PLK1基因表達,結果顯示SK-MES-1細胞中存在PLK1高表達現象,RNA干擾可顯著減少腫瘤細胞PLK1 mRNA和蛋白表達。
細胞周期是細胞周期蛋白、細胞周期蛋白激酶以及細胞周期蛋白激酶抑制劑等多個蛋白調節的有序事件,細胞周期紊亂導致腫瘤的發生發展。C-myc癌基因屬核蛋白基因,具有轉化細胞的能力,在調節細胞生長、分化及惡性轉化中發揮關鍵作用,C-myc癌基因擴增與多種腫瘤的發生、發展和演變轉歸具有重要關系。PLK1作為細胞周期調節因子具有在細胞分裂間期可以促進中心體成熟,促進細胞周期由G2期進入M期以及PLK1 促進染色體分離等功能,對細胞周期中各大重要事件的順利進行以及周期相關檢驗點的調控中均發揮重要作用。本研究通過流式細胞術對兩組肺鱗癌細胞所處細胞周期的分布進行分析,結果顯示 siRNA組與Control組相比可將更多細胞阻滯于G2/M期,并且可以下調C-myc表達,這與Berges et al[9]和Amani et al[11]采用PLK1靶向抑制劑發現可以通過顯著阻滯細胞于G2/M期導致腫瘤細胞增殖和凋亡增加的結果相一致,表明PLK1在肺鱗癌細胞異常增殖過程中起著重要作用,靶向抑制PLK1后可導致腫瘤細胞因失去正常G2/M檢查點的調控并且下調C-myc表達抑制腫瘤細胞的生長。
上皮-間質轉化主要表現為E-Cadherin等上皮表型標志表達下調,而N-Cadherin、Vimentin 等間質表型標志表達上調。通過EMT,腫瘤細胞的侵襲和轉移能力顯著增強,并且與患者預后密切相關[12-14]。Vimentin作為存在于間質細胞中的一種中間纖維蛋白在腫瘤細胞和內皮細胞的遷移、黏附和上皮癌的EMT中發揮重要作用,可作為抗腫瘤轉移研究和治療的新靶點[15]。Cai et al[16]研究發現PLK1 可以促進胃癌細胞侵襲轉移和EMT轉化。本研究表明抑制PLK1表達后可導致肺鱗癌細胞E-cadherin蛋白表達上調,Vimentin蛋白表達下調,并且侵襲實驗證實敲掉PLK1基因后可導致腫瘤細胞穿膜細胞數明顯減少,侵襲能力降低,其原因可能是PLK1通過誘導肺鱗癌腫瘤細胞發生EMT轉化,導致E-cadherin下調,Vimentin表達上調所致。
綜上所述,本研究顯示PLK1與肺鱗癌生物學行為關系密切,可以通過調節腫瘤細胞的生長增殖和誘導EMT促進腫瘤發生發展和轉移,本研究為尋找靶向PLK1相關的抗腫瘤藥物研究奠定了基礎,PLK1有望成為肺鱗癌分子靶向治療的一個新選擇。

