子宮內膜息肉術后患者行凍融周期囊胚移植臨床結局分析
王 超,邢 瓊,向卉芬,徐祖瀅,曹云霞
子宮內膜息肉指子宮內膜局部過度生長呈局限性腫物突出宮腔表面,呈單發性或多發性,有蒂或無蒂,鏡下表現為局限性腫物由子宮內膜腺體及間質構成。子宮內膜息肉臨床可表現為無癥狀、異常子宮出血或不孕等。在無癥狀女性中發生率約10%,異常子宮出血女性中發生率為24%~41%[1]。因不孕癥需行體外受精-胚胎移植(invitrofertilization and embryo transfer,IVF-ET)助孕患者中約32%患者存在子宮內膜息肉[2]。欒雪峰 等[3]發現子宮內膜息肉合并不孕癥患者行息肉切除術后自然妊娠率顯著提高。可見,子宮內膜息肉是影響女性生育功能的一項常見且重要的因素。目前關于子宮內膜息肉在不孕癥女性中的研究較多關注于控制性卵巢促排卵效果及新鮮周期移植結局分析。由于新鮮周期胚胎移植對患者的獲卵數、絨毛膜促性腺激素(HCG)注射日孕酮值及內膜厚度等具有一定要求,以及胚胎冷凍技術的發展,使得復蘇周期胚胎移植在各中心均占有很大的比例。并且有研究[4]顯示,與新鮮周期胚胎移植相比,復蘇周期胚胎移植具有較好或者類似的臨床結局。該研究將探討子宮內膜息肉術后合并不孕癥患者行復蘇周期囊胚移植的臨床結局。
1 材料與方法
1.1病例資料回顧性分析2014年6月~2017年7月于安徽醫科大學第一附屬醫院生殖醫學中心行復蘇周期囊胚移植共898個周期的臨床資料。息肉組共405個周期,所有患者具有既往因子宮內膜息肉行宮腔鏡手術切除病史,術后病理證實為子宮內膜息肉,納入研究周期中B超監測內膜回聲均勻,未發現異常回聲團。再根據移植前內膜準備方案,分為自然周期亞組(n=201)及激素替代周期亞組(n=204)。對照組為通過檢索同期病例號中含“10”且不具有子宮內膜息肉病史不具有排除標準的周期共493個周期。所有病例排除標準為其他子宮因素不孕癥者,如子宮內膜不典型增生、子宮肌瘤、宮腔粘連、子宮畸形等。
1.2治療方案
1.2.1胚胎來源 卵子獲取后經體外受精(IVF)/卵胞漿內單精子注射(ICSI)受精后培養至D5或D6,后行玻璃化冷凍保存。
1.2.2自然周期 月經周期第2~5天行經陰道超聲(TVS)檢查排除卵巢囊腫、宮內異常回聲,依據月經周期長短,在月經周期第8~12天開始監測卵泡生長直至排卵發生,依據卵泡大小決定監測頻率,必要時使用HCG誘導排卵。排卵后第5天解凍胚胎,TVS引導下移植D5或者D6囊胚1~2枚。移植后可使用地屈孕酮(達芙通,荷蘭Abbott Biologicals B.V.)10 mg,Bid進行黃體支持。
1.2.3激素替代周期 月經周期第2~3天開始口服補佳樂(戊酸雌二醇,德國拜耳醫藥保健有限公司)3~4 mg/d,5~7 d后根據TVS內膜厚度考慮是否加量,最大劑量為6 mg/d,當口服補佳樂時間達14 d、子宮內膜厚度超過8 mm,加用黃體酮(浙江仙琚制藥股份有限公司)40~60 mg/d,使用黃體酮的第6天解凍1~2枚胚胎,TVS引導下移植入宮腔。移植后,補佳樂、黃體酮維持之前使用劑量,確認宮內妊娠后逐漸減量至胎盤形成后停用。
1.3妊娠結局判斷及觀察指標生化妊娠,指移植后第14天血HCG一過性陽性且移植后第30天TVS宮內宮外均未見孕囊,同時血HCG轉陰。移植后第30天TVS檢查,宮腔內見孕囊記為臨床妊娠。妊娠28周前妊娠終止記為流產。觀察指標及計算方式如下:生化妊娠率(%)=生化妊娠周期數/移植周期總數×100%,臨床妊娠率(%)=臨床妊娠周期數/移植周期總數×100%,胚胎種植率(%)=宮內孕囊總數/移植胚胎總數×100%,流產率(%)=流產周期數/移植周期總數×100%,活產率(%)=活產周期數/移植周期總數×100%,異位妊娠率(%)=異位妊娠周期數/移植周期總數×100%。

2 結果
2.1息肉組與對照組基礎資料比較息肉組與對照組相比,年齡、不孕年限、基礎卵泡刺激素(folliclestimulating hormone,FSH)、體質量指數(body mass index,BMI)、移植胚胎數差異均無統計學意義(P>0.05),息肉組內膜厚度顯著大于對照組,差異有統計學意義(P<0.05)。見表1。
2.2息肉組與對照組臨床結局比較息肉組與對照組相比,生化妊娠率、臨床妊娠率、胚胎種植率、活產率低于對照組,流產率、異位妊娠率高于對照組,但差異均無統計學意義(P>0.05)。見表2。

表1 息肉組與對照組一般情況分析
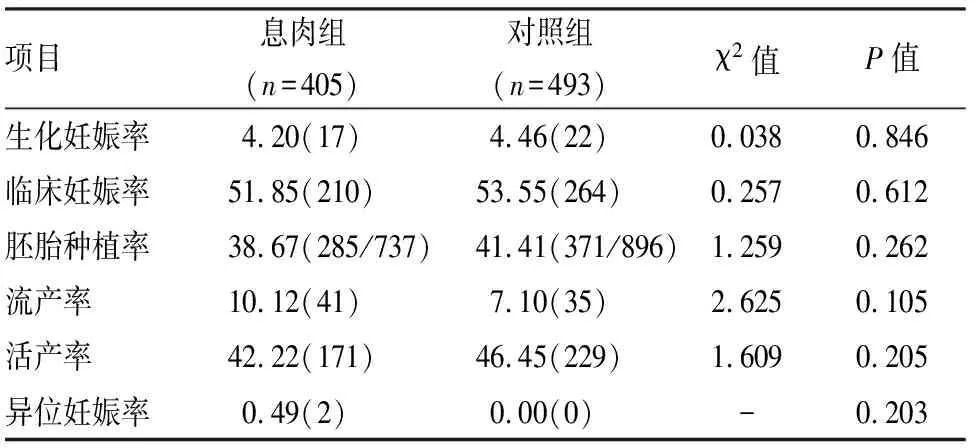
表2 息肉組與對照組臨床結局分析[%(n)]
2.3息肉組不同內膜準備方案基礎資料比較自然周期亞組及激素替代周期亞組,其年齡、不孕年限、基礎FSH、BMI、移植胚胎數差異均無統計學意義(P>0.05),自然周期亞組內膜厚度顯著大于激素替代周期亞組,差異具有統計學意義(P<0.05)。見表3。

表3 息肉組不同內膜準備方案一般情況分析
2.4息肉組不同內膜準備方案臨床結局比較兩組間的生化妊娠率、臨床妊娠率、胚胎種植率、流產率、活產率、異位妊娠率差異均無統計學意義(P>0.05)。見表4。
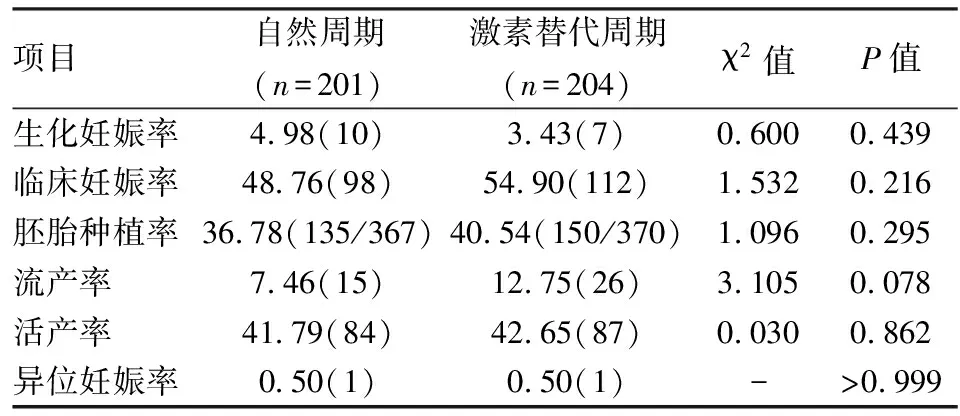
表4 息肉組不同內膜準備方案臨床結局分析[%(n)]
3 討論
子宮內膜息肉發生的病因眾多。多數研究者認為息肉的發生與體內性激素水平或性激素受體表達相關,但各種受體的表達是增加或降低目前并無統一觀點。炎癥反應相關的細胞凋亡的抑制及其他細胞間相互聯系的改變也會影響到息肉的發生[5]。此外,合并肥胖、糖尿病、高血壓等代謝異常人群子宮內膜息肉的發生率更高[6]。
子宮內膜息肉的診斷方法有經陰道超聲(二維、三維)、超聲子宮水造影、子宮輸卵管造影、宮腔鏡等檢查。子宮內膜息肉二維超聲表現為:與正常內膜相比,等回聲或偏強回聲,可呈乳頭狀、水滴狀、舌狀、條索狀等。因其具有使用方便、非侵入性、患者接受性高、對設備的要求不高、對檢查者的能力要求不如其他幾種方案嚴格等優點,經陰道二維超聲常被作為子宮內膜息肉診斷的一線檢查方法。宮腔鏡檢查能夠直視宮腔內病變,可觀察占位組織的大小、位置、單發性或多發性,同時可通過宮腔鏡直視下獲取疑似息肉組織做病理檢查,檢查的同時可行手術治療。因此,宮腔鏡聯合組織學活檢可作為子宮內膜息肉診斷的金標準。本研究中所有息肉組患者診斷依據為宮腔鏡檢查聯合組織學活檢。
研究[7]顯示6.3%的內膜息肉有完全消退的可能,可期待治療。藥物治療主要為孕激素的使用,但效果不佳,應用較少。手術去除是子宮內膜息肉治療的主要措施。無論哪種治療措施,均需注意其復發的可能性。
不孕癥患者中子宮內膜息肉具有很高的發生率,其影響生育力的因素繁雜。位于輸卵管口的息肉可通過阻擋精卵相遇而致不孕。息肉患者種植窗期孕酮/雌二醇比值降低,子宮內膜發育延遲、落后于胚泡發育, 影響著床和妨礙胎盤蛻膜發育[8]。子宮內膜容受性的標志物同源盒A10(Homeobox A10,HOXA10)及HOXA11在息肉患者中表達的降低與不孕的發生密切相關[9]。息肉患者血清及內膜局部高濃度的干擾素-γ也可能與不孕癥的發生具有一定聯系[10]。息肉的大小也與不孕癥具有一定關系,直徑小于2 cm可能對妊娠率無明顯影響[11]。一項系統評價認為子宮內膜息肉會降低妊娠率,一旦發現需盡早診斷,及時處理,從而提高妊娠率[12]。但促排卵過程中新發息肉的存在也許并不影響促性腺激素使用量及妊娠結局[13]。而將促排卵過程中新發息肉經宮腔鏡切除后行凍融胚胎移植,與無息肉不孕人群新鮮胚胎移植相比具有更高的臨床妊娠率,但胚胎種植率無顯著差異[14]。新鮮周期與復蘇周期本身的差異可能會是該研究的一個重要干擾因素。Tiras et al[15]的研究對象均為新鮮周期移植病例,研究結果提示促排前發現內膜息肉并行宮腔鏡下切除者與正常對照組具有相似的妊娠率。這意味著息肉切除病史的存在并不影響新鮮周期胚胎移植的結局,但其對復蘇周期移植結局是否有影響并未探究。目前國內外關于息肉術后患者行凍融囊胚移植研究罕見報道,本研究中所有患者為復蘇周期行凍融囊胚移植,結果顯示有息肉切除病史者移植日內膜厚度顯著大于對照組,但兩組間生化妊娠率、臨床妊娠率、胚胎種植率、流產率、活產率、異位妊娠率均無明顯差異,對有息肉切除病史者進一步亞組分析顯示,自然周期亞組內膜厚度顯著厚于激素替代周期亞組,但無相關文獻報道息肉組中兩種內膜準備方案對內膜厚度的影響,妊娠結局方面,兩亞組具有類似的結果。
綜上所述,不孕癥患者行凍融周期囊胚移植,有息肉切除病史者移植日內膜可能會厚于正常者,但并不影響其移植結局,且息肉切除病史的存在亦不影響對內膜準備方案的選擇。

