利用SSR標記和SNP芯片對小麥EMS突變體進行真實性鑒定
耿皆飛 王 娜 蔣宏寶 劉錄祥 許喜堂 魏紅升王成社 謝彥周
(1西北農林科技大學農學院/旱區作物逆境生物學國家重點實驗室,陜西楊凌 712100;2中國農業科學院作物科學研究所,北京 100081)
1928年美國科學家Stadler[1]首次報道了X射線對大麥具有誘變效應,開啟了植物誘發突變研究。據統計,截至2017年12月,世界上已有60多個國家利用誘發突變技術在170多種植物上育成和推廣了3 200個突變品種,其中包括286個小麥品種。目前誘發突變技術已廣泛應用于農作物新材料創制和優良新品種培育,在解決世界糧食安全與營養供給方面發揮了重要作用,但對于突變體的真實來源和應用價值也引起了越來越多的質疑[2]。如Caldecott等[3]認為很多選擇的突變體可能只是田間異源花粉雜交的后代而不是由于輻射誘變產生的真正突變。Knott[4]認為突變尤其在數量性狀方面的突變在作物育種中的價值并不高。此外,誘發突變后代的結實率通常會顯著下降,即使像小麥這樣嚴格的自花授粉作物,也難以避免受串粉造成的天然異交混雜,且誘變后代通常難以做到嚴格套袋自交,只要能產生優良變異,在一定程度上可以不區分突變體變異的來源。但對于遺傳研究而言,必須區分突變體的變異來源,因此,對誘變后代進行遺傳變異評價,區分真實突變體和假突變體,對于更好地發揮突變體在遺傳改良和功能基因組研究中的作用具有重要意義。
研究表明,利用表型鑒定通常難以鑒定誘變后代突變體的真實性,而利用SSR標記分析可以有效排除誘發突變體中的假突變體。如Fu等[5]利用236~340個SSR位點對親本材料及γ射線誘變產生的突變體進行檢測,發現親本與突變體之間不存在多態性。李瑞清等[6]利用分布于水稻12條染色體上的144個SSR標記分析了突變體G9和親本廣占63S,也未發現二者之間存在差異,說明該突變體是由誘發突變而來。但SSR標記會受方法和位點數量的限制,無法從全基因組水平上對突變體進行高通量的真實性鑒定[7]。單核苷酸多態性(single nucleotide polymorphism,SNP)是普遍存在于生物基因組中的一種新型分子標記,具有在基因組中數量最多、分布密度高、無需電泳、可高通量自動化檢測等特點[8-9],是繼SSR標記之后最有前途的第三代分子標記。陳竹鋒等[10]利用Illumina Infinium iSelect SNP(50 K)芯片檢測技術比較水稻品種黃華占及其突變體osms55之間的SNP位點差異,發現突變體與親本黃華占不同的純合位點僅有6個,由此判斷該突變體的遺傳背景與黃華占一致,突變體材料來源于黃華占。
小麥(Triticum aestivumL.)是最重要的糧食作物之一,隨著小麥基因組測序的迅猛發展[11-13],誘發突變技術制備的突變體在小麥遺傳改良和功能基因組學研究中發揮著重要作用[14-19]。目前國內外已經構建了多個小麥甲基磺酸乙烷(ethane methyl sulfonate,EMS)突變體庫。并對突變體的分子變異進行了評估,但關于利用分子標記對小麥突變體進行真實性鑒定的報道并不多見。呂興娜等[7]利用21對核心SSR標記對小麥品種蘭天15和鄭麥9023的航天誘變后代的抗條銹突變體進行鑒定,發現蘭天15的航天誘變衍生系可能存在異花授粉導致的遺傳重組,鄭麥9023的航天誘變衍生系可能來自航天誘變。目前,小麥中已經開發9 K[20]、90 K[21]、660 K[22]等 SNP 芯片,但利用SNP芯片對小麥EMS突變體進行真實性鑒定尚未見報道。西北農林大學旱區作物逆境生物學國家重點實驗室前期利用EMS處理小麥品系H261種子并構建了突變體庫。本研究利用SSR標記和90 K SNP芯片對其中3個突變體的真實性進行鑒定,以期為更好地發揮小麥突變體在遺傳改良和功能基因組研究奠定一定的理論基礎。
1 材料與方法
1.1 材料
LF2010、LF2099和 LF2100是小麥品系 H261經過EMS誘變獲得的,經過連續多代自交后已遺傳穩定。其中,LF2010為類病斑突變體,與H261相比,其主要農藝性狀嚴重下降[23];LF2099為葉片早衰突變體,其主要農藝性狀也嚴重下降;LF2100為無芒突變體,其主要農藝性狀與親本相差不大(圖1)。所有材料均種植于西北農林科技大學北校區小麥試驗田。
1.2 試驗方法

圖1 H261及其EMS突變體的表型Fig.1 The phenotype of H261 and EMS mutants
1.2.1 DNA的提取 待植株長至二葉一心時,取小麥葉片,按照CTAB法[24]提取基因組DNA,用0.8%瓊脂糖電泳和NanoDrop One分光光度計(Thermo,USA)檢測DNA質量和濃度。
1.2.2 SSR標記分析 用小麥染色體上特異性和穩定性較好的21對核心SSR引物[25]對突變體及其親本進行檢測。SSR引物由生工生物工程(上海)股份有限公司合成。PCR反應體系為 10 μL,含 10×PCR buffer 1 μL,10 mmol·L-1dNTP 0.15 μL,1.25 μmol·L-1引物 2 μL,2 U·μL-1Taq DNA 聚合酶 0.25 μL,10 ng·μL-1模板 DNA 3 μL,超純水 3.6 μL。 其中 10×PCR buffer、dNTP和TaqDNA聚合酶均購自上海賽默飛世爾科技(中國)有限公司。反應程序:94℃預變性5 min;94℃變性 30 s,55℃退火 30 s,72℃延伸 30 s,36個循環;72℃終延伸10 min,4℃保存。PCR產物經6%聚丙烯酰胺變性凝膠電泳分離,以2 000 V電壓電泳1.0~1.5 h。凝膠染色采用簡化硝酸銀染色法[26]。
1.2.3 SNP芯片分析 委托北京康普森生物技術有限公司,利用美國Illumina公司和美國堪薩斯州立大學共同開發的小麥90 K基因芯片對突變體及其親本材料進行檢測,其多態性分析采用Genomestudio v1.0軟件進行分析。
2 結果與分析
2.1 突變體的SSR檢測
SSR分析結果表明,H261與CS的差異標記為14個,多態性比例高達66.67%。H261與 LF2010和LF2099的差異SSR標記均為0個,但與LF2100的差異SSR標記為10個,多態性比例為47.62%(表1)。參照小麥純度檢測標準[27],差異標記≥3表示與親本遺傳相似性低,存在異花授粉或機械混雜的可能性。LF2100與親本H261差異標記為10個,由此推測LF2100是天然異交或機械混雜產生的假突變體,LF2010和LF2099與親本H261的差異標記均為0(圖2),說明LF2010和LF2099 2個突變體與親本H261的遺傳背景高度一致,是H261經過EMS誘變的后代。
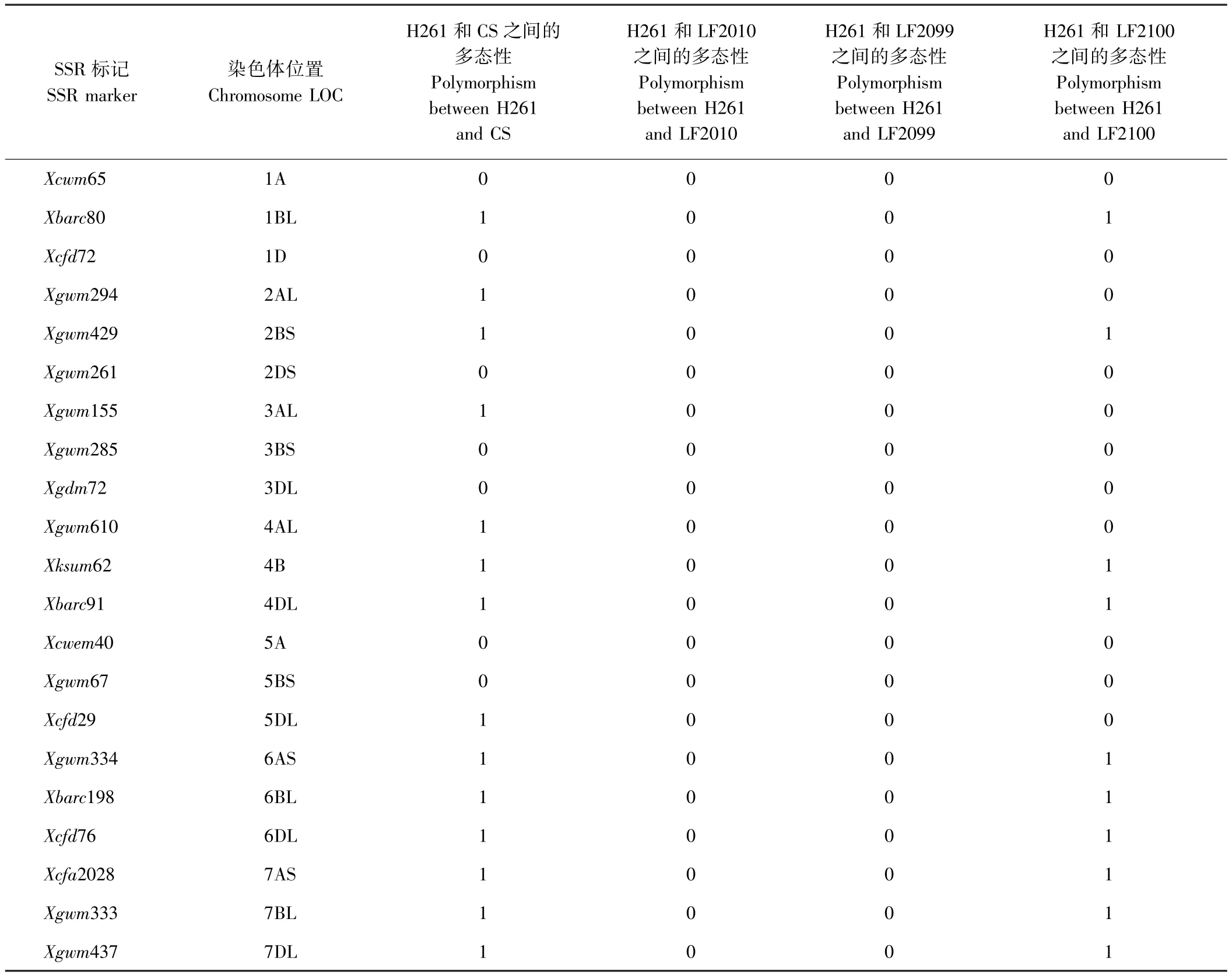
表1 小麥親本材料與突變體之間的21個SSR標記多態性檢測Table1 Polymorphism of 21 SSR markers between parent lines of wheat and mutant
2.2 突變體的SNP檢測
為了進一步探究突變體的遺傳背景與親本的關系,利用90 K基因芯片的81 597個SNP標記對H261及其衍生的突變體進行多態性分析。結果表明,H261與CS的差異位點僅3 481個,占總數的4.266 1%,純合差異 SNP為1 469,占總數的 1.800 3%;H261與LF2010和LF2099之間的差異位點分別為66和12個,這些差異SNP隨機分布于除2D、4D和6D以外的染色體上,分別占總數的0.080 9%和0.014 7%,2個突變體與H261的純合差異SNP均為0;而H261與LF2100之間的差異位點為 2 846個,占總數的3.487 9%,二者之間純合差異SNP為784,占總數的0.960 8%(表2)。上述結果從分子水平上進一步證明了突變體 LF2010和 LF2099的真實性,且說明LF2100與親本H261的遺傳背景不一致,不是H261經過EMS誘變的后代。
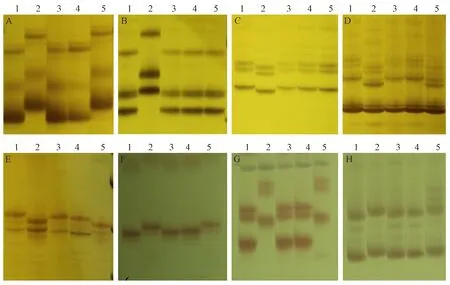
圖2 部分核心SSR引物在親本材料及其突變體的電泳圖Fig.2 Electrophoretic map of some core SSR primers in parent materials and their mutants
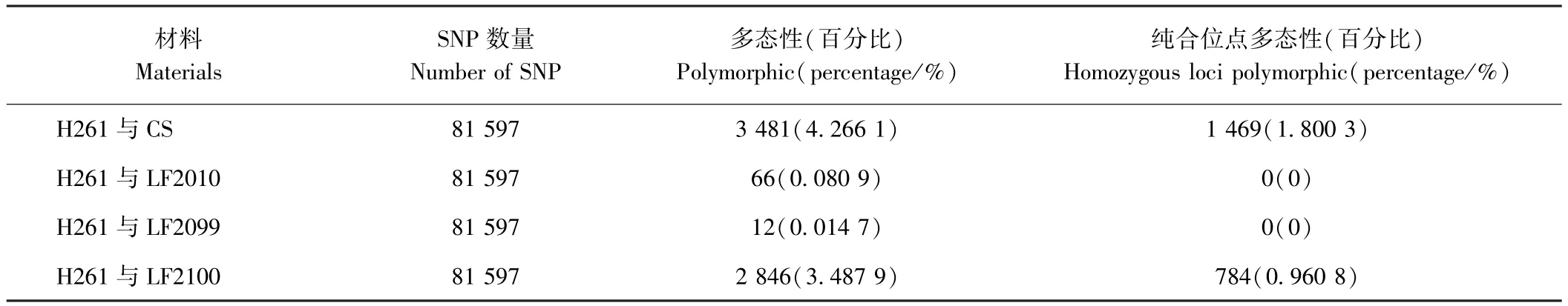
表2 小麥親本材料與突變體之間的SNP標記多態性檢測Table2 Polymorphism of SNP marker between wheat mutant and parent lines
3 討論
王立新等[25]研究表明,不同的小麥品種之間核心SSR標記具有較高的多態性。本研究結果表明,在H261和中國春(CS)之間的多態性比例高達66.67%。呂興娜等[7]利用21對核心SSR引物對小麥品種蘭天15和鄭麥9023的航天誘變后代中篩選出抗條銹病突變體進行檢測,結果表明蘭天15的航天誘變衍生系與親本間差異標記數量較多,推測可能存在異花授粉導致的遺傳重組,而鄭麥9023的航天誘變衍生系與親本差異標記數量均不超過2個,推測成株期抗病性變異可能來自航天誘變。本研究利用相同的21對核心SSR引物對H261及其EMS突變體進行檢測,結果發現,誘發突變體與親本之間,不存在SSR標記多態性,與前人研究并不一致,其原因可能是本研究中的誘發突變體和親本之間并未檢測出任何SSR位點的差異,也有可能是所用標記數量較少導致的。但Fu等[5]關于水稻的研究發現,利用236~340個SSR位點進行檢測,親本材料及γ射線誘變產生的突變體之間未發現多態性。因此,本研究利用這21個核心SSR標記可以有效地排除小麥誘變突變體中由于各種原因造成的假突變體。
小麥EMS誘變產生的突變類型主要是點突變和部分缺失突變,Krasilev等[16]研究發現,六倍體小麥每個EMS突變系平均含有5 351個EMS類型突變;而六倍體小麥基因組的大小為17 Gb,即17×109bp,突變頻率為315×10-9。本研究僅采用21對SSR引物,引物總長度為879 bp,在任何一個突變體中檢測到某一個突變的概率約為2.77×10-4。此外,根據SSR標記的原理,即使突變位點發生在SSR引物結合位點,該突變位點也不一定能被SSR標記檢測出來。從理論上解釋了本研究未能找到突變體與親本的多態性的原因。然而,在其他小麥EMS誘變后代的SSR標記檢測結果中,親本與突變體之間卻可以輕易檢測出多態性[28-30],這暗示這些突變體可能是由于各種原因產生的假突變體,當然,也存在突變位點導致SSR位點變化的可能,但這種可能性較低。
由于利用SSR標記難以鑒定突變體和親本材料之間的差異,本研究嘗試利用小麥90 K高通量SNP分析芯片對H261及其衍生的EMS突變體進行分析。結果表明,突變體LF2010和LF2099與親本H261之間的差異位點極少,多態性比例分別為0.080 9%和0.014 7%,且純合的差異位點均為0,進一步證明了LF2010和LF2099是由H261誘變而來。SNP芯片克服了SSR無法從全基因組水平上進行高通量分析的缺點,在未來的研究中可以逐步代替SSR標記,用于檢測小麥突變體的真實性,尤其是在利用高通量測序技術對突變體進行深入研究之前,突變體真實性鑒定顯得尤為重要[7-8]。
4 結論
本研究結果表明,LF2010和LF2099突變體與親本H261的遺傳背景高度一致,是H261經過EMS誘變的后代,而LF2100是天然異交或機械混雜產生的假突變體。SSR標記和SNP芯片2種方法均可以有效鑒定EMS突變體的真實性,SNP芯片由于可以進行高通量和全基因組水平的分析,在小麥突變體的真實性鑒定方面顯示出更大的應用潛力。本研究結果為更好地發揮小麥突變體在遺傳改良和功能基因組研究中的作用奠定了一定的理論基礎。

