微生物源谷氨酰胺轉胺酶修飾蛋白質機理及其在食品方面的應用進展
李明奇,賀稚非,2,李洪軍,2*
1(西南大學 食品科學學院,重慶,400715) 2(西南大學 重慶市特色食品工程技術研究中心,重慶,400715)
谷氨酰胺轉氨酶(Transglutaminase,EC2.3.2.13,簡稱TGase或TG),又名轉谷氨酰胺酶,可以通過催化酰基轉移反應使蛋白質分子中谷氨酰胺殘基和伯胺類物質發生交聯[1],因其安全無毒且催化得到的蛋白質產物可以被人體消化吸收,所以在食品行業中被廣泛用來修飾蛋白質[2],可以使蛋白質發生分子間或分子內交聯或使蛋白質發生脫酰胺以及糖基化,從而改善食品的理化和功能性質。該酶來源較廣,在動植物和微生物中均有發現,相比于動植物來源,微生物源谷氨酰胺轉氨酶(microbialtransglutaminase,MTGase)產量較高、價格適中,最關鍵的是具有較優的酶學特性,如反應最適pH范圍廣、耐熱性強、催化活性不依賴Ca2+、受酶抑制劑和金屬離子的影響小、底物特異性低等優點[3]而備受關注。
目前,國內對MTGase的應用研究較多,但是缺乏對該酶活性位點和作用機理的系統性總結。該文以此為出發點,通過查閱近年的文獻資料,概述了MTGase催化蛋白質交聯、脫酰胺和糖基化的作用機理,介紹了其在食品工業中的最新應用,以期對該酶的后續研究和應用提供理論依據。
1 微生物源谷氨酰胺轉氨酶
1.1 MTGase的性質
1989年ANDO等[3]從5 000株來自土壤環境的微生物群落中篩選出一株鏈輪絲菌StreptoverticilliumS-8112可以產MTGase,該酶分子量為37 863,等電點為 8.9,最適pH值為5~7,最適反應溫度為50℃,除了Zn2+、pb2+和Cu2+會抑制其活性外,不受其他金屬離子的干擾,在酶抑制劑方面,乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)和苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)對其活性無影響,氯汞苯甲酸酯(parachloro-mercuri-benzoate, PCMB)、N-乙基順丁烯二酰亞胺(N-ethylmaleimide, NEM)和碘乙酸(monoiodoacetate, MIA)會抑制其部分活性,但與來源于豚鼠肝臟的谷氨酰胺轉氨酶(GTGase)相比,MTGase受到的抑制作用較小。隨后又陸續發現了茂源鏈霉菌(Streptoverticilliummobaraense)[4],放線菌(Actinomadurasp.T2)[5],環狀芽孢桿菌(BacilluscirculansBL32)[6],吸水鏈霉菌(Streptomyceshygroscopicus)[7],枯草芽孢桿菌(Bacillussubtilis)[8],多頭絨泡菌(Physarumpolycephahum)[9]等均為產酶菌株。需要注意的是,鏈霉菌最初分泌的是谷氨酰胺轉氨酶酶原,酶原的N-末端結構是α-螺旋,該結構占據了活性位點導致底物無法接觸到活性中心,所以酶原不具備催化能力,只有當N-末端的螺旋結構被內源性金屬蛋白酶和三肽氨基肽酶裂解解離后才活化成為具有催化活性的轉谷氨酰胺酶[10],如表1[3-9,11]所示的不同微生物來源和動物來源的MTGase的性質對比。
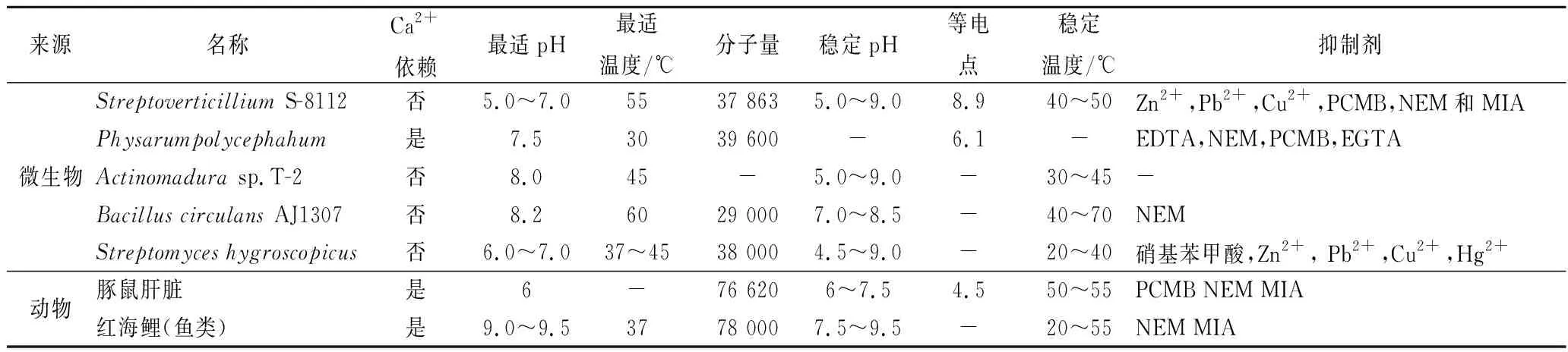
表1 不同來源MTGase的性質Table 1 Properties of MTGase from different sources
1.2 MTGase結構
MTGase的一級結構是由331個氨基酸殘基組成的一條多肽鏈,其氨基酸序列與GTGase的序列完全不同,表明兩者沒有序列同源性。二級結構顯示MTGase屬于α+β折疊類酶,有11個α螺旋和8個β-折疊,多分布于多肽的N-末端與C-末端。該酶的晶體結構是一個單一緊湊的結構域,折疊成板狀,分子邊緣有裂縫,活性位點位于由兩個螺旋形成的16?的裂縫底部。MTGase的催化活性位點是由3個氨基酸組成的三聯體結構,即Cys64-His274-Asp255,當利用突變手段將Asp255換成Ala,則酶的活性會大幅度下降,證明Asp255殘基在酶催化過程中發揮重要作用,推測Asp255的主要作用是使活性位點的半胱氨酸硫醇去質子化,這也是大部分半胱氨酸蛋白酶催化反應的第一步。而同樣利用突變技術測試His274則發現酶活只下降了50%,說明在MTGase中His274對催化效力影響較少,推測其主要作用是利用自身的親核性與Asp255形成氫鍵以維護酶活性中心的穩定性。除此之外在活性中心表面還有很多的酸性氨基酸和芳香族氨基酸如Trp和Tyr,這些氨基酸影響了酶對底物的特異性結合。由于活性中心呈現環狀結構,其可伸縮性減少了酶與底物之間的位阻,大大提高反應速率,降低了與底物特異性結合[12-13]。在對比動物來源和微生物來源的谷氨酰胺轉氨酶的結構時發現,動物性谷氨酰胺轉氨酶的活性位點被Cys殘基上的Sγ原子和Try殘基上的Oη原子組成的氫鍵覆蓋,只有當底物中存在Ca2+,才能使酶的構象發生變化,Try殘基從催化位點被釋放,暴露活性位點以進行催化反應,而MTGase的Cys64充分暴露在溶劑中,所以不需要Ca2+,且反應迅速[14]。
1.3 MTGase的催化機理
MTGase可以催化酰基轉移反應,其中酰基供體是肽鏈上谷氨酰胺殘基的γ-甲酰胺基,受體分為兩類:氨基底物和水。氨基底物是指帶有伯胺的物質,如蛋白質、多聚物、小分子物質、核酸和功能性碳水化合物等;當底物中沒有胺基時,水分子作為底物[15],下面根據受體來源介紹在食品中經常發生的3種反應:蛋白質交聯、脫酰胺和糖基化反應。
(1)當底物是肽鏈賴氨酸殘基上的ε-氨基時,則肽鏈或蛋白質之間通過形成ε-(γ-谷氨基)賴氨酸異肽鍵(G-L鍵)實現分子間或分子內交聯,形成穩定的蛋白網狀結構,這些高分子蛋白質多胺進一步綴合產生大分子聚合物(106~107g/mol),會改變蛋白質的結構和功能性質[16],引入限制性氨基酸,在食品中應用廣泛。目前關于兩個大分子蛋白怎樣對抗空間位阻,從而靠近MTGase酶的活性位點形成交聯鍵的機制尚不明確,但是實驗表明只有具有相同熱力學相容性的兩種蛋白才更容易發生交聯,即極性不同的蛋白不易交聯,可能是因為熱力學相容性不同的蛋白質無法同時到達酶的活性中心而影響催化反應的進行[17]。關于反應具體步驟有一種假設,分為下列四步:①MTGase的活性中心Cys64的硫醇與酰基供體,即谷氨酰胺殘基側鏈發生親核加成反應,供體側鏈上的碳氧雙鍵打開,與Cys64相連。②活性中心的Asp255將其質子轉移到①中形成的含氧陰離子中間體上從而釋放胺。③酰基受體,如賴氨酸側鏈的ε-氨基接近活性中心,帶負電荷的Asp255攻擊酰基受體上的質子。④最后賴氨酸殘基側鏈和谷氨酰胺殘基側鏈上的含氧陰離子中間體形成交聯產物,并與酶脫離[14]。該反應是3種反應中優先進行的,它會一直持續進行直到底物中沒有更多的谷氨酰胺和賴氨酸[18]。
(2)當底物中沒有氨基時,水成為酰基受體。MTGase水解谷氨酰胺殘基的γ-甲酰胺基,發生脫酰胺反應,轉化為谷氨酸,該反應會改變蛋白質的等電點和溶解度。目前有一種假說將在食品中添加的MTGase所引起的脫酰胺作用與脂瀉病發病率升高聯系在一起,雖然沒有更進一步的證據,但也應該引起重視[19]。實際上相比于哺乳動物體內的轉谷氨酰胺酶來說,MTGase的脫酰胺作用較慢,原因可能是MTGase的活性中心上的Asp255所帶的負電荷無法吸引中性基團水分子,而脫酰胺作用中的限速步驟恰好是水分子與活性中心的親核反應,也可能是兩種酶活性中心的His的位置相反,在脫酰胺時起了不同的作用,還可能是不同的酶分子量導致了脫酰胺反應活性的差異,但對此沒有明確的結論[20]。所以對于MTGase來說,催化蛋白質交聯是最快的反應。
(3)當反應(1)中的賴氨酸殘基被其他基團替代,則可將該基團與蛋白質通過共價鍵交聯在一起,當所連接的基團是糖時,則發生蛋白質的糖基化反應,該反應的性質與(1)相似,即含有伯胺基的糖類作為酰基受體,通過MTGase的催化作用與蛋白質結合,該反應的前景在于取代美拉德反應實現蛋白質糖基化[21]。下圖為3種機理反應式。
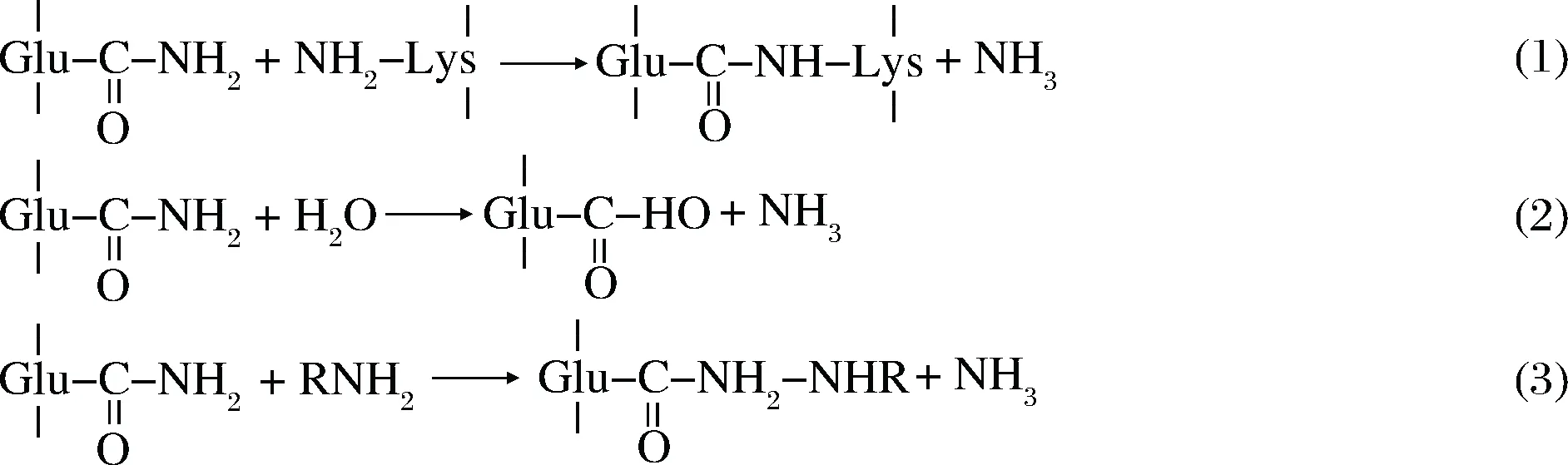
2 微生物源轉谷氨酰胺酶在食品應用中的最新進展
MTGase通過催化交聯,脫酰胺以及糖基化反應來改變蛋白質的諸多營養與功能性質,如凝膠性、乳化性、起泡性、粘度、持水力等,提高產品的口感與質量。事實上機理和底物的不同對蛋白質性質的影響各異,下面分別介紹MTGase 3種催化反應對蛋白質性質的影響。
2.1 蛋白質交聯的應用
2.1.1 交聯反應改善蛋白質凝膠性
凝膠是介于固態和液態之間的中間狀態,由大分子物質通過共價鍵或非共價鍵交聯形成高度有序的三維網狀結構,該結構可以截留水和一些小分子物質,這一性質對于肉制品、奶制品和一些豆制品極為重要,可以有效改善產品的性質。
在肉制品中,MTGase可以通過交聯作用使其中的肌球蛋白重鏈結構發生變化,減少α-螺旋結構,從而提高β-折疊的百分比,有助于形成高分子量聚合物,所形成的強凝膠結構改善了產品的質地特性,如剛性、彈性、內聚力和粘附性,使肉的口感得到改善,近年來利用MTGase改善水豬肉(pale soft exudative meat, PSE)品質的研究逐漸增多[22]。MTGase的催化作用與反應pH和肌球蛋白等電點有密切聯系。HONG等[23]發現在低于豬肌原纖維蛋白等電點(pI=5.0)時,以脫酰胺作用為主,高于5.0時才以交聯作用為主。MTGase對于不同來源的肉制品蛋白的影響是顯著不同的,效果依賴于肌肉和肌纖維種類,所含氨基酸的種類,含量及是否存在酶抑制劑等因素,但是在所有肉制品中,MTGase只對肌球蛋白有影響,對于肌動蛋白的作用效果并不顯著[24]。
在奶制品中MTGase對于κ-酪蛋白的作用是最顯著的。因為其位于酪蛋白膠束表面,更容易接近酶的活性中心,而乳清蛋白則不易被交聯,因為二硫鍵使其球形結構十分穩定,只能通過添加還原劑或預熱使其結構展開,暴露更多的谷氨酰胺和賴氨酸殘基,才能有顯著交聯作用[25]。MTGase主要用于酸奶和奶酪的制作工藝中,可有效提高酸奶凝膠效率和強度,增強其持水力[26],在奶酪中添加可有效保水,增加產量,改變質構和流變學性質,提高口感,尤其在低脂奶酪中廣泛應用[27]。
在豆制品中,MTGase對7Sβ-伴大豆球蛋白的交聯作用比11S球蛋白亞基更好,因為β-伴大豆球蛋白中含有更多的谷氨酰胺和賴氨酸,這些都是MTGase的良好底物,從而有助于形成持久且不可逆的凝膠[28],大豆分離蛋白在MTGase的作用下可以作為輔料添加到重組肉制品和發酵乳飲料中,通過交聯提高重組肉制品的強度、硬度、粘聚性、咀嚼性和彈性。
2.1.2 交聯反應改善蛋白質乳化性
部分食品體系是呈乳濁液的,比如牛奶、醬湯這些屬于水包油體系,即油相分散到水相中,還有泡沫型食品,如冰淇淋和蛋糕,即空氣分散到水相中,在這兩種體系中,蛋白質都是必不可少的表面活性劑。
MTGase提高乳化穩定性的原理與基質有關系,如在面筋蛋白[29]和豬肉肌原纖維蛋白中[30],是交聯作用產生的高分子肽聚集到油滴表面產生靜電排斥,阻止油滴靠近,從而阻止聚集、絮凝和油水兩相分離,提高乳液的穩定性,除此之外,也提高的食品的質地,增加咀嚼性和彈性。而用MTGase處理酪蛋白時發現雖然交聯作用會導致溶解度的降低,但是可能由于蛋白構象變化和負電荷的增加,提高蛋白兩親性質的平衡,有助于在油水兩相形成更富有彈性的蛋白膜,從而增加了乳化穩定性[31]。在沒有面筋蛋白的烘焙產品中,MTGase引起的交聯增加了面團的假塑性和堅硬度,共價鍵的增多也增加了彈性,從而改善產品的咀嚼性[32]。不過除了基底不同外,反應的pH和所加鹽濃度也影響反應效果。
2.1.4 交聯反應改善流體黏度
流體的黏度是由其內部分子間的摩擦阻力和壓差阻力所引起的一種抗流動的性質。溶液中的蛋白質是影響黏度的重要物質之一,蛋白質的分子形狀、大小,與溶劑之間的相互作用,水合后其分子構象變化的靈活度以及流體力學體積的大小均影響流體黏度。濃度越高、分子密度和體積越大、它們之間的相互作用力越強、空間越小,所引起的水流動性越低,因此形成更高的流體黏度。在冰淇淋和酸奶中,黏度是很重要的性質之一,直接影響了產品的質量和口感。
在冰淇淋中,MTGase處理組與空白組相比,其粘度顯著提高,原因是酪蛋白發生交聯形成高分子物質,提高持水力,減少流動性[33],而且隨著碳水化合物(如菊粉中的纖維)和其他蛋白質(大豆分離蛋白,乳清蛋白)進一步參與交聯反應,黏度會越來越大。這一性質對制作低脂肪冰淇淋尤為重要。也許是由于聚合度增加,MTGase處理后的冰淇淋假塑性也有所提高[34]。
在含大量干酪乳清的酸奶中,MTGase通過交聯提高凝膠強度,隨著MTGase的增加,聚合物的分子質量進一步增加,所形成的蛋白網絡結構有效減少水的流動性,從而使最終產品的粘度顯著增加[35]。在MTGase處理時,以β-酪蛋白為底物的酸奶,其粘度上升的速度比以α-酪蛋白作底物的酸奶要快,因為β-酪蛋白的結構松散無序,比α-酪蛋白更容易與酶接觸[36]。
2.2 蛋白質脫酰胺的應用
MTGase的脫酰胺作用雖然比交聯作用慢很多,但是也對食品中蛋白質的溶解性、乳化性和起泡性有所影響。
蛋白質的溶解性取決于分子表面親水基團和疏水基團的數量,親水基團越多,溶解性越高。當然溶液的外在環境也會影響蛋白質溶解性,如離子強度、有機溶劑、pH和溫度等,溶解性又會影響其他性質,如乳化性、起泡性、凝膠性等。MTGase可以提高蛋白質的溶解性,主要機理是脫酰胺作用。如在富含谷氨酰胺和天冬酰胺的蛋白質如大豆蛋白和小麥蛋白中,MTGase可以將其轉化為谷氨酸和天冬氨酸,降低其等電點,從而提高偏酸性食品中蛋白質的溶解性[37]。還有研究發現在不同pH條件下用MTGase處理豬肉肌原纖維蛋白,肌球蛋白在低于其等電點(pI=5)的條件下溶解度增加,在pH為3的時候溶解性顯著提高,其原因是由脫酰胺作用產生的谷氨酸,而且γ-羧基的解離常數在pH=3(Glu-COOH)時比pH>4時(Glu-COO-)大,解離的谷氨酸可以中和質子化的氨基(如Lys-NH3+→Lys-NH2+),減少蛋白質(離子)與水(偶極子)的相互作用[23]。利用MTGase處理豌豆和大豆分離蛋白時,發現脫酰胺作用可以降低蛋白表面疏水性,增加蛋白鏈之間的靜電斥力作用。盡管MTGase會引起蛋白聚合物的形成,但是脫酰胺作用同時增加了蛋白質凈負電荷,促進蛋白質聚合物的解離,提高溶解性[38]。
在起泡性方面,以面筋蛋白和大豆分離蛋白為底物時,MTGase的脫酰胺作用通過降低pH,增加極性基團,當空氣受到擊打或搖晃作用時,蛋白質迅速在水面上展開進而快速吸附在空氣-水界面,從而減少表面張力,增加蛋白質之間的相互作用,提高起泡性和泡沫穩定性[37]。而在乳化性方面,其機理在前文提到,即以大豆分離蛋白作底物,MTGase將其中的谷氨酰胺和天冬酰胺轉化為谷氨酸和天冬氨酸,增加負電荷量,提高蛋白質的兩親性,使其在油水界面形成穩定的液滴,降低表面張力,提高與水結合的能力,從而提高乳化性。
2.3 蛋白質糖基化的應用
蛋白質糖基化修飾是將糖鏈連接到蛋白質分子上,可以改變蛋白質的諸多功能性質。常用的方法是美拉德反應,但是該方法存在反應時間長、溫度高、條件難以控制、產物易褐變、營養流失、形成有毒的終期糖基化產物(AGEs)等問題[39],限制了其在食品工業中的應用。
酶法可以避免上述問題,根據轉谷氨酰胺酶的反應機理,可以將氨基葡萄糖交聯到肽鏈上谷氨酰胺殘基的γ-甲酰胺基上,完成糖基化。
例如表2[40-48]所示MTGase催化糖基化反應在食品中的應用。
通過轉谷氨酰胺酶使蛋白質糖基化,一方面可以改善蛋白質的功能性質;另一方面也產生了新的糖蛋白產物,這些物質具有抗氧化和抗菌的功效,可以作為添加劑添加到其他食品中[49],或作為保健食品的新來源。但是過度的糖基化也會降低蛋白質的消化率,所以對于某些特定反應會提前脫去蛋白的部分谷氨酰胺殘基,防止過度糖基化[50]。
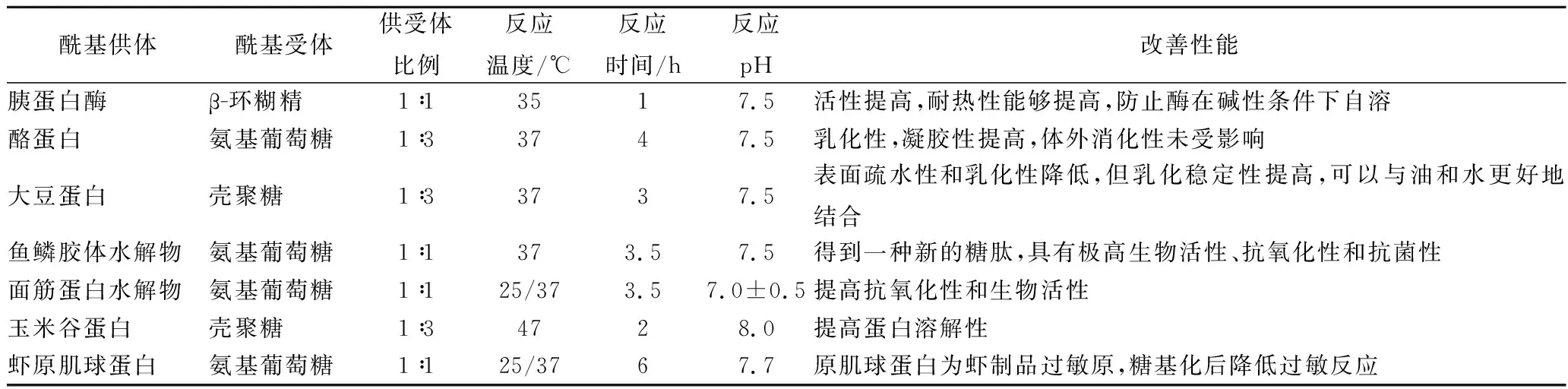
表2 糖基化反應在食品中的應用Table 2 Application of galactosylated modification in the food system
3 展望
微生物轉谷氨酰胺酶不僅在食品領域的應用前景十分廣闊,在醫藥和保健品行業的市場需求也與日俱增。在食品領域,作者推測MTGase未來的發展方向如下:
(1)催化過程的控制有待加強。要進一步探究反應機理,反應底物和反應條件的特異性,避免交聯不足、過度交聯以及產生不均一的產物。
(2)國內市場對MTGase的應用不夠廣泛。應加大對產MTGase菌株的篩選工作,同時利用誘變技術和工程基因提高MTGase酶活,以降低MTGase的生產成本。
(3)加大對MTGase結構的詳細研究。探究其活性位點氨基酸對酶活性的影響,以及與底物結合的作用方式以提高MTGase在食品加工中的精準性。
(4)可以研究與其他技術相結合以提高MTGase的活性和應用范圍。如利用超高壓、超聲波、微波、紫外線等技術處理MTGase,并且優化處理參數。

