鯽腦組織細胞系酵母雙雜交cDNA文庫的構建及初步應用
許 晨,周 勇,史玉恒,范玉頂,劉文枝,江 南,趙建青,曾令兵
(中國水產科學研究院長江水產研究所,武漢430223)
鯉皰疹病毒II型(Cyprinid herpesvirus 2,CyHV-2)[1],又稱為金魚(Carassiusauratusauratus)造血器官壞死癥病毒(goldfish haematopoietic necrosis virus,GFHNV)[2]或皰疹病毒性造血器官壞死癥病毒(herpesviral haematopoietic necrosis virus,HVHNV)[3],與鯉痘瘡病毒(Cyprinid herpesvirus 1,CyHV-1)、錦鯉皰疹病毒(Koi herpesvirus,KHV,CyHV-3)同屬異皰疹病毒科(Alloherpesviridae)鯉皰疹病毒屬(Cyprinivirus)成員[4,5]。鯉皰疹病毒II型可感染各種規格的養殖鯽魚,死亡率高達90%~100%[1,6],給我國鯽魚養殖業造成巨大的經濟損失[7]。目前,圍繞CyHV-2及其引起的鯽造血器官壞死癥已開展流行病學、病原檢測[8,9]、組織病理[10,11]、理化及生物學特性[12]、超微結構形態發生[13]、診斷技術與疫苗[14,15]等研究,但是關于CyHV-2與宿主細胞相互作用分子機制的研究較少。開展CyHV-2與宿主細胞受體相互作用的研究對于闡明CyHV-2的感染機制有重要意義。
目前,研究蛋白質之間相互作用的方法主要有酵母雙雜交技術、免疫共沉淀技術、pull down技術、串聯親和層析技術等[16]。酵母雙雜交技術作為一種高效研究蛋白質間相互作用的方法,不僅可以檢測已知蛋白質之間的相互作用,而且可以篩選與已知蛋白相互作用的未知蛋白,被廣泛用于研究病原與宿主細胞的互作機制[17,18]。已有研究表明,CyHV-2 ORF25編碼蛋白與GiCB細胞孵育后能夠吸附于GiCB細胞表面[19],因此探尋CyHV-2 ORF25的相互作用蛋白,將有助于深入了解病毒與宿主間的相互作用機制。本研究以鯽腦組織細胞GiCB細胞的總RNA為模板,反轉錄合成cDNA,擴增獲得雙鏈cDNA,與載體pGADT7-Rec共轉化酵母菌Y187,構建GiCB細胞酵母雙雜交cDNA文庫,再與表達CyHV-2 ORF25編碼蛋白的誘餌菌雜交,初步篩選得到與CyHV-2 ORF25編碼蛋白相互作用蛋白的陽性菌落。GiCB細胞酵母雙雜交 cDNA 文庫的構建為研究CyHV-2與宿主細胞間的互作機制提供了重要研究工具,也為進一步研究CyHV-2病毒的感染機制奠定基礎。
1 材料與方法
1.1 材料
鯽腦組織細胞系(Gibel carp brain,GiCB)由中國水產科學研究院長江水產研究所建立并保存[20],培養基為含10% 新生牛血清的M199,培養溫度為28 ℃。
菌株與載體酵母Y2HGold和Y187菌株,酵母雙雜交載體pGADT7-Rec、pGBKT7、pGBKT7-lam、pGBKT7-53、pGADT7-T購于Clontech公司。
1.2 方法
1.2.1 GiCB細胞總RNA的提取
待傳代培養的GiCB細胞鋪滿瓶底時(25 cm2,Corning,USA),去除培養液,胰酶消化后離心收集細胞置于液氮中保存備用。采用Trizol法提取GiCB細胞的總RNA。通過紫外分光光度計(260 nm和280 nm)檢測GiCB細胞的總RNA的吸光值、計算其濃度,并用瓊脂糖凝膠電泳對GiCB細胞的總RNA的完整性進行檢驗。
1.2.2 cDNA文庫的構建
1.2.2.1 cDNA合成及純化
參照Clontech公司Make Your Own “Mate & Plate” Library System試劑盒操作步驟,以提取的GiCB細胞總RNA為模板,合成cDNA。利用CHROMA SPINTM-400 Columns試劑盒(Clontech公司)將雙鏈cDNA進行分離與回收,除去小片段的cDNA分子,并用溶解于50 μL的ddH2O。
1.2.2.2 文庫轉化子的收獲
利用限制性內切酶SmaI將pGADT7-Rec載體線性化,并根據Clontech公司Yeast maker Yeast Transformation System 2步驟,將GiCB細胞cDNA和pGADT7-Rec載體共轉化Y187酵母感受態細胞。取150 μL菌液涂布SD/-Leu缺陷性固體培養基上,30 ℃恒溫倒置培養,約3~5 d至酵母菌落出現,收集SD/-Leu培養基上酵母菌,即為GiCB細胞cDNA酵母文庫。
1.2.3 cDNA 文庫的鑒定
1.2.3.1 轉化效率
雙鏈cDNA與載體pGADT7-Rec共轉化酵母菌Y187后,取轉化后的少量菌液分別稀釋一百倍和一千倍,取其中100 μL分別涂布SD/-Leu缺陷性固體培養基上,30 ℃恒溫倒置培養3~5 d,對長出的菌落進行計數,計算轉化效率和文庫滴度,計算公式如下:
轉化效率=培養基上的單克隆數(CFU)×總轉化混合物體積(μL)×稀釋系數/稀釋混合物涂板體積(μL)×轉化質粒質量(μg)
文庫滴度=菌落數×稀釋倍數/涂布菌液體積
1.2.3.2 插入片段
提取GiCB酵母雙雜交cDNA文庫的文庫質粒,轉化至大腸桿菌DH5α,隨機選取若干克隆用引物T7/3′ AD(表1)進行菌落PCR擴增,并利用1.0%的瓊脂糖凝膠電泳進行鑒定,同時送武漢天一輝遠生物科技有限公司測序鑒定。
1.2.4 誘餌菌株pGBKT7-CyHV-2-ORF25(Y2HGold)自激活檢測
將誘餌菌株pGBKT7-CyHV-2-ORF25(Y2HGold)(本實驗室構建)、陰性對照菌株pGBKT7-lam(Y2HGold)(Clontech公司)和陽性對照菌株pGBKT7-53(Y2HGold)×pGADT7-T(Y187)(Clontech公司)分別劃線于SD/-Trp/X-α-Gal、SD/-Trp/Aba+/X-α-Gal、SD/-Leu三種選擇性固體培養基上,觀察其生長情況。
1.2.5 酵母雙雜交文庫的篩選
利用pGBKT7-CyHV-2-ORF25(Y2HGold)誘餌菌株與GiCB酵母雙雜交cDNA文庫進行酵母雙雜交實驗,篩選與CyHV-2 ORF25編碼蛋白互作的細胞受體。將1 mL活化的GiCB酵母cDNA文庫菌和4~5 mL誘餌菌株pGBKT7-CyHV-2-ORF25(Y2HGold)加入含有45 mL 2×YPDA 培養基(含50 μg/mL Kan)的 2 L無菌三角錐瓶中,于30 ℃,30~50 r/min慢速震蕩培養20-24 h。離心收集菌體,并用10 mL 0.5×YPDA(含 50 μg/mL Kan)培養基重懸,取100 μL菌液涂布于雙缺SD/-Trp/-Leu/X-α-Gal/AbA的選擇性固體培養基上,30 ℃恒溫培養箱中倒置培養3-5 d后,將選擇性培養基上的藍色克隆菌落轉移至四缺SD/-Trp/-Leu/-Ade/-His/X-α-Gal/AbA選擇性固體培養基上反復篩選,以確定陽性克隆,并使用引物T7/3′AD(表1),T7/3′BD(表1)進行PCR檢測。

表1 引物序列Tab.1 Primer sequences
2 結果
2.1 GiCB 細胞總RNA提取
用1%的瓊脂糖凝膠電泳檢測由Trizol試劑提取GiCB細胞總RNA,電泳結果可見清晰觀察到28 S和18 S兩條RNA條帶(圖1),其亮度比約2∶1,而5 S RNA條帶亮度較弱,在分光光度計上測試A260 nm/A280 nm的值為1.89,表明提取GiCB細胞總RNA的純度和完整性較好,已達到合成GiCB細胞cDNA的要求。

圖1 GiCB細胞總RNA的瓊脂糖凝膠電泳結果Fig.1 Gel electrophoresis analysis of total RNA from CiCB cells
2.2 cDNA文庫的構建及保存
以GiCB細胞總RNA為模板,合成雙鏈cDNA,覆蓋率從100~3 000 bp,純化回收并去掉小于250 bp的條帶。將雙鏈cDNA與載體pGADT7-Rec混合共轉化至酵母Y187菌株中進行同源重組,獲得GiCB細胞酵母雙雜交cDNA文庫,提取文庫質粒并用甘油對酵母cDNA 文庫進行保存備用。
2.3 文庫質量鑒定
將文庫質粒轉化至大腸桿菌DH5α后,隨機選取單克隆菌落以T7/3′ AD為引物進行擴增,根據PCR擴增結果表明插入片段大部分在1 000 bp以上,平均長度約為1.5 kb(圖2)。將PCR產物測序結果進行BLAST比較,結果顯示,插入片段與鯽魚和鯉魚的基因相似性較高(表2)。
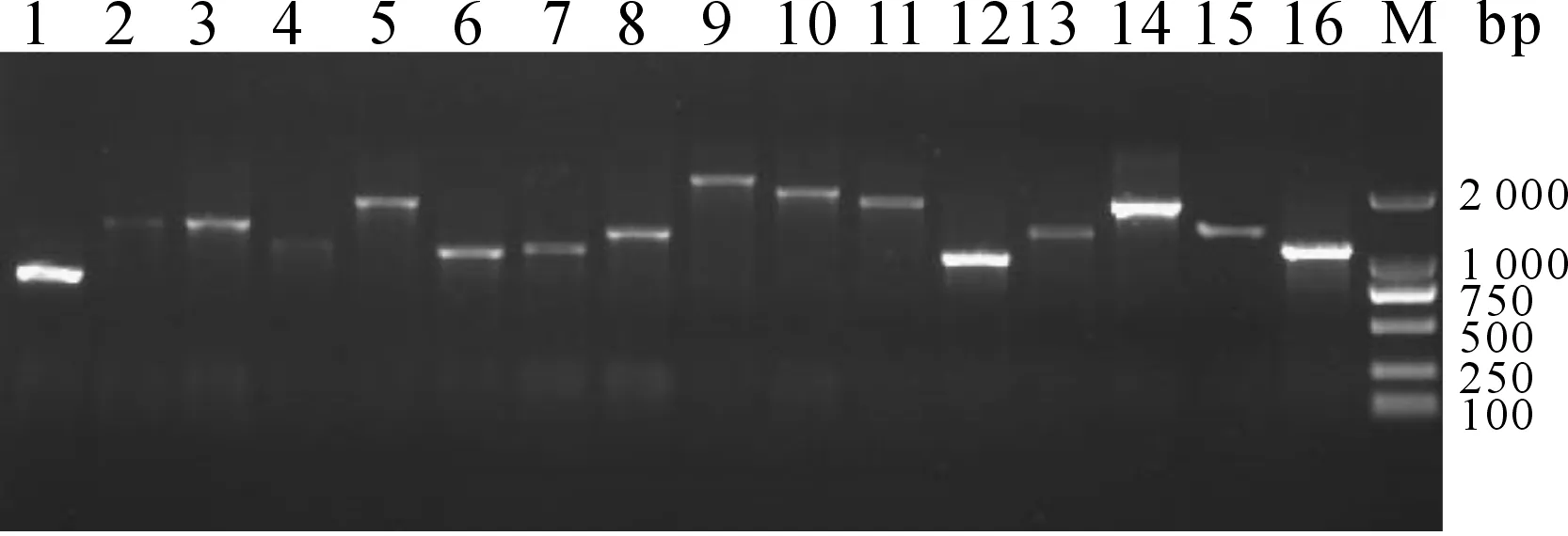
圖2 文庫隨機菌落PCR電泳檢測Fig.2 Electrophoresis of PCR products of random colonies from the libraryM:DL 2000 DNA Marker;1-16:隨機挑取的單克隆

表2 鯽腦組織細胞文庫基因的測序分析Tab.2 Analysis of library gene of GiCB cells
雙鏈cDNA與載體pGADT7-Rec共轉化酵母菌Y187后,取10 μL菌液分別稀釋一百倍和一千倍,然后各取150 μL分別涂布SD/-Leu,對長出的菌落進行計數,稀釋一百倍的SD/-Leu培養基上長出白色菌落1 280個,稀釋一千倍的SD/-Leu培養基上長出白色菌落120個,根據公式計算得出GiCB細胞cDNA文庫轉化酵母菌Y187的效率為1.03×106CFU/μg,GiCB細胞cDNA酵母表達文庫滴度約為1.24×106CFU/mL。
2.4 誘餌菌株自激活檢測
pGBKT7-CyHV-2-ORF25(Y2HGold)菌株在選擇性培養基中的生長結果表明:陰性對照菌株pGBKT7-lam(Y2HGold)和重組菌株pGBKT7-CyHV-2-ORF25(Y2HGold)在SD/-Trp/X-α-Gal選擇性固體培養基上長出白色菌落(圖3A),在其他培養基上無菌落出現(圖3B,C)。陽性對照pGBKT7-53(Y2HGold)×pGADT7-T(Y187)在 SD/-Trp/X-α-Gal、SD/-Trp/Aba+/X-α-Gal、SD/-Leu均長出菌落(圖3A,B,C),且在SD/-Trp/X-α-Gal和SD/-Trp/Aba+/X-α-Gal選擇性固體培養基上菌落呈藍色(圖3A,B)。說明重組菌株無自激活現象,可以進一步進行文庫篩選。

圖3 誘餌表達載體自激活檢測Fig.3 Detection of bait expression vector self-activation
2.5 誘餌蛋白ORF25的候選互作蛋白的篩選
pGBKT7-CyHV-2-ORF25(Y2HGold)誘餌菌株與cDNA文庫進行雜交,分別使用雙缺SD/-Trp/-Leu/X-α-Gal/AbA的選擇性固體培養基(圖4A)和四缺SD/-Trp/-Leu/-Ade/-His/X-α-Gal/AbA選擇性固體培養基(圖4B)反復篩選,最后獲得陽性克隆。分別使用誘餌載體和文庫載體的通用引物對陽性克隆進行PCR檢測并進行測序分析。對測序結果進行分析發現誘餌載體通用引物擴增的片段為ORF25(圖5),文庫載體通用引物擴增的片段中僅有1個cDNA序列的開放閱讀框正確。將該cNDA序列在GenBank數據庫中進行同源性比對分析,發現這一序列編碼蛋白與蛋白激酶C受體1(Receptor of activated protein kinase C1,RACK1)呈高度同源,同源性高達96%。
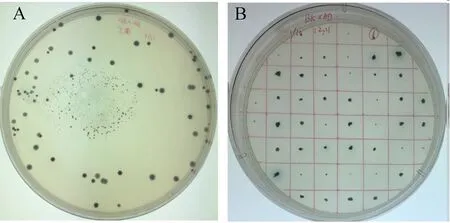
圖4 雜交后的陽性菌株Fig.4 The positive strains after hybridizationA:SD/-Trp/-Leu/X-α-Gal/AbA雙缺固體選擇性培養基,B:SD/-Trp/-Leu/-Ade/-His/X-α-Gal/AbA四缺固體選擇性培養基

圖5 陽性克隆的PCR驗證結果Fig.5 The detection of the positive strain with PCR assayM:DL5000;1:引物T7/3′AD檢測;2:引物T7/3′BD檢測
3 討論
cDNA文庫的質量與總RNA的純度和完整性關系密切[21],真核生物的28 S、18 S rRNA的質量決定了總RNA的完整性。完整性較好的總RNA,其28 S與18 S rRNA的強度比一般為1.5~2.5∶1。本研究提取鯽魚腦細胞系GiCB的總RNA,瓊脂糖凝膠電泳結果顯示28 S與18 S rRNA的比約為2∶1,并且條帶清晰,提取的RNA質量較好,可以用于cDNA文庫的構建。
評價酵母雙雜交cDNA文庫質量好壞的關鍵因素是插入片段的大小和滴度[22]。根據計算,本研究構建的GiCB酵母雙雜交cDNA文庫插入片段的平均長度約為1.5 kb,滴度約為1.24×106CFU/mL,均符合Clontech公司 SMART 文庫構建的要求(原始文庫的庫容大于 1×106CFU)。該酵母雙雜交文庫具有較好的 cDNA 片段多態性和完整性,可用于進一步的文庫篩選。
CyHV-2的ORF25基因屬于ORF25多基因家族,編碼病毒的膜蛋白,含有免疫球蛋白樣結構域,具有較好的免疫原性。已有研究表明酵母表達的ORF25編碼蛋白與GiCB細胞孵育后,感染CyHV-2,病毒滴度顯著降低,進一步研究發現ORF25編碼蛋白可特異性地吸附于GiCB細胞表面[19]。以CyHV-2 ORF25編碼蛋白為誘餌蛋白與cDNA文庫進行雜交,篩選獲得陽性克隆,進一步證實了該文庫的質量和有效性。
將CyHV-2 ORF25編碼蛋白的陽性克隆進行PCR擴增和測序獲得陽性克隆的cDNA序列,將序列在NCBI中Blast比對,發現這一序列編碼蛋白與蛋白激酶C受體1(Receptor of activated protein kinase C1,RACK1)有96%的同源性。RACK1屬于WD40蛋白(色氨酸和天冬氨酸)家族成員,含有7個WD重復序列,分子量為36 kD。1991年,RACK1首次被鑒定為蛋白激酶C(Protein Kinase C,PKC)受體的結合蛋白,RACK1 作為一種穿梭蛋白,可以改變 PKC 定位并發揮其生物學功能[23]。該蛋白參與細胞內多種信號分子的募集、組裝和調控,在細胞的生物學過程中發揮重要功能[24,25]。有研究表明,RACK1能夠作為接頭分子將HIV-1的Nef蛋白與細胞的PKC聚在一起,增強PKC對Nef蛋白的磷酸化[26]。也有研究發現腮腺炎病毒V蛋白通過與RACK1結合,使信號轉導因子和激活因子1(STAT1)從 STAT1、RACK1和IFN受體的復合物上脫落下來,從而抑制干擾素的抗病毒作用。根據CyHV-2 ORF25編碼蛋白與陽性克隆序列間的相互作用推測,CyHV-2 ORF25編碼蛋白可能通過與鯽魚的RACK1結合,調控細胞內的信號通路,以完成病毒的復制。但是關于陽性克隆序列與CyHV-2 ORF25編碼蛋白是如何發生作用仍然需要進一步的驗證及研究。在病毒粒子的組裝、釋放過程中,病毒和宿主間發生了怎樣的相互作用,其具體機制究竟是怎樣的都不清楚,尚需要進一步的研究。對 CyHV-2 ORF25編碼蛋白的互作蛋白和作用機制進行研究,將有助于揭示 CyHV-2的感染機理。
本研究成功構建了GiCB酵母雙雜交cDNA文庫,并利用此文庫篩選到CyHV-2 ORF25編碼蛋白的互作蛋白的陽性菌落,推測CyHV-2 ORF25的互作蛋白可能是細胞受體-蛋白激酶C受體1。GiCB酵母雙雜交 cDNA 文庫的構建為研究CyHV-2與宿主細胞間的互作機制提供了良好的技術平臺,也為進一步研究CyHV-2的感染與致病機理奠定了前期基礎。

