壓力控制反比通氣對腹腔鏡手術患者死腔及炎癥反應的影響
楊 俏,金立民,范 雪,許麗妍,宋雪松
(吉林大學第一醫院 麻醉科,吉林 長春130021)
腹腔鏡手術具有疼痛輕、恢復快、住院時間短等優勢,但與此同時手術時建立的人工氣腹會對機體產生很多負面的影響,同時改變呼吸機制。在氣腹建立后的頭低腳高位使氣道峰壓和平臺壓力增加至少50%,同時也減少了50%的肺順應性[1]。在這種情況下,即使在CO2氣腹終止后肺順應性的降低也無法完全恢復。通過適當的調節呼吸參數,短時間內完成的腹腔鏡手術通常可以避免上述不良影響的產生。然而較長時間和較復雜的腹腔鏡手術越來越多,比如腹腔鏡下胃癌根治術相比之下就需要更長的時間。因此選擇最佳的通氣策略十分重要。國內外目前有關研究中有結論指出,采用反比通氣的模式可以改善患者的呼吸參數[2],但尚未有人對反比通氣的最適比值選擇做出研究,因此本項研究在觀察腹腔鏡下胃癌根治術中根據呼氣流速時間波來個體化調整反比通氣吸呼比(1∶1,1.5∶1和2∶1),探討對患者死腔分數以及術后炎癥反應的影響,為腹腔鏡手術患者選擇最佳通氣策略提供參考。
1 資料與方法
1.1一般資料本研究已獲本院倫理委員會批準,并與患者本人及家屬簽署知情同意書。選取2017年2月-6月吉林大學第一醫院擬行腹腔鏡下胃癌根治術患者60例,年齡在55-75歲,ASAⅠ或Ⅱ級。排除標準:慢性阻塞性肺疾病(COPD),哮喘,氣胸病史,肺部手術史;大量吸煙;肥胖(BMI≥30 kg/m2);ASA分級在Ⅲ級以上的患者以及術前發現低氧飽和度者(SpO2<95%)。
1.2分組方法將納入研究的患者隨機分為3組:容量控制通氣組(VCV),壓力控制參考通氣組(PCV),壓力控制反比通氣組(PC-IRV)。
1.3麻醉方法麻醉誘導:患者入手術室后常規給予心電圖、血壓、脈搏血氧飽和度監測(監護儀Philips IntelliVue MP50),建立有創動脈血壓監測,并用麻醉深度檢測儀(Narcotrend-Compact)監測麻醉深度。麻醉誘導應用丙泊酚1.5-2 mg/kg或依托咪酯0.2-0.3 mg/kg、芬太尼3-5 μg/kg、順式阿曲庫銨0.15 mg/kg。麻醉維持:麻醉維持應用丙泊酚4-6 mg/kg/h,瑞芬太尼0.1-0.3 μg/kg/min,間斷給予肌松藥。麻醉深度維持在40-60之間,術畢所有患者均拔管后送入蘇醒室。
1.4機械通氣所有患者在麻醉誘導后均采用容量控制通氣模式,潮氣量6-8 ml/kg(理想體重),呼吸頻率10-12次/分,吸呼比設為1∶2,FIO2設置為0.4-0.6,PEEP設置為4 cmH2O。術中保持組間手術床傾斜角度基本相同(30-45度)。氣腹建立并且頭低腳高位后根據實驗分組調整通氣模式。PC-IRV組根據麻醉機的流速時間波調整吸呼比為2∶1,1.5∶1和1∶1,即下一個吸氣開始位于前次呼氣波轉折點與預計到達基線點的中點。術中其他通氣參數不變,根據ETCO2調整其呼吸頻率,使其在35-45 mmHg的范圍。術中人工CO2氣腹壓11-14 mmHg。術中VCV模式的氣道峰壓(PIP)和PCV、PC-IRV模式的氣道平臺壓(Pplat)大于30 cmH2O或者SpO2低于95%的患者排除研究。術中患者血壓及心率在基礎值±20% 之間,若超出此范圍,給予血管活性藥來維持血流動力學的穩定,并且該患者被排除。
1.5觀察指標在手術開始后調整相應通氣模式,血流動力學穩定后30 min記錄呼吸力學、血流動力學指標,采集動脈血,并根據測量值計算死腔分數,氧合指數(PaO2/FiO2),肺動態順應性(CL =VT/(Pmax-PEEP))[3]。死腔分數根據2010年 Frankenfield DC等研究提出的校正公式進行計算:VD/VT=0.320+0.0106(PaCO2-ETCO2)+0.003 (呼吸頻率,RR) +0.0015 (年齡,Age),充分考慮年齡、呼吸、肌松藥等因素,偏倚更小[4]。觀察術后72 h胸片有無浸潤性改變、肺不張、二次插管發生率等肺部并發癥發生的情況,以及術后1 d、3 d、5 d白細胞計數、降鈣素原(PCT)和超敏C反應蛋白(hs-CRP)等炎性指標。

2 結果
2.1三組患者之間年齡,性別,BMI,手術時間等一般情況比較差異無統計學意義(P>0.05),見表1。
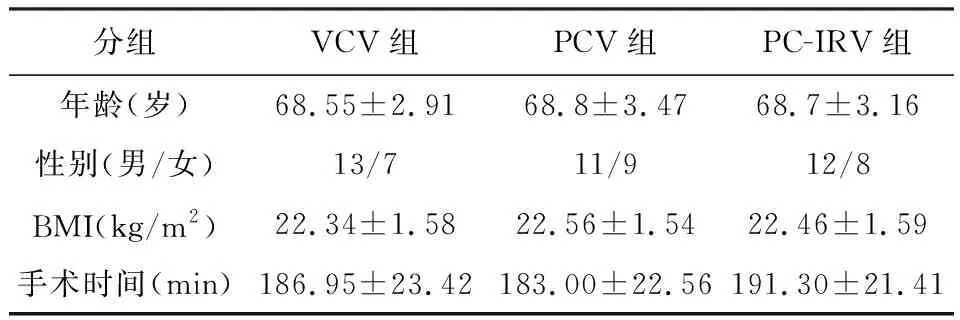
表1 三組患者一般情況比較
2.2三組之間機械通氣參數設置潮氣量,呼吸頻率,吸呼比及PEEP,見表2。其中PC-IRV組吸呼比1∶1的有7例,1.5∶1的8例,2∶1組5例。吸氣平臺階段VCV組為0 s,PCV組為1.7-2 s,PC-IRV組為2.5-4 s。
2.3在三組死腔分數、氧合指數與肺動態順應性性結果及比較,見表3。
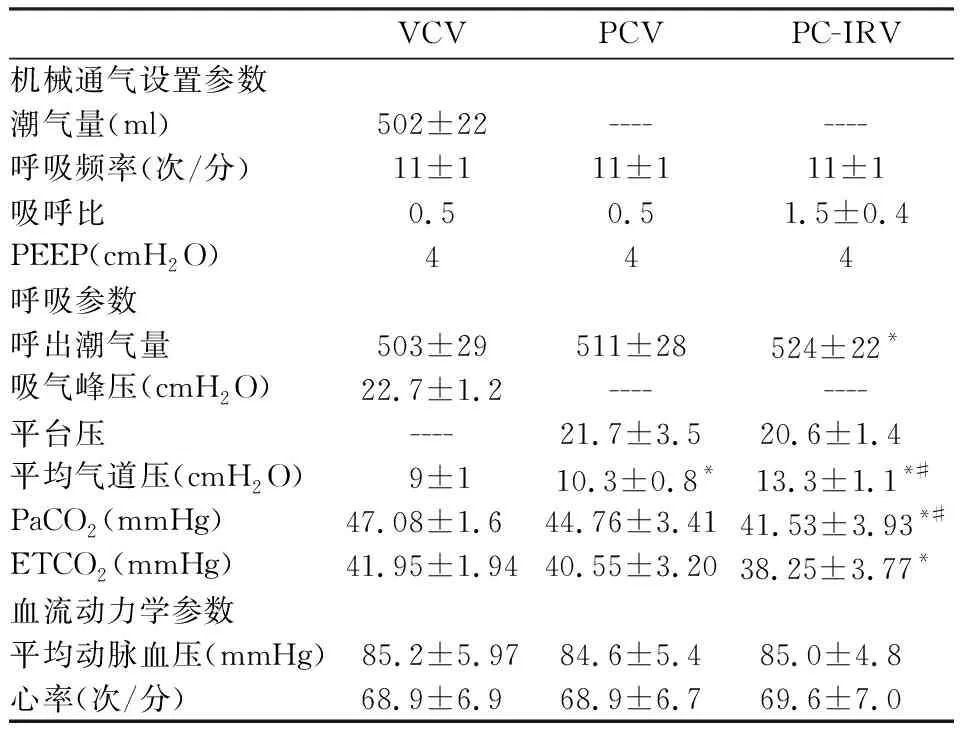
表2 三組患者術中呼吸力學及血流動力學比較
*為與VCV組相比,P<0.05,差異有統計學意義;#為與PCV組相比,P<0.05,差異有統計學意義
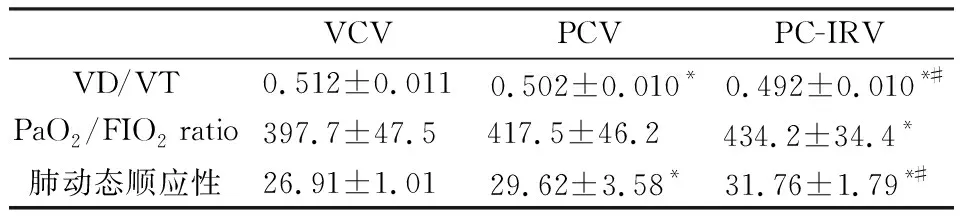
表3 三組患者死腔分數及氧合指數肺動態順應性比較
*為與VCV組相比,P<0.05,差異有統計學意義;#為與PCV組相比,P<0.05,差異有統計學意義
2.4三組術后并發癥相比較60例患者全部治愈,VCV組出現1例術后肺不張,其余患者均未出現術后并發癥。三組術后各時間的白細胞計數,PCT和CRP比較,見表4。

表4 三組患者術后炎癥因子比較
*為與VCV組相比,P<0.05,差異有統計學意義;#為與PCV組相比,P<0.05,差異有統計學意義
3 討論
在進行本項研究后,得出的主要結論是:在進行腹腔鏡手術時,采用壓力控制反比通氣并根據呼氣流速波對患者個體化調整吸呼比,可以降低死分數,改善氧合指數、肺動態順應性,減輕術后炎癥反應,不引起肺部惡性擴張,不影響血流動力學穩定。
根據上述結果,分析PC-IRV模式降低死腔分數的原因主要有:(1)PC-IRV通氣模式與其他兩種通氣模式相比,氣道死腔減少[5],在三種機械通氣的模式中,吸氣相的時長是不同的,吸氣高流速和延長吸氣時間有利于氣體在氣道內的擴散,減少了氣道死腔。(2)PC-IRV模式改善了分流死腔,明顯的減少了動脈血二氧化碳分壓和肺泡內二氧化碳分壓的差值。PC-IRV通氣模式的高流速吸氣和長吸氣相為二氧化碳提供了足夠時間去從肺毛細血管彌散到肺泡當中[6]。(3)還有一種可能的機制是PC-IRV模式減少了血液分流,PC-IRV模式下肺泡緩慢的持續擴張,增強有效的側枝通氣。此外,很可能是因為PC-IRV通氣模式的呼氣時間相對縮短,這種情況下產生了內源性PEEP,防止了肺泡萎陷[7]。
目前PC-IRV通氣模式多用于ARDS的治療[8],通常吸呼比設置為2∶1到4∶1之間,并未對患者進行個體化的調整,通常造成呼氣時間過短[9]。在肺部健康的患者中,這些通氣設置有可能由于呼氣時間過短而產生很高的內源性PEEP以至于肺泡的過度膨脹[10]。有研究顯示,氣道內疾病,特別是慢性阻塞性肺疾病、炎癥、肌松藥、體位和氣腹都會影響呼氣流速[11]。目前對壓力控制反比通氣策略的研究中常采用2∶1-4∶1的吸呼比,并沒有相關研究根據患者情況進行個體化的調整,因此常造成肺過度充氣和循環抑制[12]。在本研究中,吸呼比根據呼氣流速曲線進行了個體化調整,避免了發生動態的肺過度充氣。
在本研究中,患者在術中均應用了肌松藥且肺部健康,因此呼氣峰流速要比ARDS患者要慢。在嚴重的ARDS患者治療中要求內源性PEEP來防止肺泡的萎陷,因此在本研究中不需要更高的PEEP[13]。因此,在PC-IRV通氣模式中個體化調整吸呼比造成動態肺惡性擴張的風險較低。
對比PCV和VCV通氣模式,PC-IRV模式減少了死腔并且減少了動脈血二氧化碳分壓。已有研究表明常規PCV通氣模式可以顯著降低吸氣壓力峰值[14]。而PC-IRV通氣模式最重要的優勢通過相對較低的潮氣量達到目標動脈血氧分壓和二氧化碳分壓。在很多時候由于患者肥胖、長時間的氣腹和頭低腳高位都可能造成高碳酸血癥。在這種情況發生時,PC-IRV模式是一種可行的替代方式以較小的潮氣量來達到正常的動脈氧合和二氧化碳分壓,同時與VCV組和PCV組相比有較低的氣道峰壓和平臺壓。
炎癥因子可以反應患者的應激反應,是機體急性應激反應后比較敏感的指標,在本研究中測量了白細胞,降鈣素原(PCT),超敏C反應蛋白(CRP)三種指標,提高了敏感性[15],從結果中可以得出:與傳統吸呼比通氣模式相比,PC-IRV通氣模式可以減輕肺泡的機械性損傷,從而減少了炎癥因子的釋放,減輕了術后炎癥反應,減低了術后肺部并發癥發生的風險。但獨立的各項指標特異性較差,無法專一性的反應機體炎癥產生部位,因此只能宏觀反應機體整體炎癥水平的變化,而機體全身炎癥水平與手術時長、手術操作、患者自身體條件等均有關[16],并且在本實驗中,由于實際情況,只觀察了術后72 h胸片有無浸潤性改變、肺不張、二次插管發生率等肺部并發癥發生的情況,在該時刻只觀測到了VCV組有1例術后肺不張的發生,后續幾天無輔助檢查證據,因此可能有患者存在術后并發癥但未被記錄,因此導致3組術后肺部并發癥幾乎無差別,但炎癥因子計數相差較大的結果,這也是本項研究的不足之處,在接下來的研究中,還應細化觀察的指標,為研究提供更加明確的理論支持。
除此之外,在本實驗中仍有不足之處,我們調整吸呼比是從2∶1,1.5∶1,1∶1,這三種比率中選擇,通過觀察呼氣流速時間波,使吸氣開始點位于呼氣返回線折點與與預測返回零點之間的中點上。通過人為目測觀察來調整,有一定的誤差,最好是用麻醉機可以通過對呼氣流量波監測并進行自動分析,對呼氣的起始點進行優化,并對吸呼比進行優化。但是目前沒有麻醉機帶有這個功能,因此需要進一步的研究來開發一種方法,以確定每個病人最適宜的吸呼比,并將此方法應用于臨床麻醉的實踐中。

