槜李葉片DNA提取方法探討
李白,李軍,王蕾,種高軍*
(1.嘉興市農業科學研究院,浙江 嘉興 314016; 2.嘉興職業技術學院 農業與環境分院,浙江 嘉興 314036)
槜李是薔薇科(Rosaceae)李屬(PrunusL.)植物中栽培中國李(PrunussalicinaLindl.)的一個品種群,原產于浙江省嘉興市,桐鄉槜李于2011年獲農產品地理標志保護登記[1]。槜李果實熟透后果肉化成漿液,有酒香味,品質上乘,經濟價值高[2]。提取高質量的植物基因組 DNA 是有效開展分子育種、品種鑒定、基因功能研究等分子生物學研究的前提[3-4]。槜李為多年生木本植物,體內富含酚類、色素、多糖等物質,這給其DNA提取帶來困難,其中多糖污染是DNA提取中最常遇到的問題[4-7]。多糖污染的DNA較黏稠,呈膠狀,不利實驗操作,且多糖對后續分子生物學反應體系中的酶活性可能產生抑制作用,影響下游研究[5,7-8]。常規的 DNA 提取方法不能有效除去多糖,提取木本果樹DNA質量較差[4,9]。經典的CsCl梯度離心能有效除去木本果樹的多糖,獲得的DNA純度高,但CsCl梯度離心設備費用高昂,操作不便,且DNA得率低,應用范圍有限。隨著分子標記等分子生物學技術的發展,實驗樣品數量快速增長,DNA提取方法應考慮對實驗人員與環境的安全,并適用于批量提取大量樣品,且盡量避免使用有害試劑[10-11]。本研究報道了一種適用于槜李葉片高質量基因組DNA提取的方法,為槜李等富含多糖的木本果樹葉片的基因組DNA提取提供了參考。
1 材料與方法
1.1 材料
1.1.1 植物材料
槜李葉片采自浙江省嘉興市農業科學研究院古塘基地果樹園區,采摘后放入冰盒帶回實驗室,置于-86 ℃超低溫冰箱保存。
1.1.2 試劑
CTAB、SDS、PVP、β-巰基乙醇、EDTA、Tris均購于上海生物工程公司,其他試劑為國產分析純。
1.2 方法
1.2.1 槜李葉片DNA常規提取
樣品處理:取0.1 g槜李葉片轉入2 mL離心管中,加入1顆5 mm鋼珠,準備12份,經液氮速凍后用震蕩破碎儀1 000 r·min-1破碎至粉末狀,分4組,每組3管,4組分別用CTAB法、SDS法、高鹽法和硅膠膜法提取DNA。
CTAB法:破碎后加入CTAB提取液(100 mmol·L-1Tris,50 mmol·L-1EDTA,1.5 mol·L-1NaCl,2% CTAB,1% PVP,1% β-巰基乙醇,pH 8.0),65 ℃提取,分別用V(酚)∶V(氯仿)∶V(異戊醇)為25∶24∶1和V(氯仿)∶V(異戊醇)為24∶1的溶液抽提上清,用預冷異戊醇沉淀DNA,70%乙醇漂洗2次,風干后加100 μL TE溶解,-20 ℃保存。
SDS法:破碎后加入SDS提取液(100 mmol·L-1Tris,50 mmol·L-1EDTA,0.5 mol·L-1NaCl,2% SDS,1% PVP,1% β-巰基乙醇,pH 8.0),65 ℃提取,加5 mol·L-1KAc沉淀蛋白等雜質,用預冷異戊醇沉淀DNA,70%乙醇漂洗2次,風干后加100 μL TE溶解,-20 ℃保存。
高鹽法:破碎后加入TPS提取液(100 mmol·L-1Tris,10 mmol·L-1EDTA,1 mol·L-1KCl,1% PVP,1% β-巰基乙醇,pH值8.0),75 ℃提取,上清用預冷異戊醇沉淀DNA,70%乙醇漂洗1次,風干后加100 μL TE溶解,-20 ℃保存。
硅膠膜法:破碎后加入DNA-Silica結合液(100 mmol·L-1NaAc,20 mmol·L-1EDTA,1.5 mol·L-1NaCl,2% CTAB,1% PVP,1% β-巰基乙醇,pH 6.0),65 ℃提取,取上清加入純化柱中(含硅膠膜),靜置片刻,離心后棄廢液,用70%乙醇沖洗2次,風干去乙醇,加100 μL TE溶解,-20 ℃保存備用。
1.2.2 CTAB法純化DNA
硅膠膜法提取DNA濃度較低,不做純化處理。CTAB、SDS、高鹽法凍存DNA各取一管,吸取50 μL,加入4 μL 5 mol·L-1NaCl與6 μL 10% CTAB,混勻后離心,沉淀用體積比3∶1的100 μL TE與5 mol·L-1NaCl混合液重懸,加2體積預冷乙醇沉淀DNA,用70%乙醇漂洗2次,風干后加50 μL TE溶解,-20 ℃保存備用[12]。
2 結果與分析
2.1 常規提取方案比較
DNA條帶電泳如圖1,D值見表1。電泳圖中可以看出,CTAB、SDS和高鹽法提取的DNA存在彌散條帶,點樣孔有雜質,根據D值推測,DNA中可能殘留一些多糖雜質。硅膠膜法提取的DNA條帶亮度低,根據D值推測,DNA濃度較低,可能殘留多糖雜質。
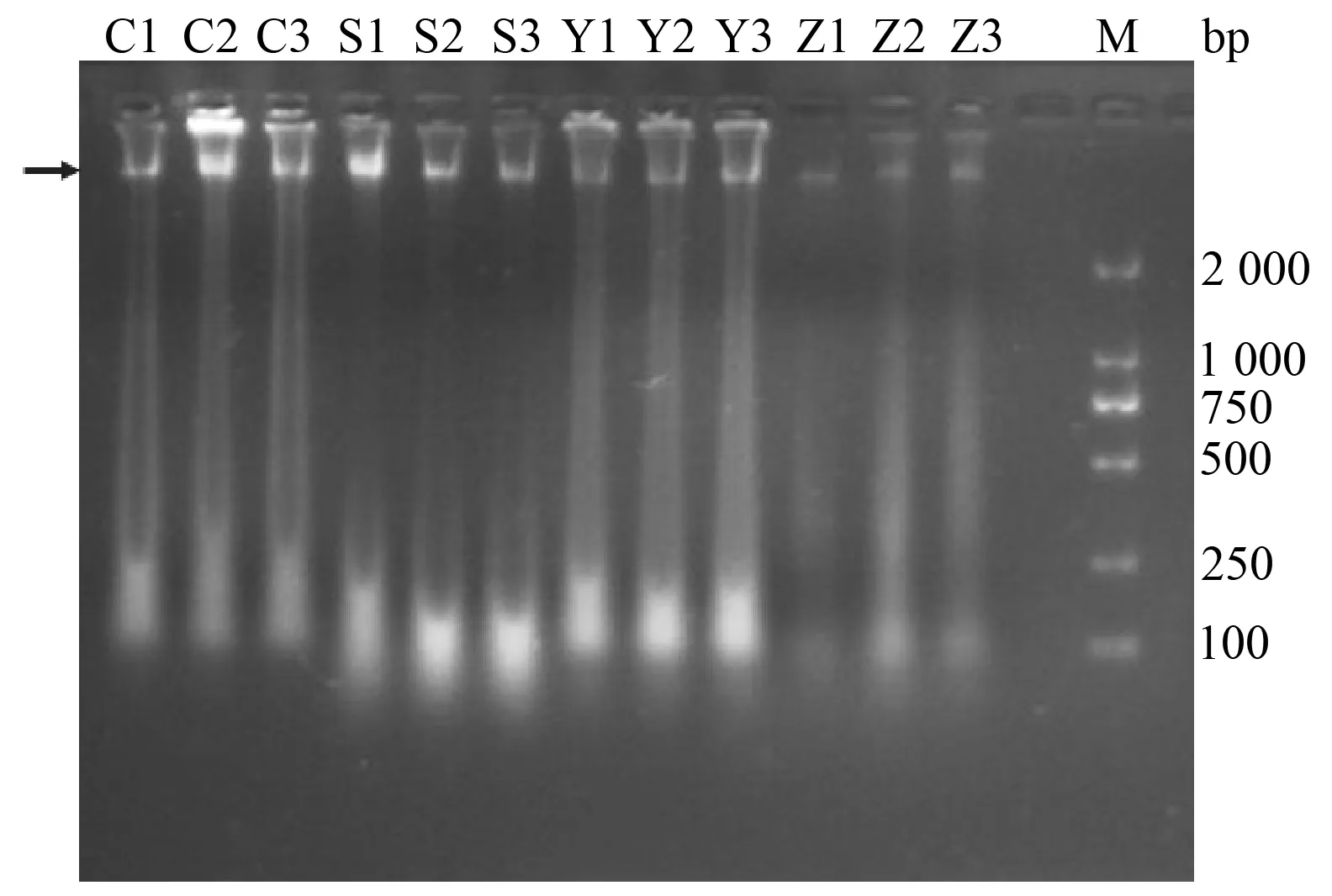
C1~3為CTAB法提取DNA;S1~3為SDS法提取DNA;Y1~3為高鹽法提取DNA;Z1~3為硅膠膜法提取DNA;M為DL2000 DNA 分子量標準;→為基因組DNA所在位置圖1 CTAB、SDS、高鹽和硅膠膜法提取 DNA電泳結果

樣品濃度/(ng·μL-1)D260/D280D260/D230C1373.1±336.12.10±1.211.86±0.27S1122.9±158.22.13±0.311.66±0.39Y2739.1±256.51.98±0.511.49±0.23Z139.4±13.11.79±0.150.87±0.23
注:C、S、Y、Z分別為CTAB法、SDS法、高鹽法、硅膠膜法提取的DNA。
2.2 CTAB純化效果
純化后的DNA條帶如圖2,D值見表2。圖中可以看出,CTAB、SDS和高鹽法提取的DNA經CTAB法純化后,RNA、彌散帶和點樣孔雜質均不同程度減少,根據D值推測,DNA濃度有所降低,這一方面是純化的損失,另一方面可能是多糖雜等雜質的減少,這些雜質原本具有一定的吸光值。其中高鹽提取DNA純化后下方彌散帶增加,可能與原樣品雜質含量較高有關。
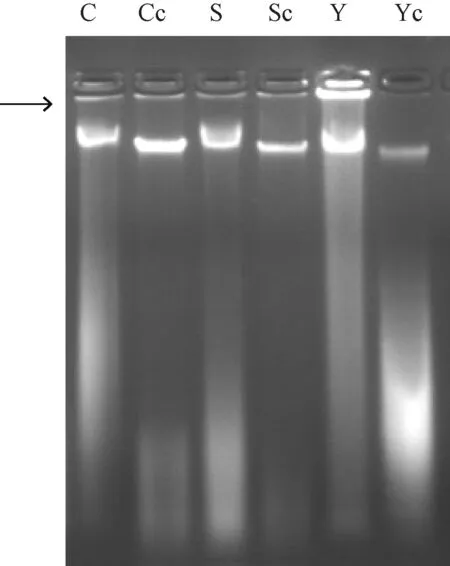
C為CTAB法提取DNA;Cc為C純化后產物;S為SDS法提取DNA;Sc為S純化后產物;Y為高鹽法提取DNA;Yc為Y純化后產物;→為基因組DNA所在位置圖2 CTAB法純化后DNA電泳結果

樣品濃度/(ng·μL-1)D260/D280D260/D230純化前純化后純化前純化后純化前純化后C1 099.5731.62.072.151.802.26S990.9465.42.002.071.342.14Y2 558.21 299.51.902.151.402.29
注:C、S、Y分別為CTAB法、SDS法、高鹽法提取的DNA。
3 討論
本研究分別用CTAB、SDS、高鹽和硅膠膜4種方法提取槜李葉片DNA,通過DNA濃度、純度、電泳條帶和可操作性評價4種方法。結果表明:CTAB法提取DNA基因組DNA條帶完整,有雜帶,殘留一定RNA和多糖雜質,除蛋白過程需氯仿抽提,操作繁瑣;SDS法電泳條帶與CTAB法相似,多糖殘留較CTAB法多,操作較CTAB法簡易;高鹽法濃度最高,操作簡易,但雜質多;硅膠膜法DNA操作簡易,但DNA濃度低,殘留多糖雜質。4種方法提取的槜李葉片DNA均存在不同程度的雜質污染,尤其是多糖雜質,這與前人關于果樹DNA提取結果的分析一致[4,8,11,13]。
CTAB是一種表面活性劑,能裂解細胞,并能與DNA可逆結合,這種作用受鹽濃度影響:當NaCl>1 mol·L-1時,不能形成復合物,DNA呈溶解狀態;當NaCl<0.2 mol·L-1時,DNA與CTAB形成復合物,呈沉淀狀態;當NaCl在0.3~0.4 mol·L-1時,CTAB與單鏈核酸結合效率非常低[14]。從實驗結果看,用CTAB純化的DNA產物,能有效去除RNA、彌散帶和多糖雜質。DNA提取方法中,CTAB法提取基因組DNA質量也較其他方法好,但過程需氯仿抽提,對實驗人員和環境均有危害,且操作繁瑣,抽提取上清時易吸到雜質(圖1,C2泳道),不利于批量提取大量果樹葉片。
高鹽法由高溫裂解、低溫沉淀和乙醇洗滌3個簡單步驟組成,僅需要Tris、EDTA、KCl、異丙醇和乙醇5種常規試劑,操作簡便,常用于批量提取大量水稻基因組DNA,且DNA質量較好,便于后續分子實驗開展,但用于槜李等富含多糖的植物基因組DNA提取,產物中雜質含量高。
在低pH高鹽環境下,DNA的磷酸基團與硅膠膜表面硅烷醇基團之間形成氫鍵,使DNA吸附在硅膠膜表面,硅膠膜法利用這一特點從細胞裂解液中分離出DNA,絕大多數DNA提取試劑盒采用了這種方法[15]。但受硅膠膜數量限制,結合的DNA總量有限,而且硅烷醇基團會受到一些雜質競爭性結合,并與DNA一同洗脫,一方面降低得率,另一方面雜質含量高,本實驗結果也驗證了這點,其中雜質從D值推測主要是多糖。
SDS法用SDS裂解細胞釋放DNA,因KAc、SDS和蛋白質三者在低溫下可形成復合物沉淀,所以用KAc代替氯仿去除蛋白,提取的DNA與CTAB法比較,電泳結果相似,多糖雜質略多,過程未使用有害試劑,操作較CTAB法簡單。由于殘留多糖可用CTAB純化法去除,因此可先用SDS法提取槜李葉片DNA,再用CTAB純化法純化,以獲得高質量基因組DNA。對這種組合提取法可進一步優化,減少操作步驟,更適合批量化提取操作。

