褪黑素調控缺氮脅迫下單針藻中油脂積累的影響
李喜明,趙永騰,余旭亞
(昆明理工大學 生命科學與技術學院,云南 昆明,650500)
化石能源日益短缺,溫室氣體效應日趨嚴重,開發清潔可再生能源成為熱點,環境友好的生物柴油極具潛力[1]。作為制備生物柴油的原料,微藻因光合效率高、環境適應能力強、生長周期短、油脂含量高等特點,成為近些年來的研究熱點[2]。
培養條件和營養成分的改變,尤其在強光照、高溫、營養成分缺乏等脅迫條件下,可直接影響微藻的生長及油脂的合成[3-11]。此外,脅迫條件結合外源添加化學誘導物或植物激素,是有效促進微藻細胞中油脂積累的另一工程策略[4,12]
褪黑素(melatonin,MT)是一種必需氨基酸——色氨酸的衍生物,最初發現于牛松果體中[13-14]。MT作為廣譜的抗氧化劑以及自由基清除劑,可直接淬滅植物中多余的活性氧(ROS),以及通過提高細胞內抗氧酶活性進一步減少氧化應激導致的細胞損傷[15]。非生物脅迫條件下,MT作為調節劑,可以通過調節光合作用和新陳代謝影響植物的生長和糖代謝[14]。WEEDA等[12]的研究結果表明,MT可通過參與細胞中赤霉素(GA)和脫落酸(ABA)的信號轉導途徑,調節植物抗衰老作用。此外,缺氮和高光照脅迫下,MT通過誘導一氧化氮水平調控促分裂素原活化蛋白激酶(MAPK)和環腺苷酸(cAMP)信號通路以激活相關轉錄因子從而促進與蝦青素和油脂合成相關基因的表達,進而提高微藻中次級代謝產物的積累[16];MT也可通過調控信號分子一氧化氮(NO)和水楊酸(SA)的水平來促進雨生紅球藻中蝦青素的積累[17]。MT雖在植物功能調節方面已取得進展,但其對微藻生長及油脂合成的調節作用鮮有報道。
本文研究了MT誘導聯合缺氮脅迫培養對單針藻Monoraphidiumsp. QLY-1的生物量、油脂、碳水化合物、蛋白質以及脂肪酸組成的影響,并考察了MT誘導下相關信號分子與油脂合成的關系。同時,探索了外源添加MT誘導油脂合成相關酶基因的表達與油脂積累的關系,旨在為研究微藻油脂積累提供一定的理論基礎。
1 材料與方法
1.1 材料與試劑
單針藻Monoraphidiumsp. QLY-1篩選、保存于本實驗室;褪黑素、ELISA試劑盒均購于上海生工生物工程有限公司;葡萄糖、三氯甲烷、甲醇均為分析純,購于北京鼎國昌盛生物技術有限公司。
1.2 儀器與設備
TS-2012GZ恒溫(恒濕)振蕩搖床,上海天呈實驗儀器制造有限公司;TDL-40B高速離心機,上海安亭科學儀器廠;FD5-12冷凍干燥機,美國金西盟國際集團中國分公司;SmartSpec plus分光光度儀,上海伯樂生命醫學產品有限公司,ABI-7500熒光定量PCR儀,美國應用生物系統(ABI)公司。
1.3 培養方式
異養培養:以BG-11為基礎培養基,添加10 g/L葡萄糖,黑暗培養。培養溫度(25±1)℃,搖床轉速150 r/min,培養周期10 d。
自養誘導:以缺氮BG-11為基礎培養基并設置為對照組,添加MT至終濃度達到1 μmol/L作為實驗組誘導處理[3],光照100 μmol photons/(m2·s)下培養,培養溫度(25±1)℃,搖床轉速150 r/min。每組設置3個平行。
1.4 生物量和油脂含量的測定
每天離心(3 500 r/min,10 min)收集藻細胞,記錄藻液體積(V,mL),將濕藻體于-80 ℃下過夜后進行真空冷凍干燥至恒重(W,g)。干藻粉(WD,g)∶石英砂(1∶2,質量比)研磨20~30 min,以V(氯仿)∶V(甲醇)=2∶1,作為油脂提取溶劑,油脂提取采用具體操作步驟見ZHAO等[11],并記錄油脂重量(WL,g)。
生物量/(g·L-1)=W/V×10-3
(1)
油脂含量/%=WL/WD×100
(2)
1.5 碳水化合物含量的測定方法
10 mg干藻粉置于15 mL離心管中,加入0.5 mL乙酸,80 ℃水浴20 min,再加入10 mL丙酮于離心管中,3 500 ×g,離心10 min。棄去上清液,收集藻細胞,吸取4 mol/L三氟乙酸2.5 mL重新懸浮,煮沸4 h,10 000 ×g,離心3 min,取100 μL上清液于新試管中,再加入900 μL硫酸(15 mL)∶水(7.5 mL)∶苯酚(0.15 g),煮沸20 min。在490 nm處檢測其波長,根據葡萄糖的含量與OD490nm的關系計算碳水化合物的含量[11]。
1.6 蛋白質含量的測定方法
稱取干藻粉10 mg于試管中,并加入NaOH溶液(1 mol/L)200 μL,80 ℃水浴10 min,加入800 μL蒸餾水,混合離心30 min,12 000×g,并將上清液轉移至新離心管中,重復上述步驟提取2次,合并3次提取液,利用考馬斯亮藍法測定蛋白質的含量[11]。
1.7 內源性植物激素和關鍵酶基因的測定
準確稱取干藻粉0.1 g,按照質量(g)∶體積(mL)=1∶10加入勻漿介質(磷酸緩沖液PBS,0.1 mol/L,pH 7.0~7.4),冰水浴條件下制備成10%的組織勻漿液,3 500×g,離心10 min。取上清液用生理鹽水按1∶9比例稀釋成10%體積分數的組織勻漿進行測定,利用ELISA試劑盒測定植物激素脫落酸ABA和赤霉素GA的含量。
利用Primer 5.0設計出相關酶基因的熒光定量特異性引物。由上海生工合成rbcL、accD、pepc(表1),離心收集第1、第2、第3、第4天的藻細胞于2 mL離心管中,于-80 ℃冰箱保存,Trizol法提取藻細胞的總RNA,由逆轉錄試劑盒合成cDNA。
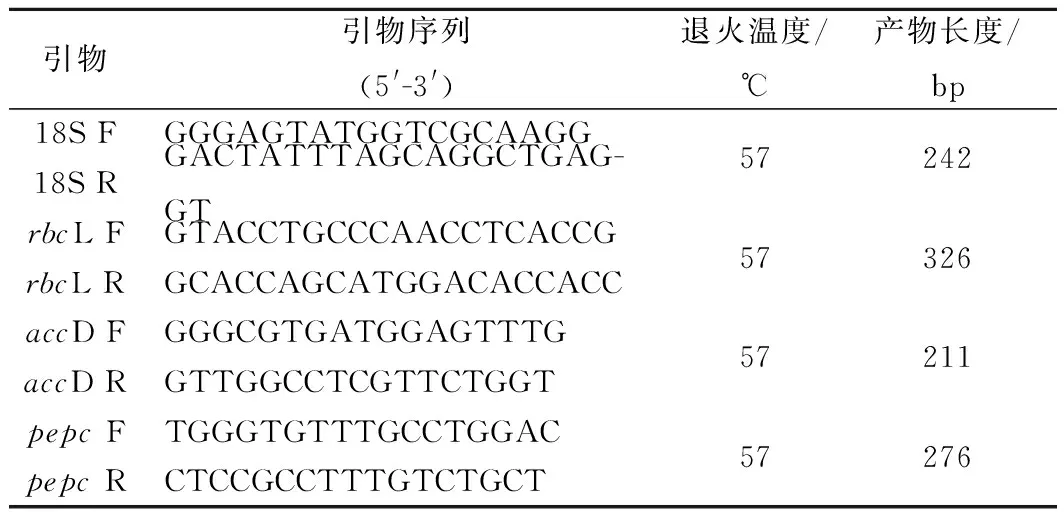
表1 單針藻Monoraphidium sp. QLY-1油脂合成相關酶基因的qRT-PCR引物Table 1 Gene involved in lipid biosynthetic pathway in and their respective primers used in qRT-PCR expression analysis
利用普通PCR實驗初步驗證引物正確性。以cDNA為模板進行熒光定量PCR。梯度稀釋cDNA模板濃度用于制作熒光定量PCR標準曲線,實驗組與對照組的每個樣品各設置3個重復,本實驗采用熒光染料SYBR進行定量,隨著qRT-PCR的進行,SYBR染料與雙鏈DNA結合,其熒光信號由儀器檢測,從而達到定量的目的。熒光定量PCR條件為:預變性95 ℃ 30 s,變性95 ℃ 5 s,退火57 ℃ 30 s,延伸72 ℃ 30 s,循環數35。擴增效率在90%~ 105%,R2>0.990為理想狀態,根據2-△△T法計算各基因的表達量,以此反映各基因的表達水平。
1.8 統計分析
所有實驗數據都是通過ANOVA(SPSS 19.0)一步法分析實驗數據。最小顯著差異進行多重比較,檢驗調查不同實驗的組間差異,且當*P<0.05具有顯著性意義。
2 結果與分析
2.1 缺氮條件下MT對單針藻Monoraphidium sp. QLY-1細胞生長和油脂含量的影響
如圖1-a所示,缺氮條件培養下,微藻生長緩慢,最高生物量為0.89 g/L。MT進行誘導后,最高生物量達到0.95 g/L,高于對照組,低于BG-11培養下的最高生物量(1.121 4 g/L)。這一結果表明添加外源MT可促進微藻在缺氮培養條件下的生長,這可能是由于MT提高了微藻利用細胞內氮源的能力從而維持其在缺氮條件下的生長[4]。
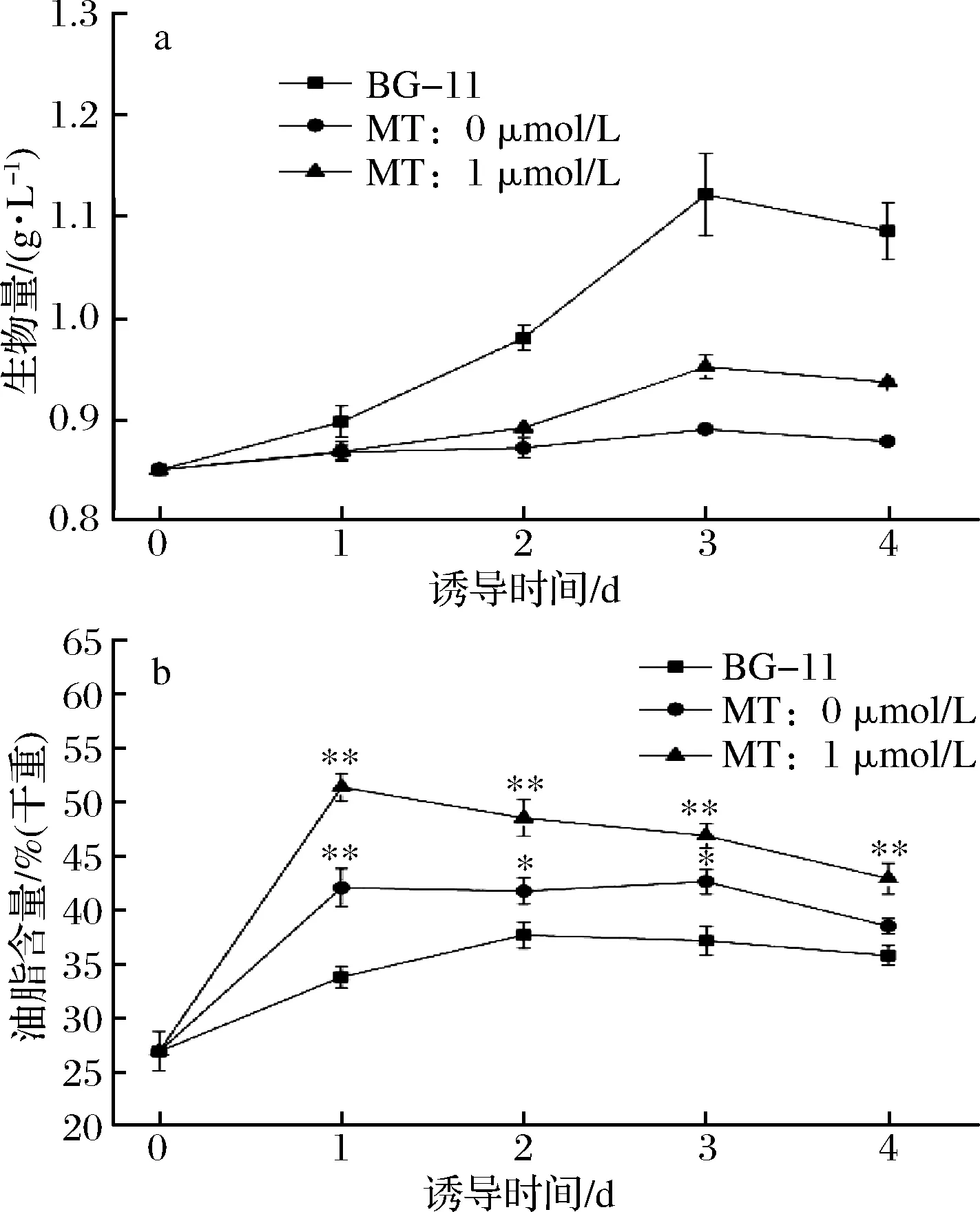
圖1 缺氮條件下MT對單針藻生物量(a)和油脂含量(b)的影響Fig.1 The effect of MT on the biomass production(a) and lipid content (b)of Monoraphidium sp. QLY-1 under the condition of nitrogen deficiency
BABU等[5]報道在小球藻中氮限制條件下聯合吲哚乙酸和胺鮮酯的誘導,微藻的生物量得以提高。這說明在缺氮脅迫或氮限制條件下,添加化學誘導子可有效提高微藻的生物量。
在缺氮條件培養下,微藻中的油脂含量最高為42.06%,高于BG-11培養下的最高油脂含量(33.77%), MT進行誘導后,微藻中的油脂含量比對照組提高了1.22倍(圖1),且高于正常培養條件下褪黑素誘導單針藻的油脂含量(49.6%)[19]。這一結果表明,缺氮脅迫可有效提高微藻中油脂的含量,而MT可進一步促進缺氮條件下微藻中油脂的積累。這可能是因為外源添加的MT會強化微藻中蛋白質、碳水化合物與油脂合成的內在聯系, MT誘導和光誘導的聯合培養,可使微藻中蛋白質和碳水化合物的含量發生改變進而促進油脂的積累[18]。因此,MT誘導缺氮脅迫下單針藻中油脂的積累可能與藻細胞中化合物之間的轉化有關。
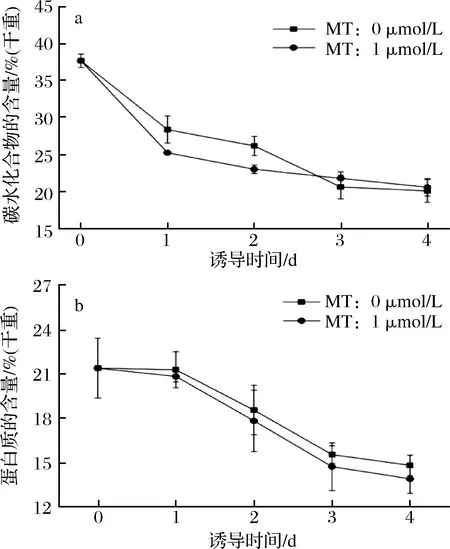
圖2 缺氮條件下MT對單針藻中碳水化合物含量(a)和蛋白質含量(b)的影響Fig.2 The effect of MT on the carbohydrate(a) and protein(b) content of Monoraphidium sp.QLY-1 under the condition of nitrogen deficiency
2.2 缺氮條件下MT對單針藻Monoraphidium sp. QLY-1中碳水化合物含量和蛋白質含量的影響
光合作用中所固定的碳可用于合成油脂,碳水化合物和蛋白質等富含能量的物質。圖2-a顯示,隨著培養時間的延長,對照組與實驗組中微藻碳水化合物的含量呈下降趨勢。而碳水化合物是光合作用的初期產物,缺氮脅迫下碳水化合物含量降低,可能與油脂積累有關;外源添加MT誘導后,碳水化合物含量低于對照組,藻細胞內油脂含量顯著增加。在油脂大量合成階段,單針藻QLY-1細胞內碳水化合物含量顯著降低,這一結果與 MILLER所報道的一致[20]。
在單針藻QLY-1生長過程中,蛋白質的含量呈先穩定再下降的趨勢。異養小球藻接種于自養培養,蛋白質含量在數小時內迅速積累[21]。而在脅迫條件下,如高光照和缺氮,導致Nannochloropsisoceanica蛋白質水平迅速下降[22]。外源添加MT使油脂積累增加,蛋白質大量消耗,導致蛋白質含量降低。CHOKSHI等[6]研究顯示,Acutodesmusdimorphus在缺氮脅迫下,其蛋白質和碳水化合物含量均呈明顯下降趨勢。MT聯合缺氮脅迫條件下,單針藻QLY-1中碳水化合物含量和蛋白質含量可能與油脂合成的復雜代謝過程相關聯,其內在聯系及相關機制值得進一步開展研究。
2.3 缺氮條件下MT對單針藻Monoraphidium sp. QLY-1中植物激素含量的影響
脫落酸ABA和赤霉素GA,是植物和微藻中控制生物脅迫和非生物脅迫的兩種重要的植物激素和生長調節劑[7-9,23]。缺氮脅迫下,微藻中ABA含量在第一天顯著增加,添加外源MT誘導后,ABA含量呈緩慢上升趨勢但低于對照組(圖3-a)。
圖3 缺氮下MT對單針藻中脫落酸ABA(a)和赤霉酸GA(b)含量的影響Fig.3 The effect of MT on abscisic acid (ABA) (a) and gibberellic acid (GA) (b) of Monoraphidium sp.QLY-1 under the condition of nitrogen deficiency
結果表明,MT促進缺氮脅迫下微藻中ABA的分解代謝。SULOCHANA等[9]報道微藻Scenedesmusquadricauda在缺氮條件下,細胞內ABA含量第1天顯著增加。此外,在缺氮脅迫下,GA含量數小時內迅速增加,而后保持在13 μg/L上下,添加外源MT誘導后,GA含量呈上升趨勢(圖3-b)。這一結果表明,MT可促進藻細胞內GA的合成。ZHANG等[8]研究發現,MT的作用主要是通過ABA和GA4的生物合成與分解代謝,從而緩解高鹽脅迫對黃瓜種子萌發的作用。通過MT促進缺氮脅迫下單針藻中油脂的積累,可能與其調控GA合成和ABA分解代謝相關,這一相關效應的分子機制還有待研究和探索。
2.4 缺氮條件下MT對單針藻Monoraphidium sp. QLY-1中與油脂合成相關酶基因表達量的影響
通過上調油脂合成相關酶基因的表達可促進單針藻中油脂的積累[18]。乙酰輔酶A羧化酶(ACC)作為油脂合成第一步中的關鍵酶,催化乙酰輔酶A轉化為丙二酰輔酶A,而accD是編碼乙酰輔酶A羧化酶的異側β單元的一段DNA序列[16,24]。在MT處理下,accD表達水平在誘導第2天和第4天時分別比對照組提高了1.98和1.75倍(圖4),accD表達量的增加與微藻中油脂的積累一致(圖1-b)。黃腐酸誘導條件下,單針藻Monoraphidiumsp. FXY-10中的accD表達與油脂合成呈正相關[18]。此外,外源MT上調了rbcL的表達水平,較對照組提高了1.2倍,且藻細胞生物量出現了相應的增加(圖1-a),外源添加MT可能促進了核酮糖二磷酸羧化酶(RuBisCO)對CO2的固定[24]。
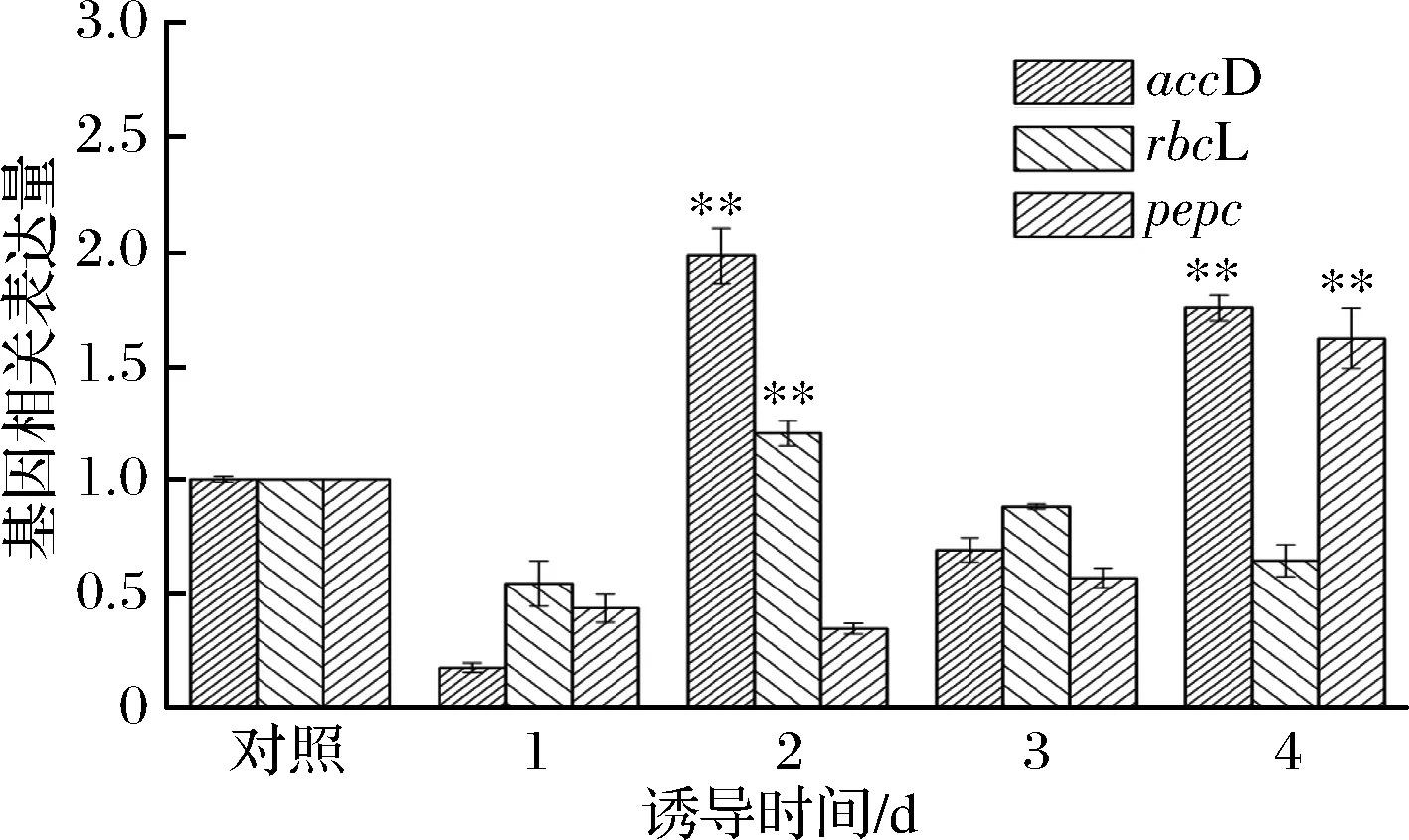
圖4 缺氮下MT對單針藻內基因相關表達量的影響Fig.4 The effect of MT on relative expression level of gene of Monoraphidium sp.QLY-1 under the condition of nitrogen deficiency
磷酸烯醇式丙酮酸羧化酶(PEPC)是油脂積累合成途徑上的另一關鍵酶。缺氮聯合MT誘導下,pepc的表達水平低于對照組,說明MT可能抑制該酶催化磷酸烯醇式丙酮酸向草酰乙酸的轉化,從而使磷酸烯醇式丙酮酸向丙酮方向轉化,此時,accD基因表達量隨之升高,進而促進油脂積累。FAN等[25]研究表明,缺氮脅迫下,微藻中pepc8086的表達水平在生長階段末期增加了1.4倍,而在油脂積累極端呈下調趨勢。綜上,缺氮脅迫下,外源MT促進單針藻中油脂的積累與上調accD、rbcL及下調pepc有關。這與之前李大菲等[19]利用褪黑素誘導單針藻中油脂積累的研究結果一致。
3 結論
本文研究MT聯合缺氮脅迫可以進一步提高單針藻Monoraphidiumsp. QLY-1中的油脂含量,且比單一缺氮脅迫下提高了1.22倍。MT促進微藻中油脂的積累與調控信號分子GA的合成及ABA的降解有關。MT顯著上調了accD和rbcL的表達水平,與微藻中油脂的合成呈正相關,同時下調了pepc的表達量。本研究初步闡明了缺氮聯合MT誘導微藻積累油脂的分子機制,為基因工程改造微藻提供了一定的理論基礎。MT與其他信號分子調控相關轉錄因子,促進缺氮脅迫下微藻油脂積累的相關機制有待進一步研究。

