國內外特殊醫學用途配方食品標準概況及技術指標比對
田洪蕓,解恒杰,王冠群,任雪梅,張海紅
(山東省食品藥品檢驗研究院山東省特殊醫學用途配方食品質量控制工程技術研究中心,濟南250101)
0 引言
特殊醫學用途配方食品是專門針對營養不良重癥和慢性病患者而設計的,臨床使用效果顯示,它能夠為醫院節省費用,較少病患死亡率,同時也能降低住院相關投資,是緩解全球營養不良問題的科學性解決方案,在發達國家已有近百年的使用歷史。特殊醫學用途配方食品在我國起步較晚,上世紀80年以藥品的形式正式進入國內市場,在其后相當長的一段時間內,一直按照藥品進行注冊管理,直至2010年我國才制定相關食品安全標準[1-2]。特殊醫學用途配方食品所體現的“營養醫學、營養治療”理念已成為“健康中國”戰略的重要組成部分,已被納入了國家“十三五”大健康產業中,中國將成為全球最大的消費市場。特殊醫學用途配方食品在世界各國均作為特殊膳食用食品進行管理,CAC、歐盟、美國、日本等國家均建立了比較完善的標準體系[3-4]。本文就相關國際組織和國家的特殊醫學用途標準現狀進行匯總整理,并對標準中的技術指與我國標準進行比對分析。
1 相關國際組織和國家標準現狀
1.1 國際食品法典委員會
全球絕大多數國家的特殊醫學用途配方食品法規都是以CAC標準為基礎建立的,國際食品法典委員會將特殊醫學用途配方食品稱為“特殊醫用食品”,是特殊膳食用食品中的一種。CAC制定了2項標準,一是《特殊醫用食品標簽和聲稱法典標準》(Codex Standard for The Labeling of and Claims For Foods For Special Medical Purpose,CODEX STAN 180-1991),二是《嬰兒配方及特殊醫用嬰兒配方食品標準》(Standard for Infant Formula And Formulas For Special Medical Purpos Intended For Infants,CODEX STAN 72-1981,Amended 2011)。
《特殊醫用食品標簽和聲稱法典標準》規定了特殊醫學用途配方食品的定義,還規定了標簽和聲稱的方式方法。標準規定除在符合《預包裝特殊膳食食品的標簽和聲稱法典通用標準》(CODEX STAN 146-1985)的基礎上,還得滿足本標準的特殊規定,包括對營養標簽、滲透壓、正確使用和儲藏方法等內容的標識方法,并特別強調“應以粗體字顯著標明在醫生指導下使用”。
對于1歲以下人群的特殊醫用食品,CAC在《嬰兒配方及特殊醫用嬰兒配方食品標準》中給出了規定,明確該類產品可以根據適用人群的特殊營養需求在嬰兒配方食品的基礎上對配方進行合理調整,對其可選擇性成分如鉻、鉬的營養含量進行了規定。該類產品營養強化劑的使用要遵守《嬰幼兒特殊膳食用食品中營養物質的參考清單》(CAC/GL10-1979)的規定。對于食品添加劑的使用,CAC明確了可用于特殊醫學用途配方食品中的食品添加劑,但對于1歲以上人群的特殊醫學用途配方食品,CAC尚未制定相應的產品標準。對于營養強化劑,CAC在《嬰幼兒特殊膳食用食品中營養物質的參考清單》中列出了適用于1歲以下人群產品的營養強化劑使用規定[5-6]。
1.2 歐盟
歐盟將特殊醫學用途配方食品作為特殊膳食用食品進行管理,有一套比較完善的管理體系,包括《特殊醫用食品指令》(Dietary foods for special Medical Purpose,1992/21/EC),《可用于特殊營養目的用食品中的營養物質名單》(Substances that may be added for specific nutritional purposes in foods for particular nutritionaluses,2001/15/EC),新物質的申報程序,上市前申報及審批等。
《特殊醫用食品指令》直接引用CAC標準對產品的定義,在標簽標示方面,采納CAC規定。2011年歐盟頒布的《可用于特殊營養目的用食品中的營養物質名單》對可用于特殊醫學用途配方食品的營養強化劑來源做出了規定,包括化合物的來源和使用規定。對于食品添加劑的使用歐盟沒有規定,只需符合食品添加劑通用標準(Food Additive,EC1333/2008)即可。若申請使用新成分/新原料,可根據歐盟《新資源食品、新原料標準》(EC NO258/97)的規定,獲得歐盟食品安全局的批準[7-8]。
1.3 美國
在美國,特殊醫學用途配方食品被稱為醫用食品。美國對于醫用食品的管理相對寬松,只有《醫用食品進口和生產指導手冊》(Compliance Program Guidance Manual 7321.002,Medical Foods Program-Import and Domestic FY06/07/08)1項指導原則。
《醫用食品進口和生產指導手冊》引用聯邦政府法律對醫用食品的定義,明確該類食品用于特殊疾病的飲食管理,必需在醫生的指導下使用,與CAC定義相似;將醫用食品分為全營養配方、非全營養配方、用于1歲以上的代謝紊亂疾病人的配方食品及口服補水產品4類,同時還規定了FSMP的生產、抽樣、檢驗和判定等多項內容[9-10]。對于醫用食品中新成分/新原料的使用,美國規定必需經過GRAS的評估。新產品不需要上市前的注冊和批注,只需生產廠家進行注冊即可。在食品添加劑、營養強化劑、食品標簽標識方面,美國對醫用食品沒有進行特別規定。
1.4 澳大利亞/新西蘭
澳大利亞及新西蘭對特殊醫學用途配方食品的管理較為相似,將適用于嬰兒的特殊醫學用途配方食品與嬰兒配方食品在同一標準中規定,共有2個標準,一是《特殊醫學用途配方食品》(Food for special medical purpose,Standard2,9.5),二是《嬰兒配方食品》(Infant Formula Products,Standard2,9.1)[10-12]。
《特殊醫學用途配方食品》標準規定了產品定義、銷售、營養素含量、標簽標示4部分內容,對于定義澳新基本等同采用Codex的定義,規定1歲以下人群食用產品不屬于該標準范疇,同時標準以附錄的形式明確規定了營養素來源及食用量等。與其他國家標準不同的是,澳新明確經糖尿病及超重人群的配方食品不納入特殊醫學用途配方食品管理。
在標簽標示方面,與Codex、歐盟相似,澳新要求特殊醫學用途配方食品應符合普通食品的標簽外,還必須符合本標準的規定,標識產品的營養成分及含量、滲透壓,在醫生和營養師的指導下使用等信息。對于一些特殊的營養成分,如乳糖、谷蛋白,還規定了對這些成分的特殊標識。對于食品添加劑,澳新沒有針對特殊醫學用途配方食品的特別規定,新成分/新原料的管理與普通食品相同。對于特殊疾病的嬰兒配方食品,澳新納入《嬰兒配方食品管理》中進行管理,并根據不同的醫學狀況分別進行規定[13-14]。
1.5 日本
特殊醫學用途配方食品在日本采取審批制的管理模式。《健康增進法》規定病人用特殊食品上市前需要通過日本厚生省批準。根據此規定,日本制定了病人用特殊食品的審評標準,配方包括了全營養食品、低蛋白質食品、無乳糖食品、除過敏原食品4類,《健康增進法》針對每類食品制定許可標準,許可標準中規定了各類產品中的營養素含量、說明書、標簽[15-16]。
1.6 中國
我國特殊醫學用途配方食品標準制定過程中參考和借鑒了國際食品法典委員會(CAC)、美國、歐盟等國際組織、國家和地區的法律法規和標準,以及國內外權威論著。2010年起,國家先后制定與國際接軌的標準體系;我國特殊醫學用途配方食品標準框架與CAC、美國等國家和組織基本一致,標準對產品定義、原料要求、必需成分、可選擇性成分、標簽標識等內容做出了相應的要求。
2015年《中華人民共和國食品安全法》修訂通過,首次明確將其作為特殊食品實施嚴格監管,明確了其作為食品的法律屬性,同時要求進行配方注冊;2016年3月,《特殊醫學用途配方食品注冊管理辦法》頒布;2018年7月,市場監管局成立特殊食品安全監管司,并規定自2019年1月1日起生產特醫食品需取得注冊證書[17]。除此之外,世界上其他國家(加拿大、新加坡、越南、韓國)以及我國臺灣省相繼制定了特殊醫學用途配方食品標準法規。上述標準大都參考了CAC標準作為指導原則,并在此基礎上進一步明確和細化[18-19]。
2 相關國家和組織技術指標比對
《食品安全國家標準特殊醫學用途嬰兒配方食品》(GB 25593-2010)標準中對原料、感官、微生物限量、食品添加劑和營養強化劑、標簽的要求與《食品安全標準嬰兒配方食品》(GB 10765-2010)、CAC和歐盟的技術指標要求基本一致。但對于必需成分、可選擇成分、污染物限量和真菌毒素限量的技術指標規定,與其他國家略有不同[20-21]。
2.1 必需成分
《食品安全國家標準特殊醫學用途嬰兒配方食品》規定的能量、蛋白質、脂肪和碳水化合物的基本含量范圍參考了CAC的標準值,并我國《食品安全國家標準嬰兒配方食品》中規定基本一致,但美國、加拿大、歐盟的部分營養素限量值與我國略有不同。
2.1.1 蛋白質
相關國際和組織標準中蛋白質的限量要求詳見表1。

表1相關國家和組織法規標準中蛋白質含量限量要求 g/100kcal
對于蛋白質限量要求,CAC和歐盟標準中蛋白質限量要求相同,我國標準中蛋白質指標限量相對與其他組織和國家相對嚴格,美國、加拿大、澳新的標準上限均高于CAC、歐盟和我國標準。
2.1.2 脂肪
相關國際和組織標準中脂肪的限量要求詳見表2。

表2相關國家和組織法規標準中脂肪含量限量要求 g/100kcal
對于脂肪含量限量要求,我國標準中脂肪限量要求均嚴于CAC及其他國家,CAC和歐盟標準中脂肪限量要求相同,美國和加拿大標準中脂肪限量相同。
2.1.3 脂肪酸
相關國家和組織脂肪酸限量要求詳見表3。
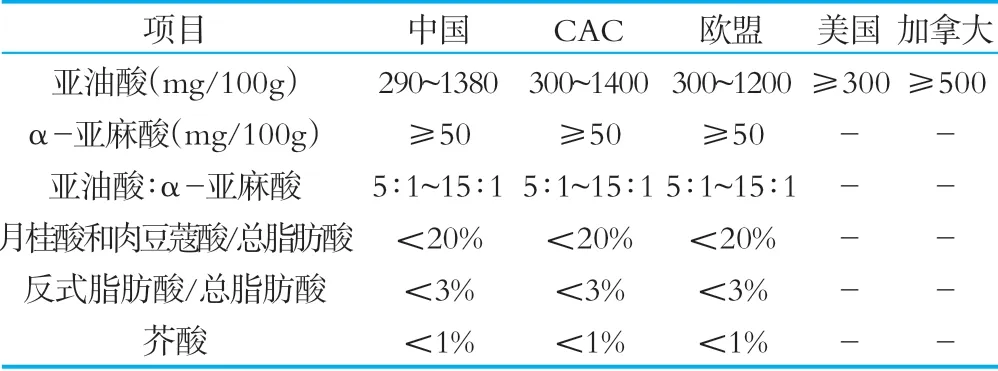
表3相關國家和組織法規標準中脂肪酸限量要求
對于脂肪含量限量要求,我國標準中亞油酸含量下限低于相關國家和組織的規定,對于α-亞麻酸、亞油酸:α-亞麻酸、月桂酸和肉豆蔻酸/總脂肪酸、反式脂肪酸/總脂肪酸和芥酸項目,我國標準與CAC和歐盟限量要求相同,但美國和加拿大對上述指標沒有相關要求。
2.1.4 碳水化合物
相關國家和組織碳水化合物含量限量要求詳見表4。

表4相關國家和組織法規標準中碳水化合物含量限量要求 g/100kcal
對于碳水化合物限量要求,我國標準中碳水化合物的限量要求嚴于CAC和歐盟,美國和加拿大標準中對碳水化合物無限量要求。
2.1.5 維生素
相關國家和組織維生素限量要求,詳見表5。
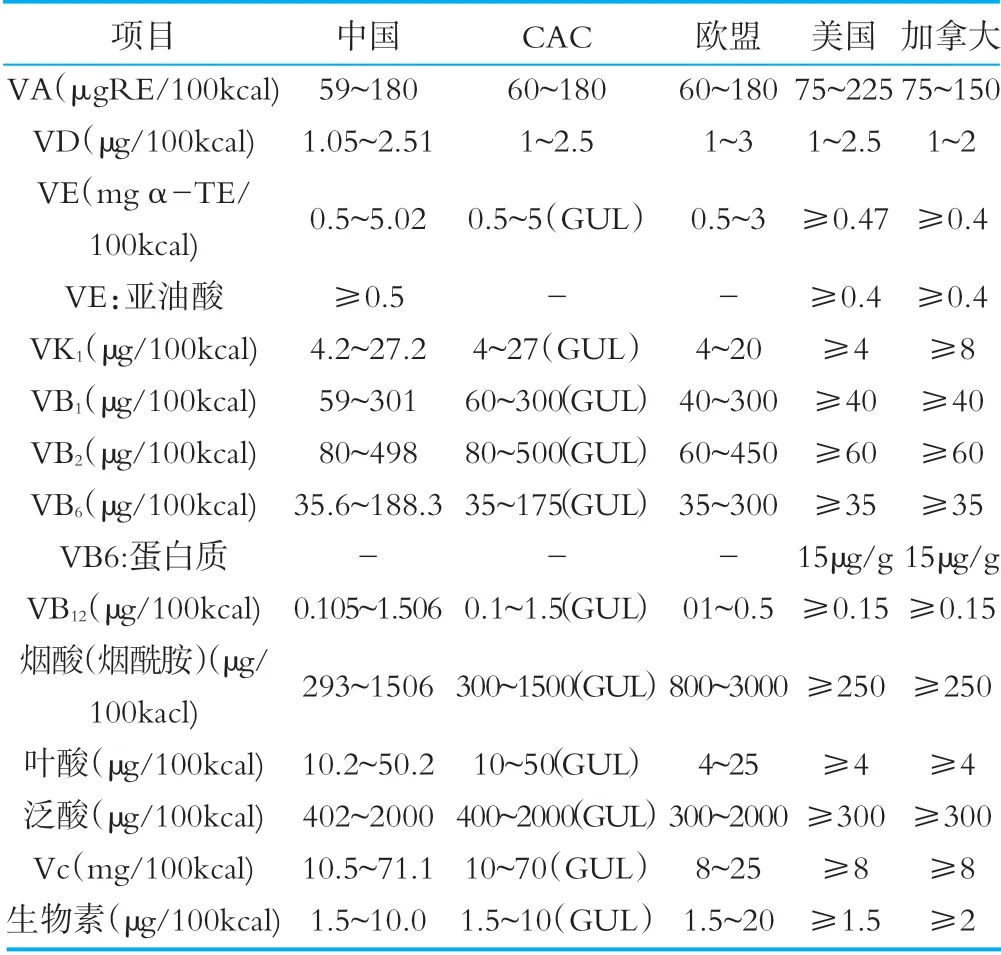
表5相關國家和組織法規標準中維生素限量要求
對于維生素的限量要求,我國與CAC和其他國家的維生素限量略有差異,CAC標準對絕大數維生素均制定了指導上限水平,我國和其他國家標準中均沒有相關規定。對于VE:亞油酸項目,CAC和歐盟沒有限量規定,VB6:蛋白質項目中國、CAC和歐盟無限量規定。
2.1.6 礦物質
相關國家和組織礦物質限量要求詳見表6。
對于礦物質的限量要求,我國的鐵、錳、硒技術指標與其他國家略有不同,我國所有礦物質元素均規定了上限和下限值,CAC標準對部分礦物質元素制定了指導上限水平值。美國和加拿大標準中絕大多數礦物質只規定了下限值。
2.2 可選擇成分
除必需成分外,標準中還規定了可選擇性成分,企業在實際生產中可以選擇性的進行添加。我國和CAC標準中可選性成分的種類和限量要求詳見表7。
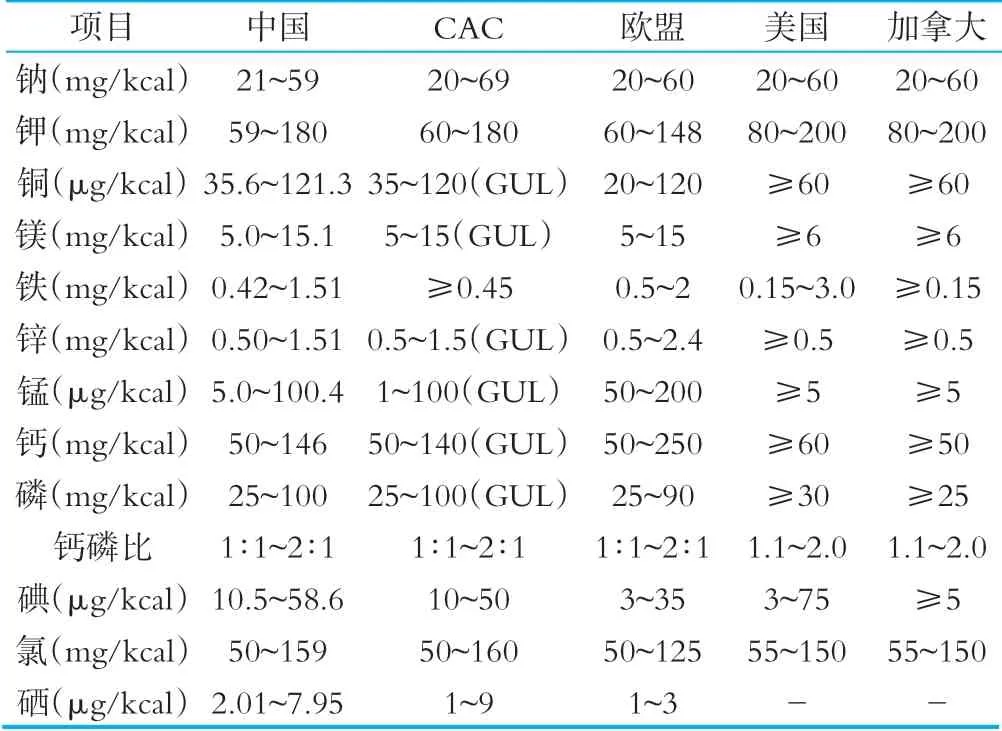
表6相關國家和組織法規標準中礦物質限量要求
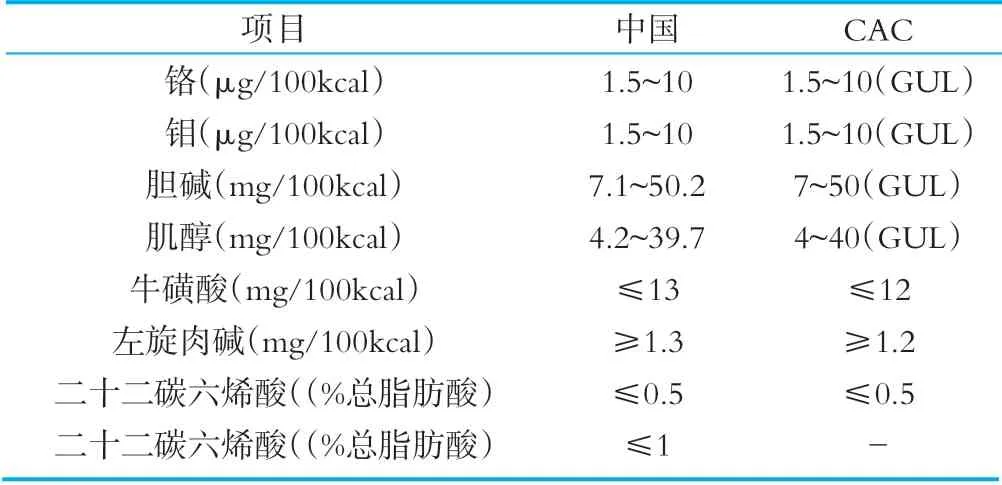
表7相關國家和組織法規標準中可選擇性成分
對于可選擇性成分的種類和限量要求,我國標準和CAC標準中可選擇性成分的種類和限量基本一致,對于二十二碳六烯酸/(%總脂肪酸)項目,CAC標準中沒有限量要求[22-23]。
2.3 污染物限量
目前,我國的食品分類體系尚未列入特殊醫學用途配方食品。《特殊醫學用途嬰兒配方食品》對原料的要求參考了《食品安全國家標準嬰兒配方食品》對鉛、硝酸鹽、亞硝酸鹽作出限量規定,其中鉛的限量為≤0.15 mg/kg。
對比歐盟食品污染物限量標準2015[No.1881/2006(201500)中3.1.4款對特殊醫學用途配方食品中鉛的限量為:≤0.05 mg/kg(粉狀),≤0.01 mg/kg(液狀)。國際食品法典委員會(CAC)標準(CODEX STAN 193-1995)中對特殊醫學用途嬰兒配方食品粉和嬰兒配方粉中鉛的限量為≤0.01 mg/kg。因此,歐盟和CAC鉛的現行技術指標嚴于我國[24-25]。

表8相關國家和組織法規標準中污染物限量要求mg/kg
對于污染物指標,我國標準中僅規定了鉛、錫、硝酸鹽3種污染物的限量要求,歐盟標準中還對鎘、苯丙[a]芘和多環芳烴做出了限量要求。
2.4 真菌毒素
我國相關標準認為嚴格控制原料的質量安全,基本能保證最終產品的安全,我國標準中僅對黃曲霉毒素M 1和黃曲霉毒素B1有限量規定。

表9真菌毒素限量 μg/kg
歐盟標準中對赭曲霉毒素A、展青霉素、脫氧學府鐮刀菌烯醇、玉米赤霉烯酮和伏馬毒素參考嬰幼兒配方食品作出了限量規定[26]。
3 結論
目前,我國特殊醫學用途配方食品相關法規和標準體系已初步完善。與其他國家的管理要求相比,我國對特殊食品實行注冊管理,產品準入門檻相對較高。在標準指標限量要求方面,我國標準中營養指標與CAC、歐盟、美國等標準中絕大多數指標的規定基本一致,在部分指標規定上存在一定差異。對于污染物和真菌毒素的限量,我國標準僅規定了鉛、錫、硝酸鹽、黃曲霉毒素M 1和黃曲霉毒素B1的限量值,與歐盟相關規定有一定的差異。

