隔藥灸對克羅恩病大鼠結腸NLRP3炎癥小體及IL-1b調節作用的實驗研究
張霽,吳麗潔,李志元,張丹,智方圓,楊延婷,,吳丹艷,趙越,李茜瑩,馬曉芃,
?
隔藥灸對克羅恩病大鼠結腸NLRP3炎癥小體及IL-1b調節作用的實驗研究
張霽1,吳麗潔1,李志元2,張丹3,智方圓1,楊延婷1,3,吳丹艷1,趙越1,李茜瑩1,馬曉芃1,3
(1.上海中醫藥大學,上海 201203;2.浙江省中醫院,杭州 310006;3.上海市針灸經絡研究所,上海 200030)
通過觀察隔藥灸對克羅恩病大鼠結腸NLRP3炎癥小體(NLRP3、ASC、Caspase-1)及下游炎癥因子IL-1b表達的影響,探討隔藥灸治療克羅恩病的抗炎機制。將清潔級雄性SD大鼠隨機分為正常組、模型組、隔藥灸組和假灸組4組。采用三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid, TNBS)與乙醇混合溶液灌腸制備大鼠克羅恩病模型。造模成功后,隔藥灸組取天樞(雙)、氣海穴進行隔藥餅灸治療;假灸組取穴、操作同隔藥灸組,但不點燃艾炷。治療結束后,記錄各組大鼠結腸長度及CMDI評分;采用HE染色,光學顯微鏡下觀察各組大鼠結腸組織形態結構,并應用免疫組織化學技術檢測各組大鼠結腸NLRP3、ASC、Caspase-1及IL-1b的表達。與正常組比較,模型組大鼠結腸組織損傷嚴重,表現為裂隙樣潰瘍,炎癥細胞浸潤伴水腫,部分大鼠結腸黏膜可見肉芽組織形成,且結腸NLRP3、ASC、Caspase-1、IL-1b蛋白表達顯著增加(均<0.05);與模型組比較,隔藥灸組大鼠結腸損傷有所修復,炎癥反應減輕,結腸NLRP3、ASC、Caspase-1及IL-1b蛋白表達顯著降低(均<0.05);假灸組大鼠結腸損傷程度、炎癥反應與模型組類似,兩組結腸NLRP3、ASC、Caspase-1、IL-1b表達比較,差異均無統計學意義(>0.05)。隔藥灸能下調克羅恩病大鼠結腸NLRP3、ASC、Caspase-1及IL-1b的蛋白表達,促進結腸炎性損傷的修復。
藥餅灸療法;克羅恩病;NLRP3炎癥小體;間接灸;大鼠
克羅恩病(Crohn’s disease, CD)是一種慢性胃腸道炎性肉芽腫性疾病,可發生于消化道從口腔至肛門的任何部位[1]。臨床癥狀主要包括腹瀉、腹痛、體重減輕、惡心、嘔吐等,在某些情況下可出現發燒或寒戰,多達1/3的患者患有肛周疾病[2]。此外,研究發現多種腸外表現與CD相關,如炎癥性關節炎、葡萄膜炎和虹膜炎、壞疽性膿皮病以及結節性紅斑等[3]。
CD的病因及發病機制尚不明確,目前認為其發病為遺傳、免疫和環境因素等交互作用的結果[3]。相關研究發現,NLR family pyrin domain containing 3 (NLRP3)基因編碼的NLRP3/cryopyrin蛋白是NLRP3炎癥小體的一部分,可與包含CARD結構域的細胞凋亡相關斑點樣接頭蛋白ASC(Apotosis-associated speck-like protein containing a CARD, ASC)結合并招募半胱天冬酶(Caspase-1)使其激活,作為調控IL-1b、IL-18生成和分泌的平臺,參與包括CD在內的多種炎癥性疾病的發病[4]。本課題組前期研究發現,隔藥灸能下調CD大鼠結腸IL-1b的表達,減輕腸道炎癥,改善結腸組織形態結構[4-5]。隔藥灸是否通過調節NLRP3炎癥小體下調IL-1b的表達值得進一步研究。因此,本研究擬建立大鼠CD模型,觀察隔藥灸對CD大鼠結腸NLRP3炎癥小體(NLRP3、ASC、Caspase-1)及下游炎癥因子IL-1b的調節作用,基于NLRP3炎癥小體探討隔藥灸治療克羅恩病的作用機制。
1 材料與方法
1.1 實驗動物
清潔級雄性Sprague-Dawley(SD)大鼠28只,體質量為(150±20)g,由上海斯萊克實驗動物有限責任公司提供[SCXK(滬)2012-0002]。飼養于上海中醫藥大學實驗動物中心,溫度為18~26℃,相對濕度為40%~70%,照明12 h晝夜交替,通風換氣8~12次/h。飼料和飲用水經高壓蒸汽滅菌處理,大鼠自由攝食、飲水,定期更換墊料。適應性飼養3 d,觀察其飲食、活動、體態、背毛等是否健康正常,大鼠無異常后開始實驗。
1.2 主要試劑和儀器
5%(w/v)2,4,6-三硝基苯磺酸(2,4,6-Trinitro- benzenesulfonic-acid, TNBS)(Sigma公司,美國),無水乙醇、戊巴比妥鈉(國藥集團化學試劑有限公司);NLRP3一抗(Abcam公司,英國),ASC一抗(Abcam公司,英國),Caspase-1一抗(Abcam公司,英國),IL- 1b一抗(Abcam公司,英國);Dako REAL EnVision兔鼠通用二抗檢測試劑盒(Dako,丹麥),組織脫水機(Leica公司,德國),組織包埋機(Leica公司,德國),石蠟切片機(Leica公司,德國),石蠟切片水浴缸(Leica公司,德國),烤片臺(Leica公司,德國)。
1.3 模型制備
參照Morris方法[6],將5%(w/v)的TNBS與50%乙醇按照體積比2:1混合成灌腸液。大鼠稱重后,用超純水配制1%戊巴比妥鈉溶液,按照30 mg/kg劑量腹腔注射麻醉。造模開始前24 h禁食不禁水,使用大鼠灌胃器自肛門插入腸道6~8 cm,以3 mL/kg的劑量灌入上述灌腸液,灌腸后保持大鼠倒立位60 s,每7 d進行1次,持續4周。于造模結束時,每組隨機取1只大鼠處死,取其結腸組織做HE染色以檢驗模型成功與否。在驗證模型制備成功的基礎上,進行干預。
1.4 分組與治療
正常組不進行任何處理與治療。
模型組在模型制備成功后,不進行任何治療,只作與隔藥灸組相同的抓取和固定。
隔藥灸組選取天樞(雙)、氣海穴,進行隔藥灸治療,每次每穴各灸2壯(約10 min)。每日1次,共治療7次。藥餅主要成份為附子粉,灸前用黃酒調和,并用動物專用模具制成藥餅;用模具將艾絨壓實制成錐形艾炷,艾炷重量為90 mg,置于藥餅上,點燃艾炷施灸。
假灸組僅做與隔藥灸組相同的固定,并將艾炷及藥餅置于大鼠腹部天樞(雙)、氣海穴上,但不點燃艾炷,每次10 min。每日1次,共7次。
1.5 樣本采集與處理
治療結束后,各組大鼠禁食、不禁水24 h,用1%戊巴比妥鈉,按照30 mg/kg劑量腹腔注射麻醉,腹主動脈取血。沿大鼠腹正中線剪開腹部皮膚,充分暴露直腸、結腸部分,自恥骨聯合處至盲腸取下大鼠整個結腸,并測量結腸長度并記錄數據后,沿腸系膜縱軸剖開,取肛門起向上5~8 cm部分,用4℃冷生理鹽水沖洗,取下結腸段放入4%多聚甲醛溶液內固定24 h。
1.6 觀察指標
1.6.1 結腸長度
測量各大鼠結腸長度,并進行統計分析。
1.6.2 結腸大體形態損傷指數(colon macroscopic damage index, CMDI)
對各組大鼠結腸進行結腸大體損傷評分,該評分包括結腸及周圍組織的黏連程度、潰瘍及炎癥損傷的嚴重程度。無黏連為0分;輕度黏連(結腸與其他組織剝離較易)為1分;重度黏連為2分。無潰瘍及炎癥為0分;局部充血無潰瘍為1分;1處潰瘍不伴出血和腸壁增厚為2分;1處潰瘍伴炎癥為3分;2處潰瘍伴炎癥為4分;>2處潰瘍伴炎癥或炎癥面積>1 cm為5分;潰瘍和(或)炎癥面積2 cm隨病變范圍每增加1 cm,積分增加1分(6~8分)。根據以上評分標準進行評分,并分析統計[7]。
1.6.3 結腸組織形態學觀察
采用蘇木素-伊紅(hematoxylin-eosin, HE)對組織切片進行染色,光學顯微鏡下觀察各組大鼠結腸組織形態學變化。HE染色主要步驟如下,①常規脫蠟水化,切片放入二甲苯Ⅰ、Ⅱ中脫蠟各20 min,梯度乙醇100%、90%、80%、70%各3 min。②雙蒸水沖洗。③核染色,用蘇木素染色約2.5 min后,放入自來水中緩緩沖洗10 min;1%鹽酸乙醇分化2 s,再流水緩緩沖洗 5 min反藍。④伊紅胞質染色,將切片放入0.1%伊紅中染色10 min后,依次經過梯度乙醇70%、80%各1 min, 90%、100%各3 min,根據鏡下顯色調整時間。⑤透明,將切片放入二甲苯Ⅰ、Ⅱ各15 min后,擦去多余液體,中性樹膠封片。
1.6.4 結腸組織NLRP3、ASC、Caspase-1及IL-1b蛋白表達檢測
采用免疫組織化學Envision法檢測。主要步驟如下,①結腸組織石蠟切片(4mm)于60℃恒溫烤箱中烤片1.5 h。②脫蠟水化,將切片浸于二甲苯Ⅰ、Ⅱ中各10 min,梯度乙醇100%、90%、80%、70%各3 min,PBS沖洗3 min×3次。③抗原修復,將切片置于600 mL檸檬酸鹽緩沖液中,微波中高火沸騰后,取出室溫冷卻10 min,再沸騰8 s,于室溫自然冷卻1 h。④消除內源性過氧化物酶活性,將組織切片浸于3%的H2O2中,避光孵育25 min后,雙蒸水沖洗3 min×3次。⑤玻片擦干,用5%BSA封閉液封閉,室溫孵育20 min,甩去多余液體,滴加一抗,4℃冰箱過夜。37℃恒溫烤箱復溫45 min, PBS沖洗3 min×3次。滴加A液,室溫孵育30 min后,PBS沖洗3 min×3次。擦干,滴加DAB工作液(10mL C液:990mL B液),光鏡下控制顯色,顯色完全后,濕盒中止顯色1 min。蘇木素染色2.5 min,自來水沖洗10 min。⑥1%鹽酸乙醇分化1~3 s,自來水沖洗5 min反藍。⑦梯度乙醇脫水70%、80%、90%、100%各3 min。⑧二甲苯Ⅰ、Ⅱ各15 min透明。⑨封片(中性樹膠:二甲苯=1:1.5)。⑩數據采集,每張切片隨機選取5個視野拍攝照片,通過Image-pro plus 6.0軟件進行半定量分析,取陽性目標的積分光密度進行統計。
1.7 統計學方法
采用SPSS18.0軟件進行數據統計。對所有計量資料進行正態分布檢驗和方差齊性檢驗。當計量資料符合正態分布時采用均數±標準差表示;當計量資料呈偏態分布時采用中位數(最小值,最大值)的形式表示。若計量資料服從正態分布,且數據符合方差齊性檢驗,組間差異采用單因素方差分析(),兩兩比較用最小顯著差法(,),方差不齊時用比較組間差異。若計量資料不服從正態分布,則用秩和檢驗。以<0.05表示差異有統計學意義。
2 結果
2.1 大鼠結腸長度的變化
與正常組比較,模型組、隔藥灸組、假灸組大鼠結腸長度均縮短,差異均有統計學意義(<0.05)。與模型組比較,隔藥灸組大鼠結腸長度雖有增加趨勢,但兩組比較差異無統計學意義(>0.05)。而假灸組大鼠結腸長度與模型組比較差異無統計學意義(>0.05)。詳見表1。
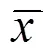
表1 各組大鼠結腸長度比較 (±s,cm)
注:與正常組比較1)<0.05
2.2 大鼠CMDI的變化(表2)
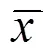
表2 各組大鼠CMDI比較 (±s,分)
注:與正常組比較1)<0.05;與模型組比較2)<0.01
與正常組比較,模型組、假灸組大鼠CMDI升高,差異均有統計學意義(<0.05)。與模型組比較,隔藥灸組大鼠CMDI明顯降低,兩組比較差異有統計學意義(<0.01),假灸組大鼠CMDI與模型組比較差異無統計學意義(>0.05)。詳見表2。
2.3 大鼠結腸組織形態學變化
光學顯微鏡下觀察,正常組大鼠結腸黏膜層上皮細胞形態結構完整,固有層杯狀細胞、腺體排列整齊有序;黏膜下層疏松結締組織形態完整;腸壁肌層(內環、外縱)結構完整無增生,漿膜層分布清晰。模型組大鼠結腸炎癥反應明顯,局部黏膜表面有糜爛甚至潰瘍形成,潰瘍呈裂隙狀,局部杯狀細胞增生明顯,腺體破壞、腺腔排列紊亂;黏膜下層結締組織嚴重水腫伴炎癥細胞浸潤,大量纖維組織增生;腸壁肌層、漿膜層分布尚清晰,病理變化較接近克羅恩病。隔藥灸組大鼠結腸黏膜層結構尚完整,損傷處可見上皮組織修復,杯狀細胞及腺體修復較好,腺體排列尚規則;黏膜固有層及黏膜下層可見炎癥細胞浸潤,黏膜下層結締組織中度水腫;結腸肌層、漿膜層形態結構完整。假灸組大鼠結腸組織病理學表現與模型組類似。結果提示,隔藥灸對克羅恩模型大鼠結腸炎癥損傷具有一定的改善作用。詳見圖1。
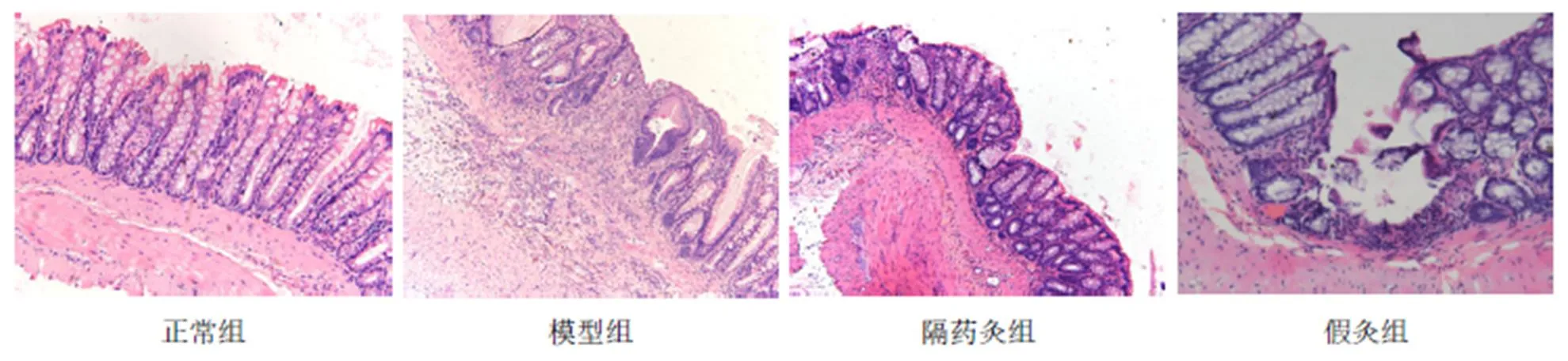
圖1 各組大鼠結腸組織HE染色結果(×200)
2.4 大鼠結腸NLRP3蛋白表達的變化(表3)
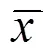
表3 各組結腸NLRP3蛋白表達結果比較 (±s)
注:與正常組比較1)<0.01;與模型組比較2)<0.01; 與假灸組比較3)<0.05
與正常組比較,模型組、假灸組大鼠結腸NLRP3蛋白表達明顯增高(均<0.01);與模型組比較,隔藥灸組大鼠結腸NLRP3蛋白表達明顯減少(<0.01),而假灸組大鼠結腸NLRP3蛋白表達則無顯著性變化 (>0.05)。與假灸組比較,隔藥灸組大鼠結腸NLRP3蛋白表達明顯降低(<0.05)。詳見表3、圖2。
2.5 大鼠結腸ASC蛋白表達的變化
與正常組比較,模型組、假灸組大鼠結腸ASC蛋白表達明顯增高(均<0.01);與模型組比較,隔藥灸組大鼠結腸ASC蛋白表達顯著下降(<0.01),假灸組大鼠結腸ASC表達無顯著性變化(>0.05);與假灸組比較,隔藥灸組大鼠結腸ASC表達明顯降低(<0.01)。詳見表4、圖3。
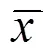
表4 各組大鼠結腸ASC表達結果比較 (±s)
注:與正常組比較1)<0.01;與模型組比較2)<0.01; 與假灸組比較3)<0.01
2.6 大鼠結腸Caspase-1蛋白表達的變化
與正常組比較,模型組、假灸組大鼠結腸Caspase-1蛋白表達明顯增高(均<0.05);與模型組比較,隔藥灸組大鼠結腸Caspase-1蛋白表達明顯降低(<0.01),假灸組大鼠結腸Caspase-1表達無顯著性變化(>0.05);與假灸組比較,隔藥灸組大鼠結腸Caspase-1蛋白表達明顯降低(<0.01)。詳見表5、圖4。
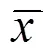
表5 各組結腸Caspase-1表達結果比較 (±s)
注:與正常組比較1)<0.01;與模型組比較2)<0.01; 與假灸組比較3)<0.01
2.7 大鼠結腸IL-1b蛋白表達的變化
與正常組比較,模型組、假灸組大鼠結腸IL-1b蛋白表達明顯增高(均<0.05);與模型組比較,隔藥灸組大鼠結腸IL-1b蛋白表達明顯降低(<0.05),假灸組大鼠結腸IL-1b蛋白表達無顯著變化(>0.05);與假灸組比較,隔藥灸組大鼠結腸IL-1b蛋白表達明顯降低(<0.01)。詳見表6、圖5。
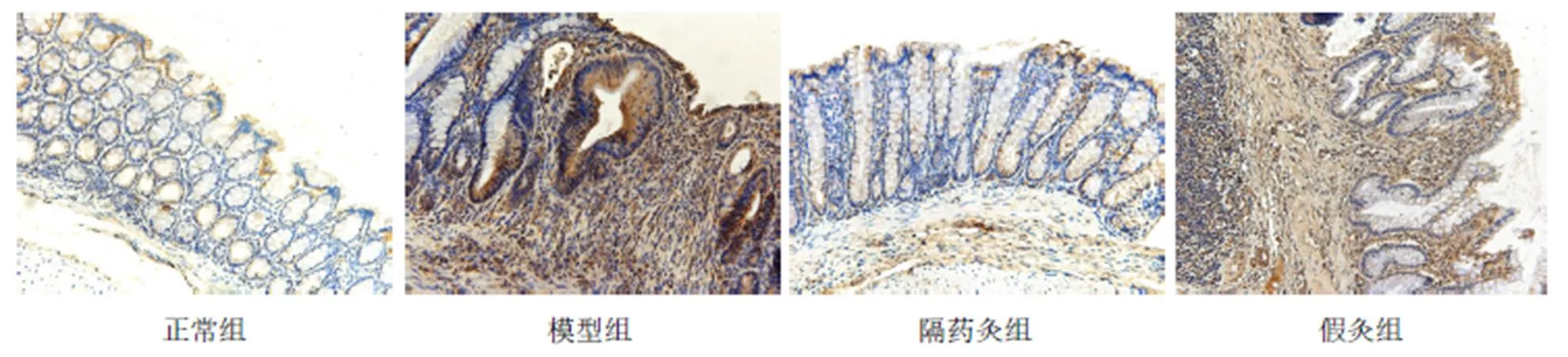
圖2 各組大鼠結腸組織NLRP3的免疫組化(×200)
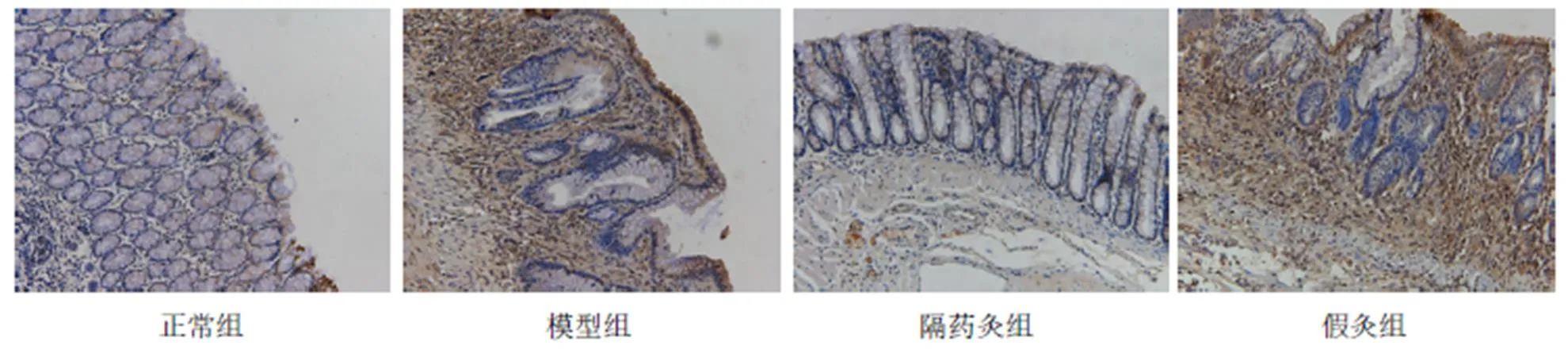
圖3 各組大鼠結腸組織ASC表達的免疫組化(×200)
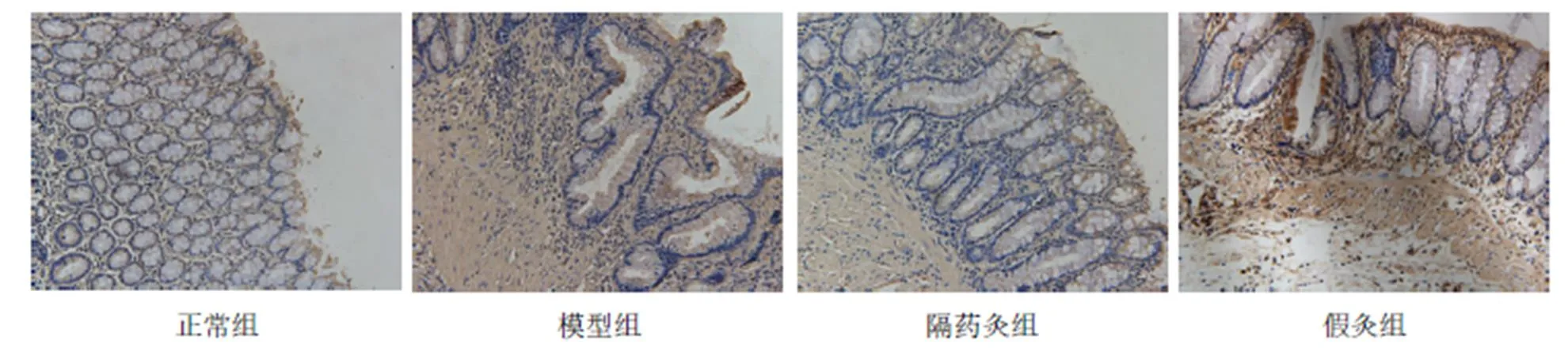
圖4 各組大鼠結腸組織Caspase-1的免疫組化(×200)
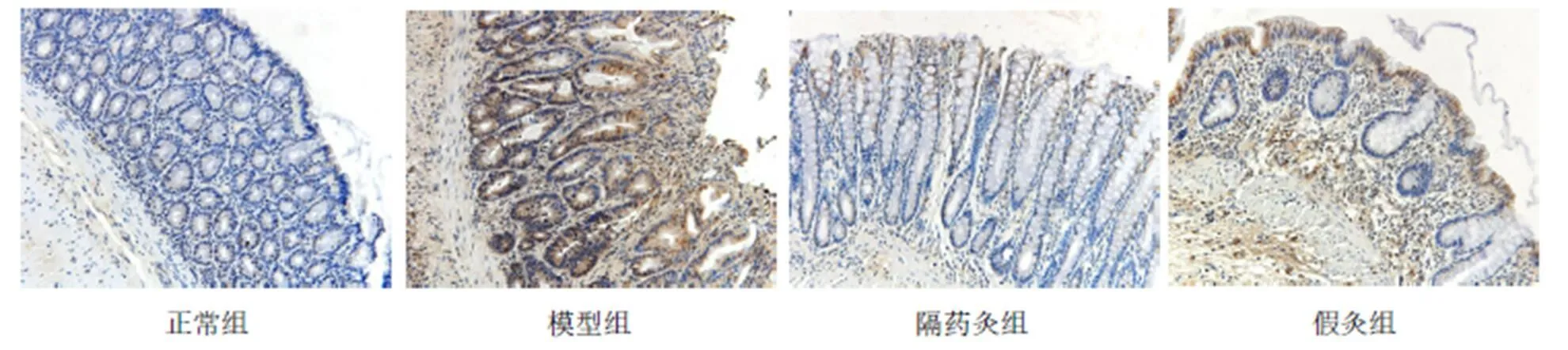
圖5 各組大鼠結腸組織IL-1β的免疫組化(×200)
表6 各組大鼠結腸IL-1b表達結果比較 (±s)
注:與正常組比較1)<0.01;與模型組比較2)<0.01; 與假灸組比較3)<0.01
3 討論
克羅恩病是一種慢性、復發性疾病,組織活檢可見肉芽腫性透壁性炎癥,可累及消化道任何部分,但最常見于末端回腸和鄰近結腸,呈不連續性、節段性病位分布,目前臨床上尚未有治愈手段,部分患者選擇外科手術切除治療[8]。重癥CD患者遷延難愈,預后不良,是公認的引發結腸腫瘤的因素[9]。根據流行病學調查顯示,不同種族間CD的發病率差異顯著,1項基于人群的系統評價研究顯示,CD發病率最高的是歐洲(德國CD患病率為322/10萬),北美次之(美國CD發病率為319/10萬)。其中22項關于CD的研究中有16項(72.7%)研究顯示北美和歐洲CD的發病率呈穩定或下降趨勢;而自1990年以來,非洲、亞洲和南美洲的新興工業化國家(包括巴西)的CD發病率一直呈上升趨勢[10];近年來我國CD的發病率逐年上升,如今已成為國內消化科的常見病[11]。由于其復發緩解過程會對不同年齡患者(尤其是年輕人)的生活質量產生顯著影響,且尚未有有效治愈該疾病的藥物,故有30%~50%的炎癥性腸病患者選擇常規治療外的其他療法作為緩解手段[12-13]。而且隨著病程的進展,腸纖維化、炎癥等會導致腸狹窄,最終會出現梗阻癥狀。盡管近年來對CD的研究取得了一定進展,抗炎等治療顯著改善了患者臨床癥狀,但現有的治療仍無法改善患者的腸纖維化甚至狹窄[14]。因此,探尋CD的有效治療方法一直是醫學界關注的熱點。
研究顯示,在CD發病過程中固有免疫系統發揮關鍵作用,腸黏膜固有免疫系統主要由腸道黏膜屏障、固有免疫細胞及其產物組成[15]。黏膜屏障一旦受損則細菌及其產物入侵黏膜下層,與初始免疫細胞和過繼免疫細胞發生免疫反應,釋放促炎因子(TNF-a、IL-1、IL-6、ROS等)放大炎癥反應。NLRP3是一種存在于胞質內的模式識別受體,在識別特異性的病原相關分子模式后,將信號傳導進入細胞,激活細胞內核轉錄因子NF-kB,進入細胞核后啟動一系列相關炎癥因子轉錄及炎癥小體裝配的級聯反應。其中核苷酸寡聚結構域受體(NLRs/ALRs)被激活并招募胞質中的相關蛋白形成復合體即炎癥小體(inflammasome),炎癥小體的裝配可激活pro-Caspases-1和Caspases-11,將酶原形式的Caspase快速轉化為活性蛋白酶,切割前體pro- IL-1b、pro-IL-18為成熟的炎癥因子并分泌成熟的IL-1b、IL-18[16]。NLRP3炎癥小體的激活失控,則會產生過量IL-1b、IL-18或其他炎性因子,進而誘導大量炎性介質、炎性細胞等在患處堆積,導致機體發生嚴重炎癥并誘發壞死及損傷。CD發病時,腸黏膜被腸道中各種刺激因子刺激,導致NLRP3炎癥小體激活,隨之IL-1b等表達增多,并造成局部黏膜損傷[17-18]。
另外,有研究發現CD的易感性與NLRP3炎癥小體和NOD2的異常激活相關[19]。隨著炎癥小體與CD的相關性研究的深入,發現NLRP3基因編碼區(先前為NALP3)和CARD8基因(編碼CARD蛋白)中的單核苷酸多態性(SNPs)與CD的易感性有關[20]。一項研究對來自CD家族的710個樣本組合進行分析,發現NLRP3基因調節區中的3個SNP與CD具有相關性[21]。另一項研究發現,納入研究的25名CD患者中有60%的患者檢測到NLRP3炎癥小體激活,而潰瘍性結腸炎患者與對照組相比較NLRP3炎癥小體的激活差異無統計學意義[18]。以上研究提示,NLRP3炎癥小體的激活與CD發生發展關系密切,深入研究NLRP3炎癥小體與CD之間的關系,有助于進一步揭示CD的發病機制。
中醫學中無CD的專屬名詞,依據其癥狀常被歸類為“泄瀉”“腹痛”等范疇。艾灸是中醫學重要的組成部分,具有調整陰陽、扶正祛邪、疏通經絡等作用。作為中醫學治療腸腑疾病的有效療法,艾灸近年來在炎癥性腸病的臨床治療中漸漸被廣泛應用,對于輕、中度CD患者的療效較為明顯[22-24]。大量臨床與動物實驗研究結果也證實,艾灸治療炎癥性腸病可能通過調節炎癥反應通路、炎性因子水平、基因表達等,起到降低炎癥反應、修復結腸黏膜屏障、減少組織纖維化、減輕內臟痛、緩解焦慮情緒等作用[5,25]。
本研究結果顯示,CD模型大鼠結腸組織的NLRP3、ASC、Caspase-1、IL-1b蛋白表達均顯著升高。Du X等[26]通過TNBS誘導SD大鼠結腸炎模型,模型組大鼠結腸NLRP3、IL-1b表達亦顯著升高。Castro J等[27]通過TNBS誘導大鼠結腸炎模型,并采用RT-PCR檢測結腸NLRP3、IL-1bmRNA表達,發現兩者在模型組結腸組織中的表達均顯著上升。Bauer C等[28]使用DSS誘導急性結腸炎模型,發現NLRP3基因缺陷型(NLRP3-/-)小鼠與野生型小鼠相比較,結腸損傷極大程度降低; NLRP3炎癥小體及IL-1b的表達顯著上升,且IL-1b的表達依賴NLRP3炎癥小體激活。以上研究結果與本研究結果均有一致性,提示CD模型NLRP3炎癥小體及其下游炎癥因子IL-1b蛋白的表達異常增高。本研究在隔藥灸治療后,CD大鼠結腸組織病理損傷顯著改善,黏膜層上皮、杯狀細胞及腺體得到一定程度的修復,炎癥反應減輕;結腸組織中NLRP3炎癥小體(NLRP3、ASC、Caspase-1)及其下游炎癥因子IL-1b蛋白的表達水平降低。IL-1b是NLRP3炎癥小體信號通路下游重要的炎癥因子,與腸道炎癥相關,已有研究證實IL-1b是引發腸道炎癥最重要的致炎因子之一,可導致腸道屏障功能障礙,誘發并擴大炎癥反應等[29-32]。因此,推測隔藥灸可能通過抑制CD大鼠結腸NLRP3炎癥小體的異常激活,進而下調結腸炎癥因子IL-1b蛋白的表達,達到促進結腸炎性損傷修復之目的。
炎癥小體的發現為CD發病機制以及艾灸抗炎機制的研究提供了新的視角。闡明炎癥小體活化及其調控CD炎癥反應的確切分子機制,對于CD的防治具有重要意義,并有望成為治療CD的新靶點。通過研究NLRP3炎癥小體上下游信號通路與CD發病的關系以及艾灸對其的調控作用,將有助于進一步提高CD的臨床療效。
[1] Abraham C, Cho JH. Inflammatory bowel disease[J]., 2009,361(21):2066-2078.
[2] Feuerstein JD, Cheifetz AS. Crohn Disease: Epidemi- ology, Diagnosis, and Management[J]., 2017,92(7):1088-1103.
[3] Vavricka SR, Schoepfer A, Scharl M,. Extra- intestinal manifestations of inflammatory bowel disease[J]., 2015,21(8):1982- 1992.
[4] Baumgart DC, Sandborn WJ. Crohn's disease[J]., 2012,380(9853):1590-2605.
[5] 魏凱,張丹,竇傳字,等.艾灸對克羅恩病大鼠結腸NF-kB p65及TNF-a、IL-1b調節作用的研究[J].世界中醫藥,2013,8(8):862-866.
[6] Morris GP, Beck PL, Herridge MS,. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J]., 1989,96(2):795-803.
[7] Paiotti AP, Miszputen SJ, Oshima CT,. Etanercept attenuates TNBS-induced experimental colitis: role of TNF-α expression[J]., 2011, 42(5):443- 450.
[8] Cheifetz AS. Management of active Crohn disease[J]., 2013,309(20):2150-2158.
[9] Zaki MH, Vogel P, Body-Malapel M,. IL-18 production downstream of the Nlrp3 inflammasome confers protection against colorectal tumor formation[J]., 2010,185(8):4912-4920.
[10] Ng SC, Shi HY, Hamidi N,. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies[J]., 2018,390(10114):2769-2778.
[11] Molodecky NA, Soon IS, Rabi DM,. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review[J]., 2012,142(1):46-54.e42; quiz e30.
[12] Sirois FM. Health-related self-perceptions over time and provider-based Complementary and Alternative Medicine
(CAM) use in people with inflammatory bowel disease or arthritis[J]., 2014,22(4):701- 709.
[13] Opheim R, Bernklev T, Fagermoen MS,. Use of complementary and alternative medicine in patients with inflammatory bowel disease: results of a cross-sectional study in Norway[J]., 2012,47 (12):1436-1447.
[14] Spinelli A, Correale C, Szabo H,. Intestinal fibrosis in Crohn's disease: medical treatment or surgery?[J]., 2010,11(2):242-248.
[15] Oshima T, Miwa H. Gastrointestinal mucosal barrier function and diseases[J]., 2016,51(8): 768-778.
[16] Kayagaki N, Warming S, Lamkanfi M,. Non- canonical inflammasome activation targets caspase-11[J]., 2011,479(7371):117-121.
[17] Liu L, Dong Y, Ye M,. The pathogenic role of NLRP3 inflammasome activation in Inflammatory bowel diseases of both mice and humans[J]., 2017,11(6):737-750.
[18] Lazaridis LD, Pistiki A, Giamarellos-Bourboulis EJ,. Activation of NLRP3 inflammasome in inflammatory bowel disease: differences between Crohn's disease and ulcerative colitis[J]., 2017,62(9):2348- 2356.
[19] Elia PP, Tolentino YF, Bernardazzi C,. The role of innate immunity receptors in the pathogenesis of inflammatory bowel disease[J]., 2015: 936193.
[20] Schoultz I, Verma D, Halfvarsson J,. Combined polymorphisms in genes encoding the inflammasome components NALP3 and CARD8 confer susceptibility to Crohn's disease in Swedish men[J]., 2009,104(5):1180-1188.
[21] Villani AC, Lemire M, Fortin G,. Common variants in the NLRP3 region contribute to Crohn's disease susceptibility[J]., 2009,41(1):71-76.
[22] Joos S, Brinkhaus B, Maluche C,. Acupuncture and moxibustion in the treatment of active Crohn's disease: a randomized controlled study[J]., 2004,69(3): 131-139.
[23] 包春輝,吳璐一,吳煥淦,等.針灸治療活動期克羅恩病:隨機對照研究[J].中國針灸,2016,36(7):683-688.
[24] Shang HX, Wang AQ, Bao CH,. Moxibustion combined with acupuncture increases tight junction protein expression in Crohn's disease patients[J]., 2015,21(16):4986-4996.
[25] Wei K, Zhang D, Hong J,. Herb-partitioned moxibustion and the miRNAs related to Crohn's disease: a study based on rat models[J]., 2015:265238.
[26] Du X, Chen W, Wang Y,. Therapeutic efficacy of carboxyamidotriazole on 2,4,6-trinitrobenzene sulfonic acid-induced colitis model is associated with the inhibition of NLRP3 inflammasome and NF-kappaB activation[J]., 2017,45:16-25.
[27] Castro J, Ocampo Y, Franco L. Cape Gooseberry [Physalis peruviana L.] Calyces Ameliorate TNBS Acid- induced Colitis in Rats[J]., 2015,9(11): 1004-1015.
[28] Bauer C, Duewell P, Mayer C,. Colitis induced in mice with dextran sulfate sodium (DSS) is mediated by the NLRP3 inflammasome[J]., 2010,59(9):1192- 1199.
[29] De Santis S, Kunde D, Galleggiante V,. TNFalpha deficiency results in increased IL-1beta in an early onset of spontaneous murine colitis[J]., 2017, 8(8):e2993.
[30] Ogawa M, Osada H, Hasegawa A,. Effect of interleukin-1beta on occludin mRNA expression in the duodenal and colonic mucosa of dogs with inflammatory bowel disease[J]., 2018,32(3):1019- 1025.
[31] 張璐,王詩怡,范一宏,等.克羅恩病患者小腸細菌過生長的監測及意義研究[J].浙江臨床醫學,2017,19(6): 1029-1032.
[32] 吳璐一,翁志軍,吳煥淦,等.Th17細胞因子在CD大鼠結腸不同炎性時期的差異表達[J].世界華人消化雜志,2016,24(14):2161-2169.
Experimental Study on the Regulating Effect of Herbal Cake-partitioned Moxibustion on NLRP3 Inflammasome and IL-1β in Colons of Crohn's Disease Rats
1,1,2,3,1,1,3,1,1,1,1,3.
1.,201203,; 2.,310006,;3.,200030,
To explore the action mechanism of moxibustion in treating Crohn's disease (CD) by observing the effect of herbal cake-partitioned moxibustion on the expression of NLRP3 inflammasome (NLRP3, ASC and Caspase-1) and IL-1β.Male Sprague Dawley (SD) rats of clean conventional grade were randomized into a normal control group (NG), a model control group (MG), a herbal cake-partitioned moxibustion control group (MoxG), and a sham moxibustion control group (SMG). The CD rat models were developed by using the mixture of 2,4,6-trinitrobenzene sulfonic acid (TNBS) and alcohol via enema. When the models were successfully developed, the MoxG received moxibustion intervention at bilateral Tianshu (ST25) and Qihai (CV6), and the SMG were administered by unlighted moxa cones. At the end of treatment, the length of each rats' colon and the colon macroscopic damage index (CMDI) score were recorded, the histopathological variations of rats' colons were observed by adopting HE staining and light microscope, and the expressions of NLRP3, ASC, Caspase-1 and IL-1β in rats' colons were determined by using immunohistochemical technique.Compared to the NG, the MG had its rats' colons present with severe damages, fissured ulcers and inflammatory cell infiltration with edema, and granulomas in submucosa of some colons, and its expressions of NLRP3, ASC, Caspase-1 and IL-1β increased significantly (<0.05); compared to the MG, the MoxG had rats' colons present with improved structures and reduced intestinal inflammation, and its expressions of NLRP3, ASC, Caspase-1 and IL-1β dropped significantly (<0.05); the SMG had its rats' colon inflammation present similarly to the MG, and its expressions of NLRP3, ASC, Caspase-1 and IL-1β had no significant difference (>0.05).Herbal Cake-partitioned moxibustion can down-regulate the expressions of NLRP3, ASC, caspase-1 and IL-1β in CD rats' colons to promote the repair of colon damage.
Medicinal cake-partitioned moxibustion; Crohn’s disease; NLRP3 inflammasome; Indirect moxibustion; Rats
1005-0957(2019)02-0119-08
R2-03
A
10.13460/j.issn.1005-0957.2019.02.0119
2018-08-03
國家重點基礎研究發展計劃(2015CB554501);國家自然科學基金項目(81674073);上海市衛生計生系統優秀學科帶頭人培養計劃項目(2017BR047)
張霽(1990—),女,2016級博士生,Email:zhangdaimao1990@163.com
吳麗潔(1990—),女,2017級博士生,Email:wljzwb@163.com
馬曉芃(1973—),女,研究員,博士生導師,Email:pengpengma@163.com

