刷狀聚磷酸酯包載阿霉素形成的納米顆粒對胰腺癌BxPC-3細胞株的殺傷效應
楊席席,任 樂,高 萌,許 朝,余 躍
胰腺癌是一種惡性程度高,病情進展迅速,且預后較差的消化道腫瘤,5年存活率目前已不足5%[1-2]。大多數患者被診出時已錯過手術機會,目前臨床中晚期多以化療為主。阿霉素(doxorubicin,Dox)是一種廣譜的腫瘤化療藥物,臨床上已應用于多種癌癥的治療,但Dox對骨髓及心臟等明顯的毒副作用,限制了其在臨床癌癥治療的應用[3-4]。聚乙二醇(polyethylene glycol,PEG)修飾的聚磷酸酯化合物近年來越來越受到人們的關注,在多種癌癥治療方面有顯著療效,PEG修飾的納米顆粒可以有效增加其藥物的水溶性,且隨其密度增大,可以顯著延長血液中循環,這些將使得其包載的藥物能夠在腫瘤部位富集而發揮更強的抗腫瘤效應[5-6]。該研究旨在設計不同PEG密度刷狀聚磷酸酯納米顆粒,探究其被胰腺癌細胞攝取差異,及對胰腺癌細胞的殺傷效應,為進一步將聚磷酸酯納米材料應用于胰腺癌臨床治療提供理論參考。
1 材料與方法
1.1材料阿霉素鹽酸鹽/Dox購自北京華豐有限公司;NoPEG-NP、LowPEG-NP、HighPEG-NP系華南理工大學楊顯珠教授饋贈;人胰腺癌細胞系BxPC-3購自上海細胞庫;噻唑藍(MTT)購自美國Sigma -Aldrich公司;RPMI-1640培養基購自美國 Invitrogen公司。
1.2方法
1.2.1納米顆粒的制備 將已制備的刷狀聚磷酸酯聚合物NoPEG-NP、LowPEG-NP、HighPEG-NP和Dox溶于二甲亞砜(DMSO)溶液中,再通過攪拌、透析、濃縮等過程將Dox通過疏水間作用力包載其中而獲得納米顆粒NoPEG-NPDox、LowPEG-NPDox及HighPEG-NPDox。
1.2.2納米顆粒的粒徑(particle size,PS)及其血清穩定性檢測 分別取制備好的納米顆粒NoPEG-NPDox、LowPEG-NPDox及HighPEG-NPDox溶液各100 μl加入到不同的比色皿中,用動態光散射儀(dynamic light Scatterometer,DLS)來檢測顆粒PS,溫度控制在25 ℃,需重復此實驗3次。其次為了了解各種納米藥物是否能在血清中穩定存在,將其加入含10% 胎牛血清的RPMI-1640 溶液中邊孵育邊緩慢攪拌,然后用DLS分別檢測不同納米顆粒在相應時間點的PS大小,分析其穩定性。
1.2.3細胞培養 BxPC-3細胞系用含10% 胎牛血清、1%雙抗的RPMI-1640 培養液培養于恒溫孵育箱中(37 ℃、5% CO2),當細胞生長到對數期時,即貼壁面積達80%~90%時,用0.25%胰酶消化。
1.2.4FACS檢測納米顆粒NoPEG-NPDox、LowPEG-NPDox、HighPEG-NPDox及游離阿霉素(Free Dox)各組細胞攝取差異 將生長狀態良好的BxPC-3細胞植入24孔板,每孔約10萬細胞。將孔板放到恒溫培養箱中進行培養過夜,次日用RPMI-1640完全培養基配置含游離 Dox或納米顆粒NoPEG-NPDox、LowPEG-NPDox、HighPEG-NPDox,使Dox濃度均為3 μg/ml。溫箱孵育2 h,每組3個平行孔,后取出培養板,吸去其中舊的含有顆粒和納米藥物的培養基,后向板中加入適量1×PBS緩沖液清洗3次,充分洗去孔板中藥物殘留。接下來向每孔中加入等量0.25%的胰酶進行消化,溫箱孵育3~5 min 終止消化,后將其轉移至事先準備好的潔凈流式管中進行離心,4 ℃、1 000 r/min、5 min,結束后去除上清液,加入適量緩沖液重懸(250 μl左右),流式上樣檢測,后用FlowJo 7.6.1.處理數據,算出不同組細胞攝取的Dox量。
1.2.5MTT法檢測不同納米顆粒及游離Dox各組對細胞的殺傷效果 將生長狀態良好的BxPC-3細胞種植于96孔板中,5 000細胞/孔。將其置于溫箱孵育過夜,次日分別加入用RPMI-1640完全培養液配制的含Dox濃度為0.50、 1.00、2.00、4.00 μg/ml的游離Dox和聚磷酸酯納米顆粒NoPEG-NPDox、LowPEG-NPDox、HighPEG-NPDox,500 μl孔, 每組設4個平行孔,另外設置只含細胞不做任何處理的細胞孔作為空白對照。溫箱孵育4 h,后取出棄去舊的培養液,換上新的RPMI-1640完全培養基,繼續培養48 h,期間倒置顯微鏡下仔細觀察細胞生長狀態,培養結束后向板中加入由培養液和已過濾除菌的MTT溶液混合,濃度為1 mg/ml,100 μl/孔,溫箱孵育4 h后取出向板中加入事先配置好20% SDS細胞裂解液(100 μl/孔),放置溫箱中繼續培養,8 h后拿出用酶標儀進行檢測,用軟件Excel 2013、SPSS 16.0和GraphPad.Prism.v 5.0.處理測好的對應孔的吸光度(optical density,OD)值,計算細胞存活率:細胞存活率(%)= (藥物細胞組OD值-空白對照組OD值) / (非光照不加藥細胞組OD值-空白對照組OD值) ×100%。
1.2.6活死細胞染色法檢測各組納米顆粒細胞殺傷情況 BxPC-3細胞種板步驟基本同流式檢測,將完全培養液配制的含Dox濃度為4 μg/ml的游離組和納米顆粒分別加入到相應的孔板中,培養箱孵育4 h后取出棄去舊的培養液,換上新的培養基,繼續溫箱孵育48 h,后將PBS配好的死細胞染色液溴乙非啶豪莫二聚體(4 μmol/L)和活細胞染色液鈣黃綠素乙酰甲酯( 2 μmol/L)加入孔板中,100 μl/孔。室溫孵30 min,后用熒光顯微鏡觀察并拍照保存,最后用軟件Image J處理相應數據。

2 結果
2.1不同聚磷酸酯納米藥物的PS、分布及其血清中的穩定性首先通過核磁表征等證明成功合成了刷狀聚磷酸酯納米顆粒NoPEG-NPDox、LowPEG-NPDox和HighPEG-NPDox。通過DLS檢測證明制備好的納米顆粒NoPEG-NPDox、LowPEG-NPDox或HighPEG-NPDox的PS,大小約為95 nm,見圖1A。PEG殼層的存在阻止了這些運載有Dox 納米顆粒的聚集成團,將顆粒置于10%胎牛血清的RPMI-1640培養基中培養,隨著時間的延長,顆粒的PS也基本在一個固定PS范圍內進行波動,說明其在血液中可以穩定存在,血清穩定性好,見圖1B。
2.2FACS結果顯示三種納米顆粒中P(CEP30-EEP10)/Dox/NoPEG-NPDox被胰腺癌細胞攝取更多在細胞完成溫箱孵育攝取2 h后,FACS檢測每組細胞中攝取的Dox量見圖2B。胰腺癌細胞和三種納米顆粒共孵育2 h后,NoPEG-NPDox胞內的Dox平均熒光強度(mean flourscence indensity,MFI)約為LowPEG-NPDox組的2倍(t=8.845,P<0.001),LowPEG-NPDox組約為HighPEG-NPDox(t=8.367,P<0.001)的1.6倍,其中三組顆粒的Dox的熒光量均低于Free Dox組,NoPEG-NPDox的熒光量僅略低于游離組,各組間差異有統計學意義(P<0.001)。
2.3MTT法顯示納米顆粒NoPEG-NPDox對細胞的殺傷作用更強加藥孵育后3種納米藥物抑制細胞的生長作用為NoPEG-NPDox組強于LowPEG-NPDox組,其次是HighPEG-NPDox組,其中Free Dox組略強于NoPEG-NPDox組。如Dox濃度為4.0 μg/ml時,Free Dox組對細胞的抑制率為82.40%,接近85%,而NoPEG-NPDox組抑制率也達到了77.55%,接近于80%,已和游離組細胞抑制率相近,而其余兩組LowPEG-NPDox和HighPEG-NPDox相對較弱,分別只有58.85%和39.74%,均明顯低于NoPEG-NPDox組。見圖3、表1。
2.4各種納米顆粒對細胞的殺傷情況活死細胞染色法結果顯示:紅色代表死細胞,綠色代表活細胞,見圖3B,加藥培養后NoPEG-NPDox組單個視野下死細胞所占比例高于LowPEG-NPDox組(t=7.594,P<0.01),LowPEG-NPDox組強于HighPEG-NPDox組(t=7.921,P<0.01),其中Free Dox組略高于NoPEG-NPDox組(t=7.754,P<0.01),各組間差異有統計學意義。見圖3。
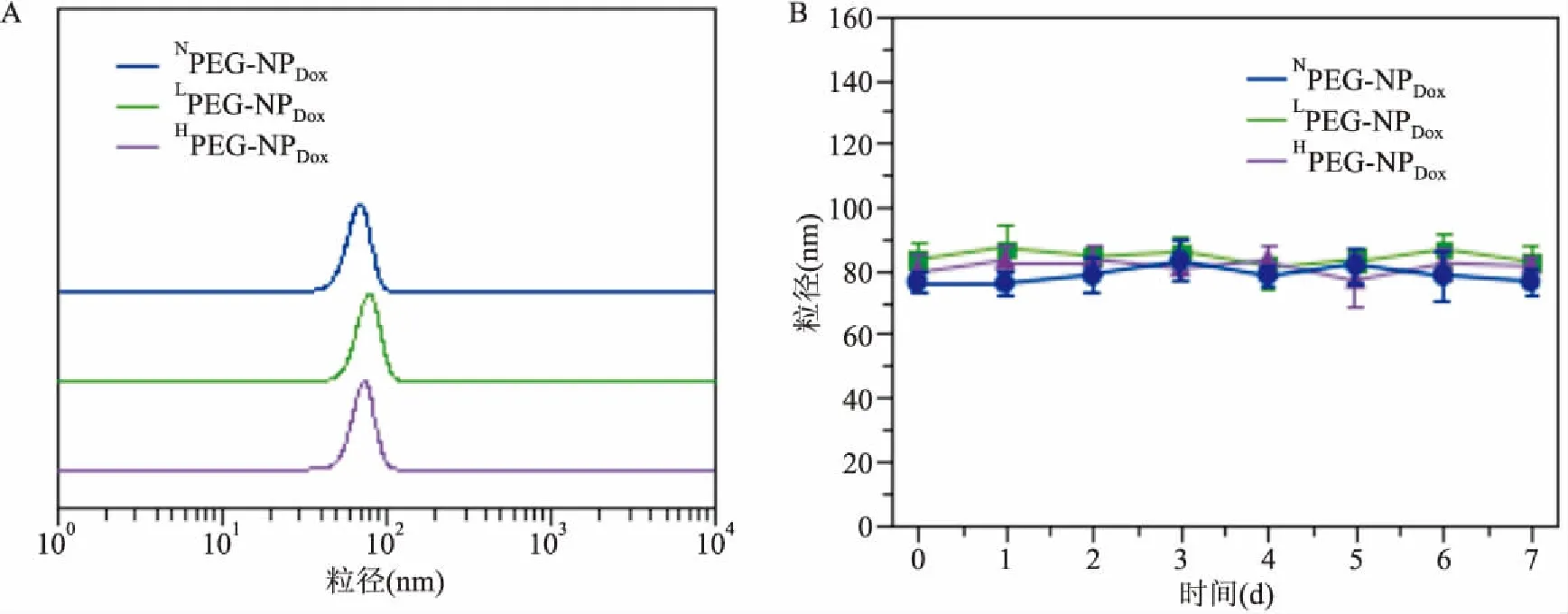
圖1 顆粒相關性質的表征
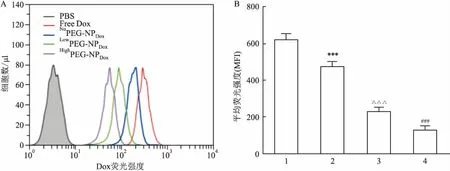
圖2 FACS檢測3種納米顆粒被細胞攝取情況
A:流式峰圖;B:柱狀圖;1:NoPEG-NPDox組;2:LowPEG-NPDox組;3:HighPEG-NPDox組;4:Free Dox組;與NoPEG-NPDox組比較:***P<0.001;與LowPEG-NPDox組比較:△△△P<0.001;與HighPEG-NPDox組比較:###P<0.001

表1 加藥孵育后各處理組在不同Dox濃度下對BxPC-3細胞生長的抑制率
與Free Dox比較:*P<0.01,**P<0.001;與NoPEG-NPDox比較:△P<0.01,△△P<0.001;與LowPEG-NPDox比較:#P<0.01,##P<0.001

圖3 三種顆粒對細胞的殺傷情況
A:MTT法檢測各組顆粒被細胞攝取后對細胞產生的殺傷情況;B:活死細胞染色法檢測各組納米顆粒對細胞的殺傷效應
3 討論
Dox通過細胞膜進入癌細胞作用于其DNA,進而產生較強的抗腫瘤藥理特性,臨床上已用于多種癌癥的治療。但Dox在殺傷腫瘤細胞的同時也對正常組織產生了一定的毒副作用,這些都限制了其在臨床癌癥治療的應用。納米載藥體系,是通過一系列包埋、囊封、吸附的方式將臨床藥物同納米載體相結合后形成一種穩定的納米載藥系統,它可以增加藥物的水溶性,減輕其對正常組織的毒副作用,使得納米藥物在腫瘤部位通過腫瘤的高滲透及滯留效應完成在腫瘤部位的富集,為后期藥物在腫瘤部位發揮療效提供基礎[7]。此外也有相關研究[8]報道了酸度響應的超支化納米材料包載Dox后顯示增強的乳腺癌抑制效應。
PEG修飾的聚磷酸酯的化合物近年來越來越受到人們的關注,在多種癌癥治療方面有顯著療效,已在相關文獻[9-10]中報道。本研究選用不同密度PEG修飾聚磷酸酯納米載藥體系,PEG修飾后可顯著改善藥物的水溶性,為后期體內實驗藥物在血液中能夠穩定存在,延長血液中長循環奠定基礎。FACS結果顯示納米顆粒NoPEG-NPDox被細胞攝取更多,多于LowPEG-NPDox及HighPEG-NPDox,這可能是由于納米顆粒的PEG密度越大時,會使得其柔韌性增加,抵抗細胞攝取的能力越強,因此沒有PEG鏈修飾的NoPEG-NPDox在三種顆粒中相對攝取最好,而Free Dox屬于小分子物質,可以通過擴散的形式進入細胞,故同等條件下游離組相對納米顆粒攝取多一些[11]。因NoPEG-NPDox在腫瘤細胞內Dox含量相對最多,故后續MTT實驗中NoPEG-NPDox的細胞殺傷效果要強于LowPEG-NPDox,再者HighPEG-NPDox。且Dox濃度為4.0 μg/ml,NoPEG-NPDox的細胞殺傷效果和游離組接近,為80%左右,說明通過納米載藥系統有效地提高了Dox對胰腺癌細胞的殺傷作用。
綜上所述,本體外研究證明了納米顆粒NoPEG-NPDox能夠更好地被胰腺癌細胞攝取,后期殺傷癌細胞效應更強。在細胞水平上,PEG的密度影響細胞對其的攝取量,PEG密度越大,細胞攝取越少,而且雖然游離Dox的攝取量要多于NoPEG-NPDox,但因游離的Dox其本身毒副作用的存在,且體內應用時它極易被血液系統清除,而要達到體內抑瘤效應時,其對正常組織的毒副作用遠大于抑瘤作用,故遠期應用方面,其整體效果遠不及聚磷酸酯納米藥物,后者可以避免血液的清除,在血液中長期穩定存在,更多的納米藥物在腫瘤部位富集,進而對腫瘤部位產生更強殺傷效應。而不同PEG密度納米藥物在體內應用時其體內循環情況是否和細胞水平一樣,有待進一步研究,為臨床實踐及應用提供更多的價值參考。

