siRNA可降低IL-1β刺激椎間盤細胞所致凋亡敏感性
韓敦富,尹荷珊,王 延,王鵬云,汪 震,魏 超,時 明
炎癥因子特別是IL-1β在椎間盤退變過程中發揮了很大的促進作用,涉及到諸多方面[1-2]。最近的研究[3]表明,IL-1β不僅能夠導致營養缺乏狀態下椎間盤細胞的凋亡,而且還可以大大提高椎間盤細胞對Fas Ligand介導的凋亡敏感性[4]。Cui et al[4]研究同時還發現,IL-1β可以上調死亡受體Fas mRNA 的表達。然而,關于IL-1β預刺激增強了椎間盤細胞對Fas L的凋亡敏感性的原因卻未作深究。
該研究力圖利用RNAi的方法對這一原因進行探討并檢驗能否利用這一技術降低椎間盤細胞對炎性因子刺激而導致的凋亡敏感性,并對其機制作初步探討。為保持與Cui et al[4]實驗結果的一致性,本部分實驗仍然采用了SD大鼠椎間盤內層纖維環+髓核交界區細胞。
1 材料與方法
1.1實驗動物3月齡SD大鼠,雌雄不限(中山大學動物實驗中心提供)。
1.2主要試劑及儀器DMEM-F12培養基(美國Gibco公司);特優級胎牛血清(美國Hyclone公司);重組大鼠Fas Ligand(美國R&D Systems公司);Fas-siRNA(廣州市銳博生物科技有限公司);RT-PCR試劑盒(PrimeScriptTMRT-PCR Kit,日本TaKaRa公司,);PCR 引物(上海生工生物工程公司);β-actin單克隆抗體、Fas單克隆抗體 (anti-Rat)、蛋白 Marker(美國Newmarker公司);碘化丙啶、Annexin V-FITC (奧地利Bender MedSystems公司);流式細胞儀(EpicsALtra,美國Beckman CouLter公司)。
1.3SD大鼠椎間盤細胞分離和培養按Cui et al[4]培養方法,10%水合氯醛麻醉SD大鼠,取L3-L6 椎間盤,顯微鏡下分離取出內層纖維環 +髓核交界區組織,PBS緩沖液沖洗、切碎、轉移、胰蛋白酶消化、過濾、離心,最后以1×106/ml 在37 ℃、5%CO2培養箱中培養,鑒定結果見圖1。
1.4細胞準備和siRNA轉染
1.4.1Fas-siRNA序列 采用已被驗證能有效沉默Fas mRNA的序列:ACCAAAUGCAAGAAACAAA dTdT(正義鏈) dTdT UGGUUUACGUUCUUUGUUU(反義鏈)[5]。
1.4.2轉染細胞 轉染前1 d將鋪滿培養瓶 80%~90%原代SD大鼠椎間盤細胞進行傳代,以2×105~4×105/孔的密度接種于6孔板中。采用Lipofectamine 2000+ Opti MEM I脂質體轉染法轉染。采用陰性對照siRNA,轉染后48 h培養基更換培養基,在37 ℃、5%CO2培養箱中培養。
1.5實驗分組及細胞處理
1.5.1IL-1β(10 ng/ml)在不同時間點對陰性siRNA轉染的大鼠椎間盤細胞Fas表達的影響 轉染后48 h的椎間盤細胞,共設5組均更換為1% FBS培養基,加10 ng/ml IL-1β分別培養0、4、8、16、32 h, RT-PCR檢測Fas mRNA表達,Western blot檢測Fas蛋白表達水平。
1.5.2IL-1β刺激后的椎間盤細胞與FasL共培養后Fas表達及凋亡情況觀察 轉染后48 h的椎間盤細胞分為5組: N:作為對照組,陰性對照siRNA轉染細胞不加FasL培養在1%FBS培養基中(在8 h后重新更換1%FBS培養基);N-20 ng:陰性對照siRNA轉染細胞加1%FBS培養基中培養8 h后,重新更換1%FBS培養基,加入終濃度為20 ng/ml FasL;N-IL:陰性對照siRNA轉染細胞與10 ng/ml IL-1β預培養8 h后(1%FBS培養基),重新更換1%FBS培養基,加入終濃度為20 ng/ml FasL;Si-20 ng:Fas-siRNA轉染細胞加1%FBS培養基中培養8 h后,重新更換1%FBS培養基,加入終濃度為20 ng/ml FasL;Si-IL:Fas-siRNA轉染細胞與10 ng/ml IL-1β預培養8 h后(1%FBS培養基),重新更換1%FBS培養基,加入終濃度為20 ng/ml FasL;加入終濃度為20 ng/ml FasL后再共培養24 h。即siRNA轉染后80 h后,細胞進行Annexin V-FITC/碘化丙啶雙染或提取總RNA和總蛋白,分別檢測以下指標。同時采用Hochest 33258染色評估細胞凋亡情況,以相互驗證細胞凋亡評測情況。
1.6檢測指標及方法
1.6.1RT-PCR檢測Fas的mRNA表達水平 TRIzoL法提取總RNA,兩步法RT-PCR進行擴增,收集PCR產物用于瓊脂糖凝膠電泳,凝膠成像系統進行拍照,圖像分析軟件進行光密度掃描分析。Fas上、下游引物為5′-GCATCTTTGAGGGTTTGGA-3′,5′-CATTTGGTGTTGCTGGTTC-3′;退火溫度50 ℃,產物長度409 bp。
1.6.2Western blot檢測Fas的蛋白表達水平 于各時間點用RIPA裂解液分別提取總蛋白備用;制備凝膠、上樣、電泳、轉膜;免疫雜交:轉膜后PVDF膜孵育Fas一抗4 ℃過夜 (稀釋度均為1 ∶1 000);1×PBST洗滌,室溫孵育β-actin二抗(抗稀釋度1 ∶1 000) 1 h;曝光顯影、照像留底;圖像分析系統計算條帶的灰度×面積值。各組Fas條帶值同相應的β-actin條帶值的比值表示目的蛋白的表達水平。
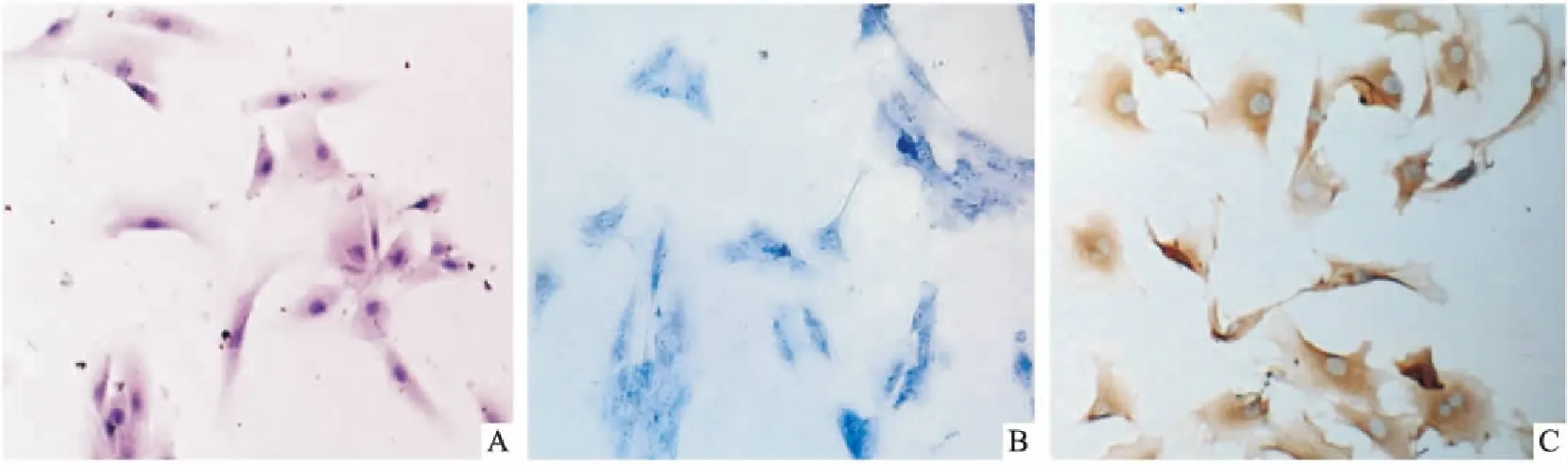
圖1 原代內層纖維環+纖維環與髓核交界區細胞鑒定 ×100
A:HE染色顯示細胞呈多角形或短梭形,核為圓形或橢圓形,位于胞質中央,呈藍紫色;B:甲苯胺蘭染色顯示基質藍染,核仁亦呈藍色著色;C:Ⅱ型膠原免疫細胞化學染色顯示細胞質染成棕黃色,細胞核基本不著色
1.6.3流式細胞儀測定細胞凋亡率 用Annexin V-FITC/碘化丙啶雙染,流式細胞儀分析凋亡率。胰酶消化收集細胞,PBS 洗滌2次,離心收集全部細胞,每管加入膜聯蛋白結合緩沖液 195 μl,5 μl Annexin V-FITC 混勻后,再加入10 μl 碘化丙啶,混勻,避光、室溫反應5 min,EpicsALtra流式細胞儀分析得到細胞凋亡率。

2 結果
2.1IL-1β(10ng/ml)在不同時間點對陰性對照siRNA轉染的大鼠椎間盤細胞Fas表達的影響RT-PCR結果顯示,10 ng/ml的IL-1β和陰性對照siRNA轉染的大鼠椎間盤細胞共培養,在4 h開始Fas mRNA就有所上調,但僅32 h時和對照相比有統計學差異(圖2)。Western blot法檢測Fas蛋白表達水平無明顯差異,可見 10 ng/ml的IL-1β對陰性對照siRNA轉染的大鼠椎間盤細胞Fas蛋白表達影響作用不明顯。
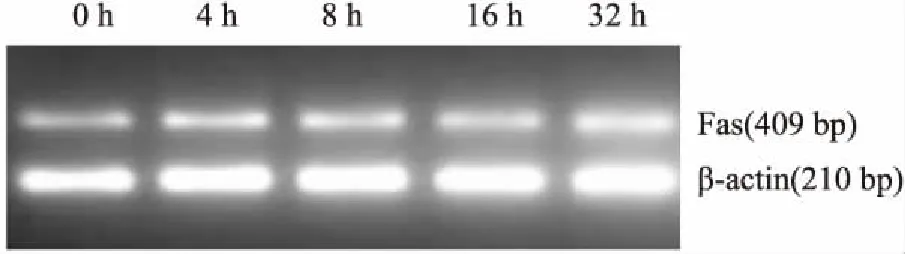
圖2 RT-PCR法檢測IL-1β(10ng/ml)在不同時間點對陰性對照siRNA轉染的大鼠椎間盤細胞Fas mRNA表達的影響
2.2IL-1β刺激后的椎間盤細胞與FasL共培養后Fas表達及凋亡情況
2.2.1RT-PCR檢測Fas 的mRNA表達水平 10 ng/ml IL-1β刺激8 h后,和20 ng/ml FasL共培養24 h,RT-PCR檢測結果顯示,Si-20 ng、Si-IL組較對照組Fas mRNA的表達分別降低了70%、40.6%;而N-20 ng、N-IL組較對照組Fas mRNA的表達均升高,分別是對照組的1.53倍、1.99倍。各組之間比較差異均有統計學意義(圖3) (P<0.05)。
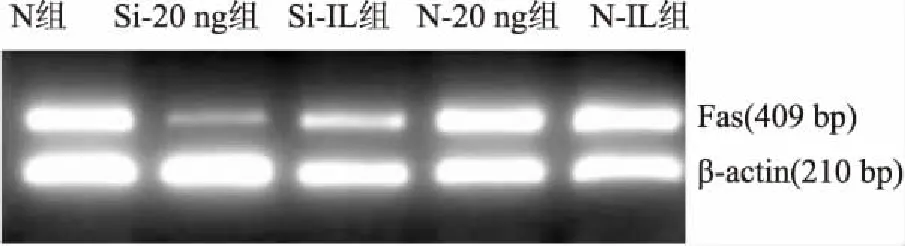
圖3 RT-PCR檢測FasL對轉染細胞Fas mRNA的表達影響
2.2.2Western blot檢測Fas的蛋白表達水平 10 ng/ml IL-1β刺激8 h后,和20 ng/ml FasL共培養24 h,Western blot檢測結果顯示,Si-20 ng、Si-IL組較對照組Fas 蛋白的表達分別降低了37.8%、25.8%;而N-20 ng、N-IL組較對照組Fas 蛋白的表達均升高,分別是27.9%、37.2%。 Si-20 ng、Si-IL、N-20 ng、N-IL組與對照組之間比較差異均有統計學意義(圖4、表1),結果與RT-PCR結果相一致。
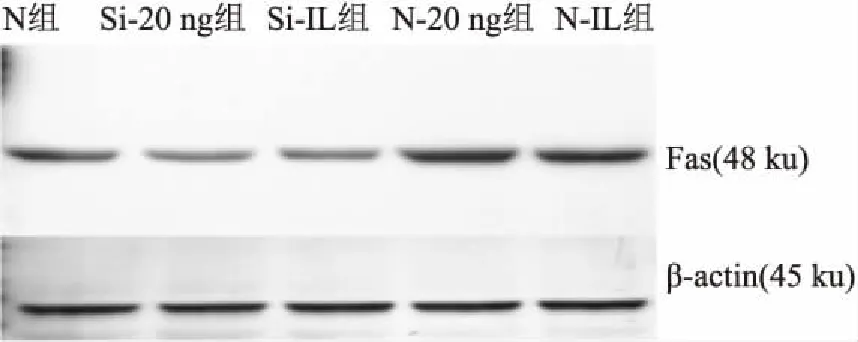
圖4 Western blot法檢測FasL對轉染細胞Fas 蛋白表達變化的影響
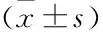
表1 Western blot檢測Fas的蛋白表達水平的組間比較統計分析結果
與N組比較:*P<0.05;與Si-IL組比較:#P<0.05
2.2.3流式細胞儀測定細胞凋亡率 Fas-siRNA轉染后的細胞Si-20 ng、Si-IL組較相同FasL濃度共培養的N-20 ng、N-IL組凋亡率明顯降低(圖5);但Fas-siRNA轉染后的細胞Si-20 ng組與Si-IL組之間、Si-20 ng組與對照組之間細胞凋亡率統計分析仍然存在差異 (表2)。
3 討論
既往研究[5-9]表明,Fas/FasL凋亡系統是椎間盤細胞的主要凋亡途徑,并且該凋亡途徑的啟動是受多種因素影響的。Fas、FasL的表達部位(正常/非正常)、表達形態(膜態還是可溶性態)、表達水平、二者的多態性,細胞所處的微環境狀態、是否有外源因子的存在等等都有可能導致啟動結果的不同。本實驗結果也支持這一觀點。實驗顯示,在兩組未沉默Fas基因的椎間盤細胞中,經IL-1β預處理的細胞較未經IL-1β預處理的細胞凋亡率明顯增高,差異有統計學意義;而在兩組沉默Fas基因的椎間盤細胞中,經IL-1β預處理的細胞較未經IL-1β預處理的細胞凋亡率增高幅度明顯減小,兩組的細胞凋亡率差異無統計學意義。同時,作者還發現,椎間盤細胞與FasL共培養,無論是否沉默Fas基因,其細胞凋亡率和對照組比較均有升高,而未沉默 Fas基因的椎間盤細胞凋亡率升高更明顯;使用RT-PCR和Western blot分別在mRNA 和蛋白兩個水平檢測到Fas的表達變化與椎間盤細胞的這種凋亡率具有明顯相關性。但是,本研究顯示,用10 ng/ml IL-1β和陰性對照siRNA轉染的大鼠椎間盤細胞進行共培養,在8 h時Fas mRNA和蛋白檢測卻都沒有發現明顯上調;而與FasL共培養后,椎間盤細胞的Fas表達反而升高。這一現象表明椎間盤細胞在經IL-1β預處理后的確增加了對FasL應答的敏感性,但導致這種凋亡敏感性增加的確切機制尚不明確。該結果同時也再次驗證了FasL具有上調椎間盤細胞凋亡受體Fas表達的作用[5]。
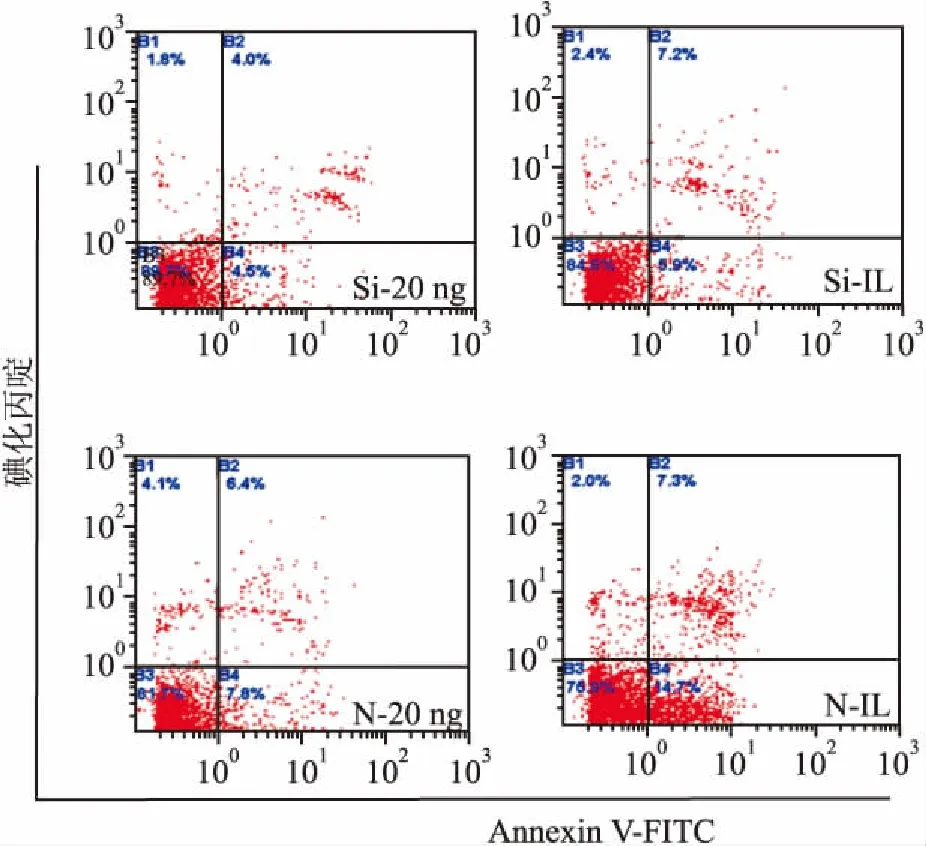
圖5 流式細胞儀檢測FasL對轉染細胞凋亡率的影響
表2 流式細胞儀測定細胞凋亡率
與N組比較:*P<0.05;與Si-IL組比較:#P<0.05
實驗中通過對Fas mRNA和蛋白表達結果檢測雖未能完全明確經IL-1β預處理后增加了對FasL應答敏感性的確切機制。但這一結果提示了IL-1β可能是通過改變Fas受體的應答狀態而不是上調Fas受體的表達而增加椎間盤細胞對FasL凋亡應答敏感性的,正是這種Fas受體應答狀態的變化導致了椎間盤細胞在低水平的FasL作用下就會產生高水平的凋亡。而后期細胞凋亡的增加則是凋亡受體Fas表達增加的原因,因為FasL本身就具有上調Fas表達的作用。但這種凋亡敏感性可被Fas-siRNA所抑制。這就為利用RNA干擾的方法抑制椎間盤退變性疾病提供了可能。
Fas的表達易受各種因素影響,異常機械應力、過度負荷、創傷等均可上調Fas的表達水平從而增加了椎間盤細胞的過度凋亡[10-12]。綜合以前研究結果顯示,IL-1β不僅能夠上調Fas的表達水平,而且可以改變Fas受體應答狀態,從而產生超常的凋亡作用,導致椎間盤組織中細胞數量的減少。本實驗從另一個側面說明了炎性環境對椎間盤細胞超常凋亡的加速作用[8]。減輕或者抑制椎間盤部位的炎性反應對延緩椎間盤退變可能有著重要作用。

