糞腸球菌膠原黏附素ace基因對生物被膜形成的影響
強 華, 宋立罡, 林任璽, 劉光英
腸球菌是常見的條件致病菌,許多醫院感染均與之密切相關。在腸球菌引起的感染中,許多部位如前列腺小管、口腔感染根管、心內膜炎瓣膜、細支氣管等均可觀察到腸球菌生物被膜的存在[1-2],表明細菌生物被膜的形成在腸球菌感染中起作用。對腸球菌生物被膜形成基因的探討成為腸球菌致病機制的研究方向之一。已有研究表明,腸球菌esp、明膠酶gelE、分選酶srt、fsr調節因子和ebpR等基因有利于糞腸球菌生物膜形成[3-7]。在臨床心內膜炎感染患者血清中膠原結合蛋白ACE抗體檢測率較高[8],ACE是糞腸球菌的表面黏附蛋白,是腸球菌的毒力因子之一。本研究通過微量滴定板法以及激光共聚焦顯微鏡(confocal laser scanning microscopy,CLSM)觀察比較糞腸球菌ace+、ace-菌株生物膜形成力的差別,探討糞腸球菌ace基因影響生物膜形成從而促進感染發生發展的致病機制。
1 材料與方法
1.1材料
1.1.1菌株及質粒 糞腸球菌野生株U8-ace-,分離自臨床泌尿道感染標本,PCR篩選鑒定ace基因陰性,藥敏實驗壯觀霉素敏感;糞腸球菌空質粒對照株EU8-ace-、糞腸球菌轉化株ZU8-ace+由本實驗室構建保存;pTEX5646質粒含整段ace基因、攜壯觀霉素抗性基因以及pAT 392穿梭質粒由美國德克薩斯大學Barbara E. Murray教授饋贈。
1.1.2試劑 質粒提取純化試劑盒(日本Takara生物工程公司);MH 肉湯(美國 Difco 公司);吖啶橙、溴化乙錠(美國Sigma公司)。35 mm培養皿、96孔微量滴定板(美國Corning Incorporated公司)。
1.1.3儀器 酶標儀(iMark680,美國BioRad公司);共聚焦激光掃描顯微鏡(LSM780,德國Zeiss公司)。
1.2方法
1.2.1糞腸球菌ace基因轉化株構建 通過 PCR 及藥敏實驗篩選ace陰性、壯觀霉素敏感的糞腸球菌原始株U8-ace-,采用簡便法制備糞腸球菌U8-ace-感受態細胞,通過電擊轉化方法,將pAT 392空質粒以及pTEX5646質粒(含整段ace基因,攜壯觀霉素抗性基因以及pAT 392穿梭質粒)分別轉入糞腸球菌U8-ace-感受態中,電擊混合液在含壯觀霉素的選擇培養基上培養,挑選菌落進行PCR、測序等鑒定,獲得空質粒對照株EU8-ace-,轉化株ZU8-ace+。
1.2.2糞腸球菌ace基因陽性、陰性菌株不同溫度下早期黏附能力比較 各取野生株U8-ace-,空質粒對照株EU8-ace-,轉化株ZU8-ace+菌液(1×107CFU/mL),接種到96孔微量滴定板,每菌株24孔,每孔100 μL,分別于37 ℃和46 ℃下孵化6 h,吸去菌液,PBS 輕柔沖洗3次,洗去浮游細菌,0.1%番紅染色30 min,倒置、干燥,用酶標儀測定孔板底部OD595值。
1.2.3微量滴定板法比較糞腸球菌ace基因陽性、陰性菌株生物被膜形成能力[9-10]將U8-ace-,EU8-ace-,ZU8-ace+菌液(1×107CFU/mL)加入96孔細胞培養板中,每孔200 μL,46 ℃培養3,6,12,24,36及48 h,各點培養5孔,設1孔PBS空白對照。吸去培養液,PBS緩沖液洗去浮游細菌,甲醛固定,結晶紫染色15 min,PBS緩沖液沖洗,80∶20乙醇-丙酮溶解結晶紫,測定各孔OD570值,每孔測3次。生物被膜形成力評價標準[6]:未形成生物膜:OD570≤0.5;生物膜形成力弱:0.5
1.2.4CLSM觀測比較糞腸球菌ace基因陽性、陰性菌株生物被膜 將20 mm×20 mm滅菌玻片放入35 mm細胞培養皿內,將U8-ace-,EU8-ace-,ZU8-ace+菌液1 mL(菌密度5×106CFU/mL)分別滴至玻片表面,靜置1 min,加入BHI培養液1.5 mL,封口膜封閉,46 ℃分別培養6,12,18,24,48及72 h,各點培養5個標本。棄培養液,PBS沖洗浮游菌,在蓋玻片表面滴加100 μL AO/EB染液,于暗室孵育15 min,滅菌PBS沖洗2次后用吸水紙吸干水分,用透明指甲油密封。置于CLSM下觀察并收集圖像。CLSM觀察條件:氬激光514/488 nm,物鏡×20。生物膜標本由內(生物膜與玻片相貼的一面)向外(生物膜游離的一面)沿Z軸逐層掃描,得到生物膜的斷層掃描圖象。取最外一層和玻片之間的距離測量生物膜厚度。生物膜的細菌密度和活菌比例計算選用斷層掃描圖象中間一層的數據進行分析。CLSM斷層掃描圖象中的熒光量表示生物膜內細菌密度。生物膜活菌比例=綠熒光量/(綠熒光量+紅熒光量)[10]。
2 結 果
2.1糞腸球菌ace基因陽性、陰性菌株不同溫度下早期黏附能力比較 分別取野生株U8-ace-,空質粒對照株EU8-ace-,轉化株ZU8-ace+菌液于37 ℃和46 ℃培養后,測定初步黏附能力OD595[11],單因素方差分析。結果表明,野生株U8-ace-、空質粒對照株EU8-ace-37 ℃培養與46 ℃培養的早期黏附OD595值比較,差別無統計學意義(P>0.05);轉化株ZU8-ace+于37 ℃與46 ℃培養的早期黏附OD595值比較,差別有統計學意義(P<0.01)。實驗表明,46 ℃體外條件下培養,ace轉化變異株或表達ACE蛋白,更有利糞腸球菌的早期黏附(表1)。
表137 ℃,46 ℃下野生株U8-ace-與轉化變異株ZU8-ace+早期黏附OD595值比較
Tab 1The initial adhesionOD595values of wild strains and transformants at 37 ℃,46 ℃
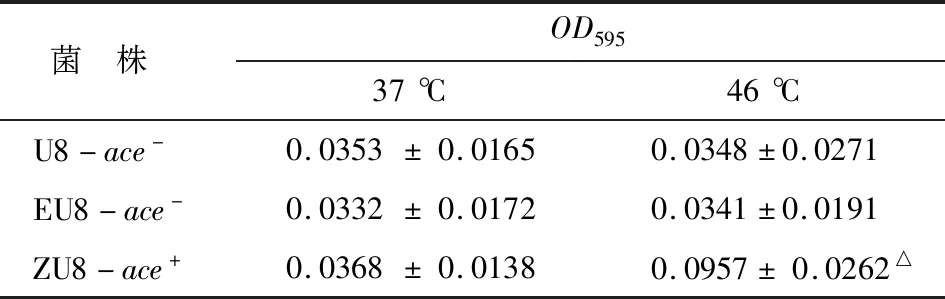
菌 株OD59537℃46℃U8-ace-0.0353±0.01650.0348±0.0271EU8-ace-0.0332±0.01720.0341±0.0191ZU8-ace+0.0368±0.01380.0957±0.0262△
與37 ℃OD595值比較,△:P<0.01.
2.2糞腸球菌ace基因陽性、陰性菌株生物被膜形成能力比較 微量滴定板法比較腸球菌野生株U8-ace-、空質粒對照株EU8-ace-、轉化株ZU8-ace+生物被膜形成能力,各菌株的生物被膜形成能力隨培養時間延長而提高,糞腸球菌轉化株ZU8-ace+在各時段的生物膜形成能力均比野生株U8-ace-、空質粒對照株EU8-ace-的強。經單因素方差分析,ZU8-ace+與U8-ace-比較,差別有統計學意義(P<0.01);EU8-ace-與U8-ace-比較,差別無統計學意義(P>0.05,圖1)。
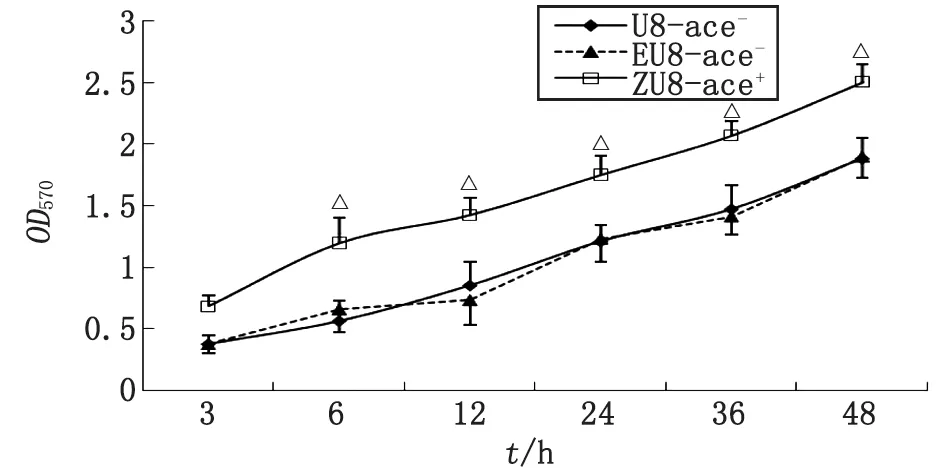
ZU8-ace+與U8-ace-比較,△:P<0.01.圖1 ace+,ace-糞腸球菌體外生物膜形成能力Fig 1 The biofilm formation ability of ace+,ace- E.faecalis in vital
2.3CLSM觀測比較糞腸球菌ace基因陽性、陰性菌株生物被膜情況
2.3.1ace+,ace-糞腸球菌生物被膜平均厚度比較 在生物被膜形成各階段,糞腸球菌轉化株ZU8-ace+所形成生物膜的平均厚度均高于野生株U8-ace-,經單因素方差分析,ZU8-ace+與U8-ace-比較,差別有統計學意義(P<0.01);EU8-ace-與U8-ace-比較,差別無統計學意義(P>0.05,圖2)。
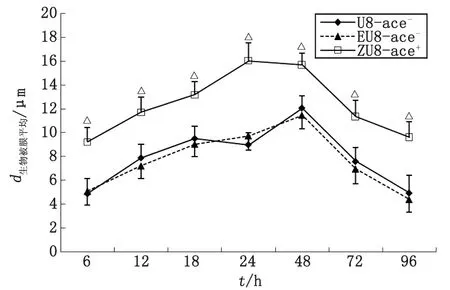
ZU8-ace+與U8-ace-比較,△:P<0.01.圖2 ace+,ace-糞腸球菌生物被膜在各階段的平均厚度Fig 2 The average thickness of ace+,ace-E.faecalis biofilm at different stages
2.3.2ace+,ace-糞腸球菌生物被膜中層內細菌密度比較 生物膜內層、中間層的細菌密度相對較大,而外層較低。取生物膜中層進行糞腸球菌轉化株ZU8-ace+與野生株U8-ace-生物被膜密度比較,結果表明,糞腸球菌轉化株ZU8-ace+所形成的生物被膜密度比野生株U8-ace-的高,經單因素方差分析,ZU8-ace+與U8-ace-比較,差別有統計學意義(P<0.01);EU8-ace-與U8-ace-比較,差別無統計學意義(P>0.05,圖3)。
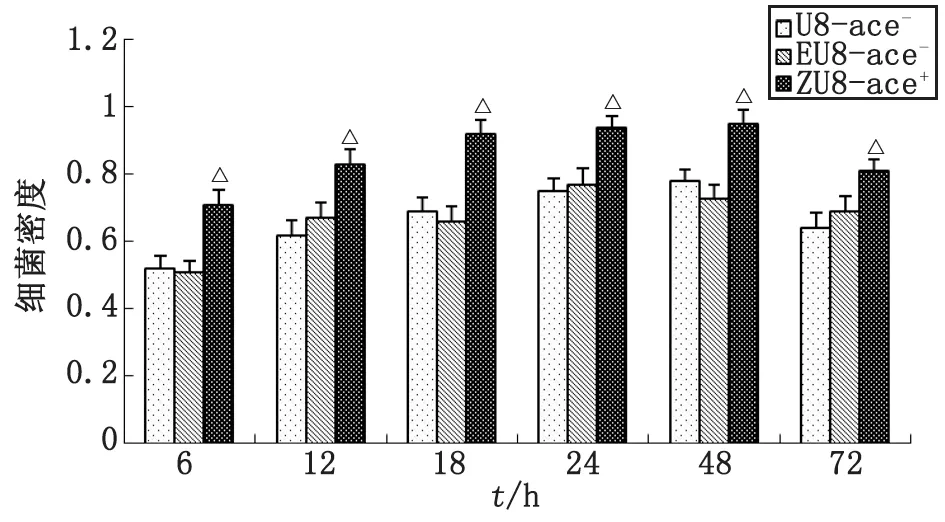
ZU8-ace+與U8-ace-比較,△:P<0.01.圖3 ace+,ace-糞腸球菌生物被膜中層細菌密度Fig 3 The bacterial density of ace+,ace- E.faecalis biofilm at intermediate layer
2.3.3ace+,ace-糞腸球菌生物被膜內活菌比例比較 取生物膜中層比較糞腸球菌轉化株ZU8-ace+與野生株U8-ace-生物被膜的活菌比例,結果表明,糞腸球菌轉化株ZU8-ace+生物被膜活菌比例高于野生株U8-ace-,經單因素方差分析,ZU8-ace+與U8-ace-比較,差別有統計學意義(P<0.01);EU8-ace-與U8-ace-比較,差別無統計學意義(P>0.05,圖4)。
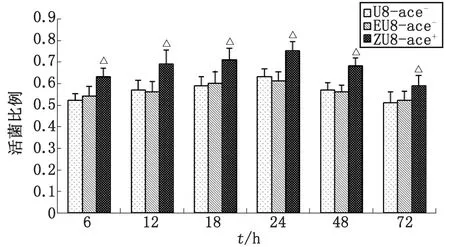
ZU8-ace+與U8-ace-比較,△:P<0.05.圖4 ace+,ace-糞腸球菌生物被膜中層活菌比例Fig 4 The proportion of viable bacteria of ace+,ace- E.faecalis biofilm at intermediate layer
3 討 論
腸球菌膠原結合蛋白是腸球菌表面黏附素,與金黃色葡萄球菌CAN膠原蛋白黏附素高度同源,為MSCRAMM家族成員,可以介導糞腸球菌黏附細胞外的基質蛋白,如層黏連蛋白、膠原蛋白Ⅱ及膠原蛋白Ⅳ等[12]。Singh等的研究表明,ACE抗體在腸球菌心內膜炎患者的血清中檢出率高,ACE蛋白在體內感染表達較普遍,但體外糞腸球菌ACE蛋白表達的溫度與體內有差別。體外條件下,絕大多數糞腸球菌于46 ℃培養有利于表達ACE蛋白[11,13]。本研究表明,野生株及空質粒對照株在37 ℃培養的早期黏附值與46 ℃培養的比較,差別無統計學意義(P>0.05),而ace+轉化株于46 ℃培養的早期黏附值比37 ℃培養的大(P<0.01),說明46 ℃體外條件下,ace轉化變異株表達了ACE蛋白,有利于糞腸球菌早期黏附,也支持這一結論。
細菌黏附是細菌感染宿主的第一步,在腸球菌毒力因子研究中,對黏附素的研究近年來較為廣泛。同時,細菌生物被膜在感染致病中的意義也越來越受重視。腸球菌生物被膜的形成在呼吸道感染、泌尿道感染尤其是留置管相關泌尿道感染、感染性心內膜炎等醫院感染中都具有重要意義。強華等報道糞腸球菌心內膜炎抗原EfaA有利于細菌生物被膜形成[5],其他黏附素如腸球菌膠原結合蛋白ACE是否有利于細菌生物被膜的形成未見報道。本研究結果表明,在CLSM觀察下,ace+糞腸球菌在不同培養時間點所形成的生物膜厚度、生物膜細菌密度以及生物膜活菌比例均高于ace-菌;微量滴定板法測定生物膜形成能力,各培養時間點ace+轉化株的OD570值均大于ace-野生株,而ace-空質粒轉化對照株與ace-野生株比較,差別無統計學意義,提示糞腸球菌膠原黏附素ace基因有利于腸球菌體外生物被膜的形成,可為體內動物模型生物被膜形成的研究提供相互驗證。腸球菌膠原蛋白黏附素有促進細菌黏附細胞外基質蛋白的作用[14],該黏附素也有可能增強細菌間黏附能力從而促進生物被膜的形成。研究認為,腸球菌ace基因在大鼠心內膜炎模型以及泌尿道感染模型中具有毒力作用[8,15]。本研究進一步探討了糞腸球菌ace基因與生物被膜形成的相關毒力機制,為腸球菌生物被膜研究及腸球菌泌尿道、呼吸道感染等醫院感染的防治提供新思路。

