顱骨缺損修補術后并發惡性腦水腫1例
吳佳橋,段宗生,孫艷平,李建云,王虎山
(吉林大學第一醫院 麻醉科,吉林 長春130021)
1 臨床資料
1.1 患者資料
患者:男,24歲,因車禍后右側肢體活動不靈伴言語障礙3月余入院,頭核磁示:左側額顳頂顱骨局部缺損,腦組織外膨;左側額顳葉、島葉、基底節區缺血,部分呈亞急性期表現;伴左側頸內動脈顱內段閉塞;鼻竇炎。并于2016年06月29日行“去骨瓣減壓術”,術后患者清醒,遺留右側肢體運動障礙及言語障礙,后行系統康復物理治療近2月,病情好轉。遂于2016年11月14日于全麻下行“顱骨缺損修補術”,術后病人意識朦朧,無明顯自主呼吸,入ICU科給予有創呼吸機輔助通氣、抗感染、保護臟器及對癥支持治療。并于2016年11月15日急診全麻下行“左側額顳頂部去骨瓣減壓術”。患者術中核磁顯示右側小腦半球、左側額顳頂葉伴多發異常信號,腦梗死或腦水腫有待鑒別;術中MRA示左側頸內動脈、左側大腦中動脈細且顯影不清晰,左側大腦中動脈分支顯示不清(圖1)。術中MRV示左側橫竇、乙狀竇及上矢狀竇前1/3細且顯影不清晰(圖2)。
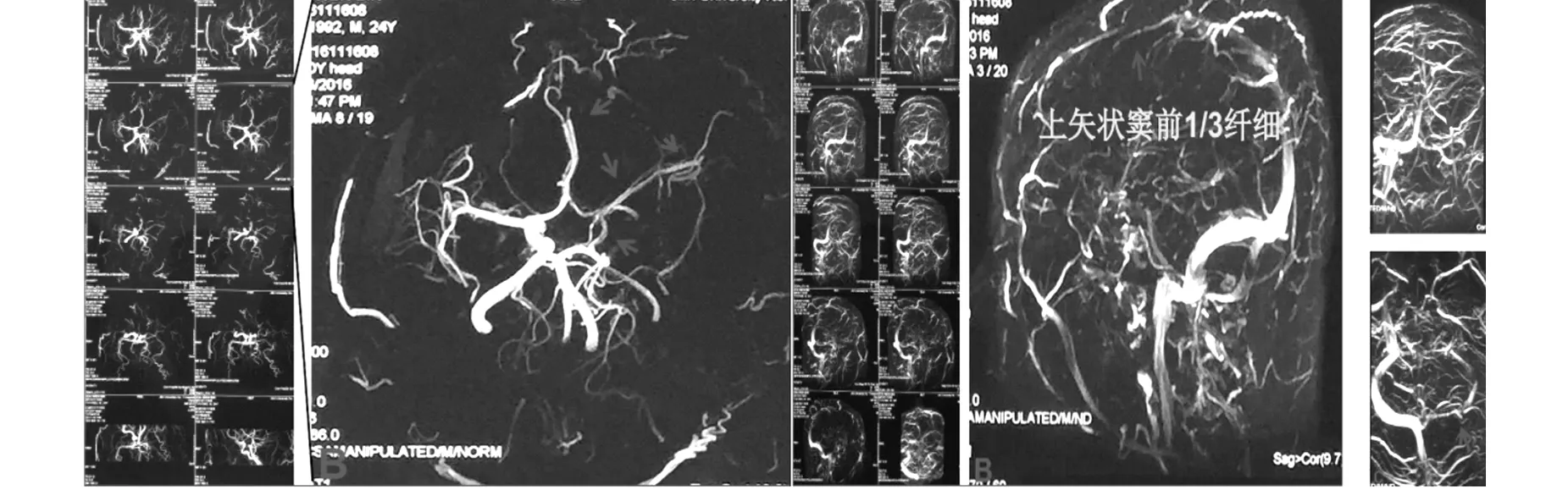
圖1左側頸內動脈、左側大腦中動脈細且顯影不清晰,圖2左側橫竇、乙狀竇及上矢狀竇前1/3細且顯左側大腦中動脈分支顯示不清影不清晰
1.2 麻醉方法
患者帶管入室,入室無創血壓131/78 mmHg,脈搏110次/分,外周血氧飽和度99%。監護儀心電圖提示正常竇性起搏心律。在患者右上肢開放靜脈通道立即滴注晶體液醋酸鈉林格注射液。麻醉誘導:1%丙泊酚120 mg(2 mg/kg),芬太尼0.2 mg(0.03 mg/kg),順式阿曲庫銨10 mg(0.15 mg/kg)。呼吸機行容量控制通氣模式:潮氣量8 ml/kg,氣體流量2 L/min,呼吸頻率10-16次/分,氧氣和空氣混合氣,氧氣濃度50%,維持氣道峰壓16-20 cmH2O,呼吸末CO2分壓在30-35 mmHg。置入7.5號氣管插管[1]。麻醉維持:濃度為2%的七氟烷術中持續吸入,右美托咪啶4 μg/(kg·h),2%丙泊酚6 mg/(kg·h),每20 min給予0.03 mg/kg的順式阿曲庫銨。術中血壓波動不明顯,血壓維持在110-120/50-70 mmHg之間,心率變化在 60-80次/分,外周血氧飽和度為98%-100%,手術中心電圖未顯示異常。手術歷時2 h,術中輸注晶體液約1 500 ml,出血量100 ml,尿量300 ml。術畢患者行機械通氣3 h,仍未恢復自主呼吸,但意識朦朧、呼喚可睜眼。遂帶氣管插管回到神經外科監護室。術后18 h測血壓125/68 mmHg,心率101次/分,淺昏迷狀態,無自主呼吸,瞳孔直徑右側3.0 mm,左側4.0 mm,直接及間接對光反射遲鈍,疼痛刺激左側肢體可動,右側肢體少動。硬膜外引流通暢,引流出血性液體約100 ml。由于患者長時間未恢復自主呼吸,遂擬將鈦網取出,手術過程順利,患者生命體征維持平穩。鈦網取出術后血壓135/75 mmHg,心率110次/分,呼吸機輔助呼吸,自主呼吸弱,潮氣量約350 ml,頻率6次/分。間斷躁動,給予丙泊酚聯合芬太尼鎮靜、鎮痛。查體瞳孔直徑右側2.0 mm,左側3.0 mm,光反射遲鈍。術后第3天患者自主呼吸恢復,意識逐漸清晰,雙側瞳孔等大同圓,光反射靈敏,給予試脫機。術后第6天患者自主呼吸恢復,神志清楚,可回答簡單問題,遂拔除氣管插管。術后17天隨訪,患者意識清楚,語言欠流利,雙側瞳孔等大同圓約3.0 mm,對光反射靈敏,右側鼻唇溝淺,右側肢體肌力Ⅲ級,左側肌力Ⅴ級,在他人攙扶下可行走。
2 討論
顱骨修補術后發生了彌漫性腦水腫是非常罕見的,對甘露醇聯合地塞米松的治療反應很差。腦水腫可以在修補術后立即發生,也可以在術后7天之內發生[2],這種并發癥的發病機制目前還未確定。可能與植骨術術后凹陷處顱內負壓的消失導致大量腦組織向植骨部位移位進而產生致命性的血管緊張性反應和大腦自動調節功能障礙有關。同時,腦室腹腔分流術、腦血管畸形、腦腫瘤、腫瘤囊腫及感染可能也是其危險因素。
中樞神經系統發生急性損傷時,首先活躍的是腦血管內皮細胞、星形膠質細胞中的離子通道和轉運蛋白,從而導致異常的離子轉運和異常滲透力的產生,最終表現為腦水腫和腦腫脹[3]。目前可分為細胞毒性水腫和血管源性水腫兩類[3]。在缺血,創傷,低血糖,癲癇持續狀態和暴發性肝衰竭等損傷中,中樞神經系統受損,星形膠質細胞對損傷快速作出反應,引起Na+、Cl-和水等滲透物在細胞內聚集,形成細胞毒性水腫[4]。滲透物的流入是靠主動轉運或二次轉運提供能量的,主動轉運主要是靠Na+-K+-ATP酶和Ca2+-ATP酶介導,而二次轉運主要是靠離子通道和共轉運蛋白如Na+-K+-Cl-共轉運蛋白和Na+-Ca2+交換劑介導的。在許多類型的中樞神經損傷之后,細胞內ATP被消耗,因此,獨立于細胞內ATP的機制,如二級轉運,更可能與離子水腫的形成相關[5]。
血管源性水腫是一種細胞外水腫,其特征在于血腦屏障的完整性被破壞,形成跨內皮通透性孔隙,允許水和血漿蛋白外滲到腦間質中。與出血不同的是,在血管源性水腫期間毛細血管結構是完整的,從而禁止紅細胞通過,因此,血管源性水腫被視為無細胞血液(即血漿)的濾過。血管源性水腫主要由靜水壓力和滲透壓力梯度決定,其中靜水壓力是血管源性水腫形成的主要驅動力。靜水壓梯度的決定因素,如顱內壓,全身血壓,毛細血管閉塞和血管痙攣,對血管源性水腫動力學很重要;滲透壓梯度的決定因素,包括所有滲透活性分子,如Na+和蛋白質,也會影響水通量[3]。
手術前的準備:對于去骨瓣減壓術術后需要植骨的患者,術后可能會出現頭暈、頭痛、情緒改變甚至癲癇、偏癱等癥狀[6],如果術前患者有大面積腦梗塞,需外科大夫評估術后發生腦腫脹的風險,建議植骨術前進行相關腦血管影像學檢查。早期預測惡性腦水腫發生的風險對于改善疾病預后有重要意義。2008年的一篇Meta分析提出可預測惡性腦水腫發生的影響因素,其中首位的是腦梗死面積,其次是血管因素,血管因素中影響最大的是大腦中動脈,其他因素包括年齡、低灌注、出血等。術前可以進行一些影像學檢查以預測惡性腦水腫的發生,MRI彌散加權成像(DWI)是判斷腦水腫的有效方法,但因MRI掃描不如CT普及,而且費用貴,耗時長,因此一般不作為預測腦水腫的首選。因此,我們可以使用CT平掃及CTA,CTA可用于預測急性腦梗死并發惡性腦水腫,為早期識別惡性腦水腫提供影像依據[7]。Horstmann等人研究發現,經顱多普勒超聲檢查結果和CT結果之間有密切的聯系,而超聲檢查無創又價格適宜,可以作為常規術前預測腦水腫的影像學檢查[8]。麻醉醫師也應做好充足的術前準備,在術前訪視患者時應密切關注患者的生命體征,評估患者的呼吸、循環功能及對手術的耐受能力,與家屬進行充分的溝通,制定嚴密的個體化麻醉方案。
麻醉方式的選擇和處理:我們選擇了靜吸復合、氣管插管全身麻醉方式,該患者對于麻醉藥沒有特殊反應。從這1例患者中總結出一些麻醉經驗,例如,全身血壓特別是收縮壓必須保持足夠高以維持腦灌注,但過高會促進腦出血的發生,此外,顱內壓必須保持足夠低以維持組織灌注,但又需要足夠高以抵消水腫。因此為預防插管時的顱內壓急劇增高和產生的相應心血管反應,我們麻醉誘導時緩慢給藥,充分去氮給氧,使用了足量的芬太尼和非去極化肌松藥、用喉麻管以2%利多卡因行舌根及咽喉部表面麻醉等多種方式,使插管前后心率、血壓等心血管反應變化不明顯,從而避免了顱內壓的急劇增高。在麻醉過程中,我們始終保持PaCO2維持在30-35 mmHg,過度通氣雖然有利于緩解顱內壓,但若PaCO2降低過多,可致腦血管收縮,腦血流量減少,進而增加了腦缺血的可能,因此PaCO2不適宜過低。此次手術時間短,術中少量失血,平均動脈壓保證在65 mmHg以上,保證了腦血流的自主調節機制,避免了腦缺血的發生。若外科醫生開顱后認為需要降低顱內壓,我們準備了靜脈輸入甘露醇來達到脫水降低顱內壓的目的。
彌漫性腦腫脹目前尚無統一的治療標準和良好的預防方法,而惡性腦水腫的死亡率極高。這些年治療措施主要是脫水降低顱內壓及外科行去骨瓣手術減壓治療。因此我們需要更透徹的了解腦水腫的病理生理機制,如果可以研究出以腦水腫形成為生物靶點的藥物來預防腦水腫的形成,將會形成新的突破[9],可以嘗試以發揮作用的離子通道和蛋白酶作為生物靶點。有研究證明,貝伐單抗可治療難治性腦水腫,有效率為84.74%[9]。而外科醫生可以通過積極的擴大去骨瓣減壓術治療,這對麻醉方式的選擇和麻醉管理有一定的要求。因此麻醉醫師在術前,應和外科醫生有個充分的溝通,并做好術前評估[10],制定一個個體化的麻醉方案,合理使用誘導及維持藥物,及時處理術中出現的異常情況,維持呼吸、循環功能的穩定,還可以對體溫等進行監測,例如術中可以全程使用保溫硅膠床墊。有研究提出,先天性的顱內血管異常也有可能是誘發因素,所以術前能準確判斷患者血管結構,對術后惡性腦水腫的發生有很好的預防作用。我們可以從血清標記物、神經影像學、神經保護劑等多方面綜合考慮,為惡性腦水腫的早期診斷及治療提供新的方法[3]。

