銀杏內酯B對外傷后神經細胞凋亡Omi/HtrA2信號通路影響的實驗研究
陳方慧 王 弋 方金燕 吳澤生 陳子晞 謝 贇 肖 晨 趙 雪
銀杏內酯B (ginkgolide B,GB) 是銀杏葉的主要提取物,對血小板活化因子具有明顯的拮抗作用,已用于治療血栓形成、急性胰腺炎和心血管疾病等疾患[1]。GB可顯著抑制神經細胞凋亡,但具體機制尚不明確[2]。Omi/HtrA2是一種由線粒體產生并可進入細胞質的絲氨酸蛋白酶。X染色體連鎖凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)是內源性的caspases抑制物;而Omi/HtrA2通過降解XIAP來增強caspase活性從而參與線粒體凋亡途徑發揮致凋亡作用[3~6]。線粒體Omi/HtrA2信號通路參與大鼠膿毒癥性腦病、幼鼠癲癇持續狀態和大鼠腦缺血/灌注損傷中的神經細胞凋亡過程[7~9]。但目前少有研究揭示該信號途徑在顱腦損傷后神經細胞凋亡中的作用。本研究檢測顱腦損傷大鼠海馬組織細胞凋亡,觀察Omi/HtrA2通路上XIAP、pro-caspase 3和pro-caspase 9等蛋白的表達及GB的干預作用,從而揭示大鼠顱腦損傷后Omi/HtrA2介導的神經細胞凋亡線粒體途徑的激活及GB抗神經細胞凋亡的信號通路。
材料與方法
1.材料:健康Wistar大鼠(南京大學模式動物研究所,雄性,清潔級);GB(規格:10mg,批號:15291-77-7,上海諾辰生物技術有限公司);BCA蛋白定量試劑盒(批號:23256,美國Thermo Scientific公司);TUNEL試劑盒(批號:TUN11684817,北京嘉美紐諾生物科技有限公司);caspase-3和caspase-9底物(批號:T9281、T9275,美國Livemore公司);轉印槽(型號:Trans-Blot,美國Biorad公司);電泳儀(型號:BG-caTANK,北京百晶生物技術有限公司);小型垂直電泳槽(型號:164-8001,美國Biorad公司);脫色搖床(型號:RCK 2D 200,上海達姆實業有限公司);生物倒置顯微鏡(型號:IX-71,中國奧林巴斯有限公司);低溫高速離心機(型號:TD4,鹽城凱特實驗儀器設備有限公司);熒光分光光度儀(型號:B-500,上海元析儀器有限公司)。
2.方法:本實驗設立假手術組、腦外傷組和治療組,隨機分配30只大鼠,每組10只。大鼠腹腔注射戊巴比妥鈉(50mg/kg)麻醉后,取右側冠狀縫后1mm和中線旁開2mm為撞擊位點,切開頭皮后,鉆直徑5mm骨孔一枚,采用Feeney自由落體損傷裝置,選擇40g重擊錘從25cm處自由墜落沖擊撞桿,打擊深度5mm,縫合頭皮。腦外傷組和治療組大鼠按上述標準制作大鼠顱腦損傷模型,假手術組大鼠切開頭皮但未作自由落體打擊。模型形成前0.5h,治療組大鼠予以20mg/(kg·d) GB腹腔注射,其余兩組大鼠腹腔注射1ml 0.9%氯化鈉溶液,均連續用藥3天。在第3天,取大鼠以80mg/kg戊巴比妥鈉腹腔注射深度麻醉后斷頭處死,分離海馬組織。假手術組、腦外傷組和治療組3天內死亡大鼠依次是1、2和2只。大鼠死亡后補充成活大鼠,保證每組10只大鼠。3組大鼠病死率比較,差異無統計學意義(χ2=0.516,P=0.773)。
3.細胞凋亡檢測: 采用石蠟包埋大鼠海馬組織,切取厚約4μm切片,按照說明書采用TUNEL法檢測海馬組織神經細胞凋亡。凋亡神經細胞為細胞核呈現棕黃色或棕紅色。在光學顯微鏡下計算10個高倍鏡視野,每個視野計數100個細胞,總計1000個細胞,計算平均陽性率(%)。
4.蛋白表達的檢測:采用BCA法測定大鼠海馬組織蛋白濃度,采用Western blot法檢測大鼠海馬組織Omi/HtrA2、XIAP、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表達,結果用quality one軟件分析雜交條帶灰度值,以β-actin水平為內對照,比較相對灰度值。
5.蛋白活性的檢測:采用四肽熒光底物法檢測海馬組織caspase-3和caspase-9蛋白活性。采用熒光分光光度計,取激發波長400nm和釋放波長505nm處測定熒光強度。以未加腦組織時的熒光強度為參照值,計算熒光強度,最終比較相對熒光強度。

結 果
1.GB對大鼠海馬神經元凋亡的影響:由圖1和圖2可見,3組大鼠凋亡的海馬神經元比例比較,差異有統計學意義(F=157.806,P<0.01)。腦外傷組大鼠凋亡的海馬神經元比例較假手術組顯著升高(P<0.01),而治療組大鼠凋亡的海馬神經元比例較腦外傷組顯著下降(P<0.01)。
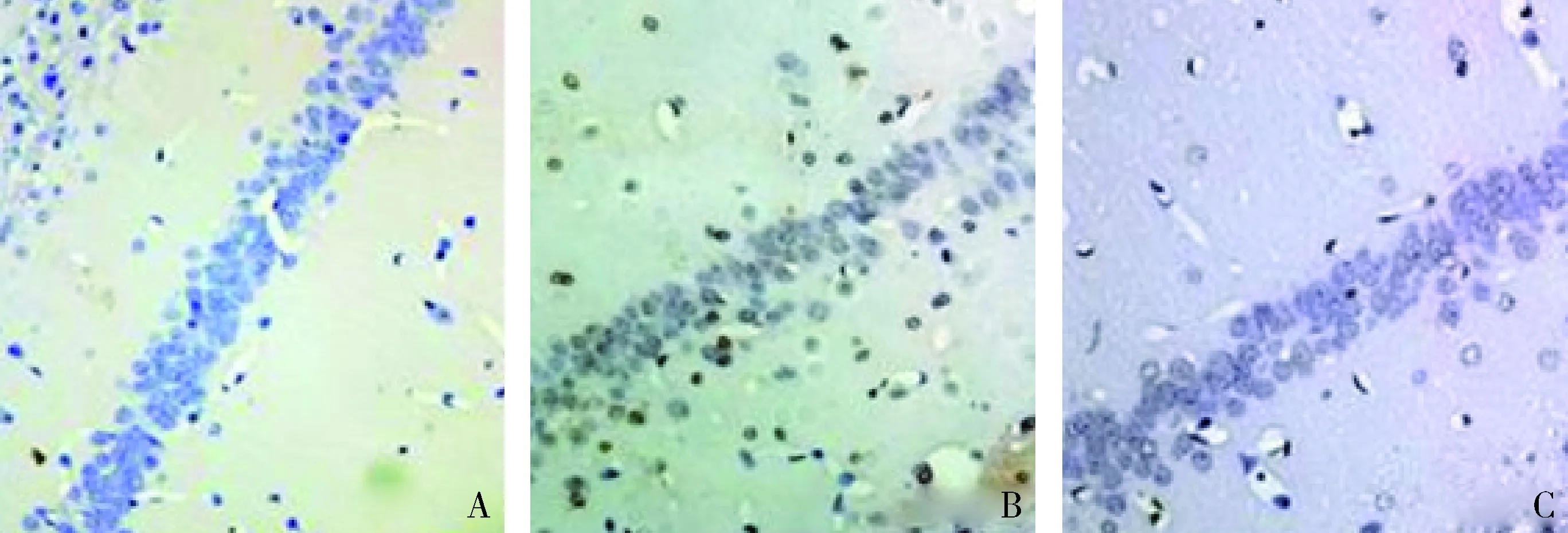
圖1 GB對大鼠海馬神經元凋亡的影響 (TUNEL,×100)A.假手術組;B.腦外傷組;C.治療組
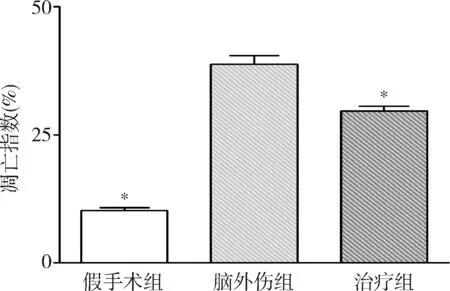
圖2 GB對大鼠海馬凋亡神經元比例的影響與腦外傷組比較,*P<0.01
2.GB對大鼠海馬組織Omi/HtrA2、pro-caspase-3、pro-caspase-9、剪切PARP 和XIAP蛋白表達的影響:由圖3~圖8可見,3組大鼠海馬組織Omi/HtrA2、pro-caspase-3、pro-caspase-9、剪切PARP 和XIAP蛋白表達比較,差異有統計學意義(F=85.538、104.546、89.650、63.168和53.096,P均<0.01)。腦外傷組大鼠海馬組織Omi/HtrA2、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表達均較假手術組顯著升高(P<0.01),腦外傷組大鼠海馬組織XIAP蛋白表達較假手術組顯著下降(P<0.01);治療組大鼠海馬組織Omi/HtrA2、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表達均較腦外傷組顯著下降(P均<0.01),治療組大鼠海馬組織XIAP蛋白表達較腦外傷組顯著升高(P<0.01)。
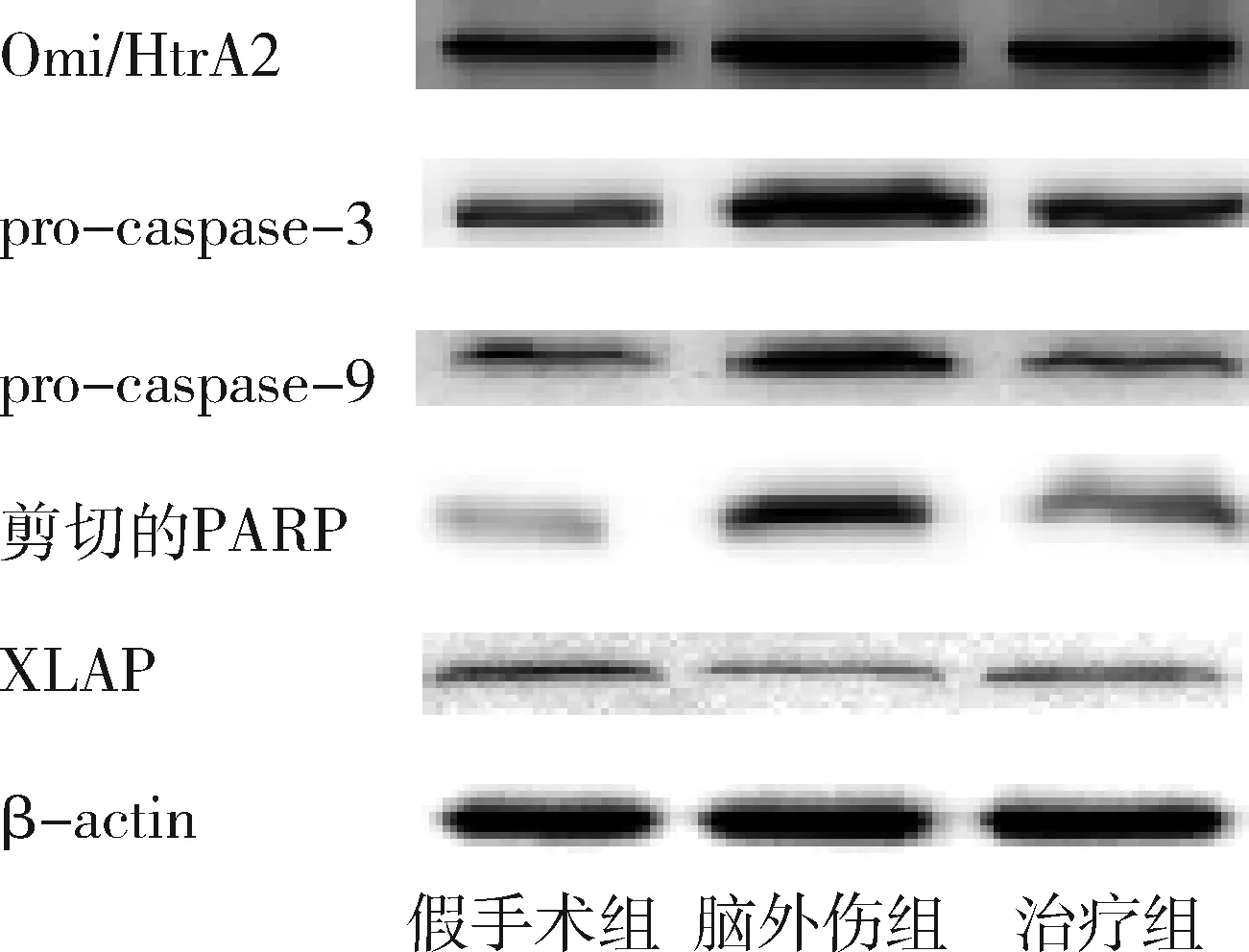
圖3 GB對大鼠海馬組織Omi/HtrA2、pro-caspase-3、pro-caspase-9、剪切PARP 和XIAP蛋白表達的影響
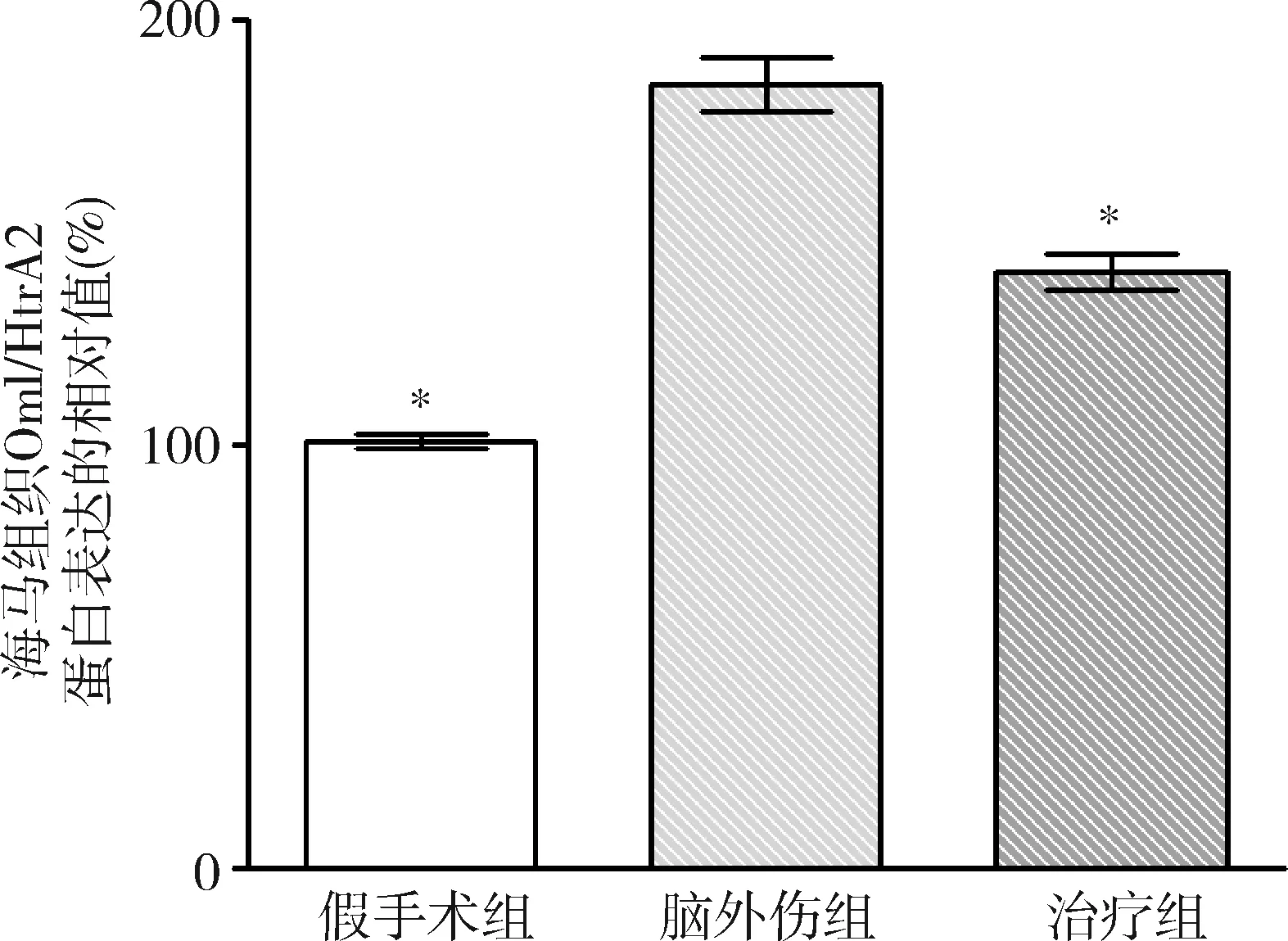
圖4 GB對大鼠海馬組織Omi/HtrA2蛋白表達相對值的影響與腦外傷組比較,*P<0.01
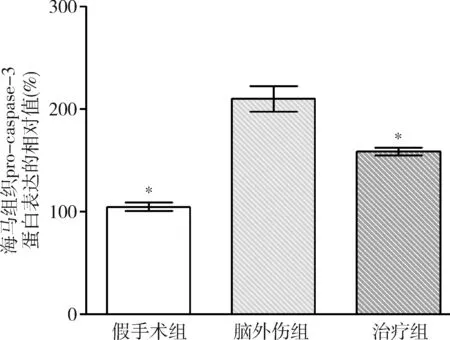
圖5 GB對大鼠海馬組織pro-caspase-3蛋白表達相對值的影響與腦外傷組比較,*P<0.01
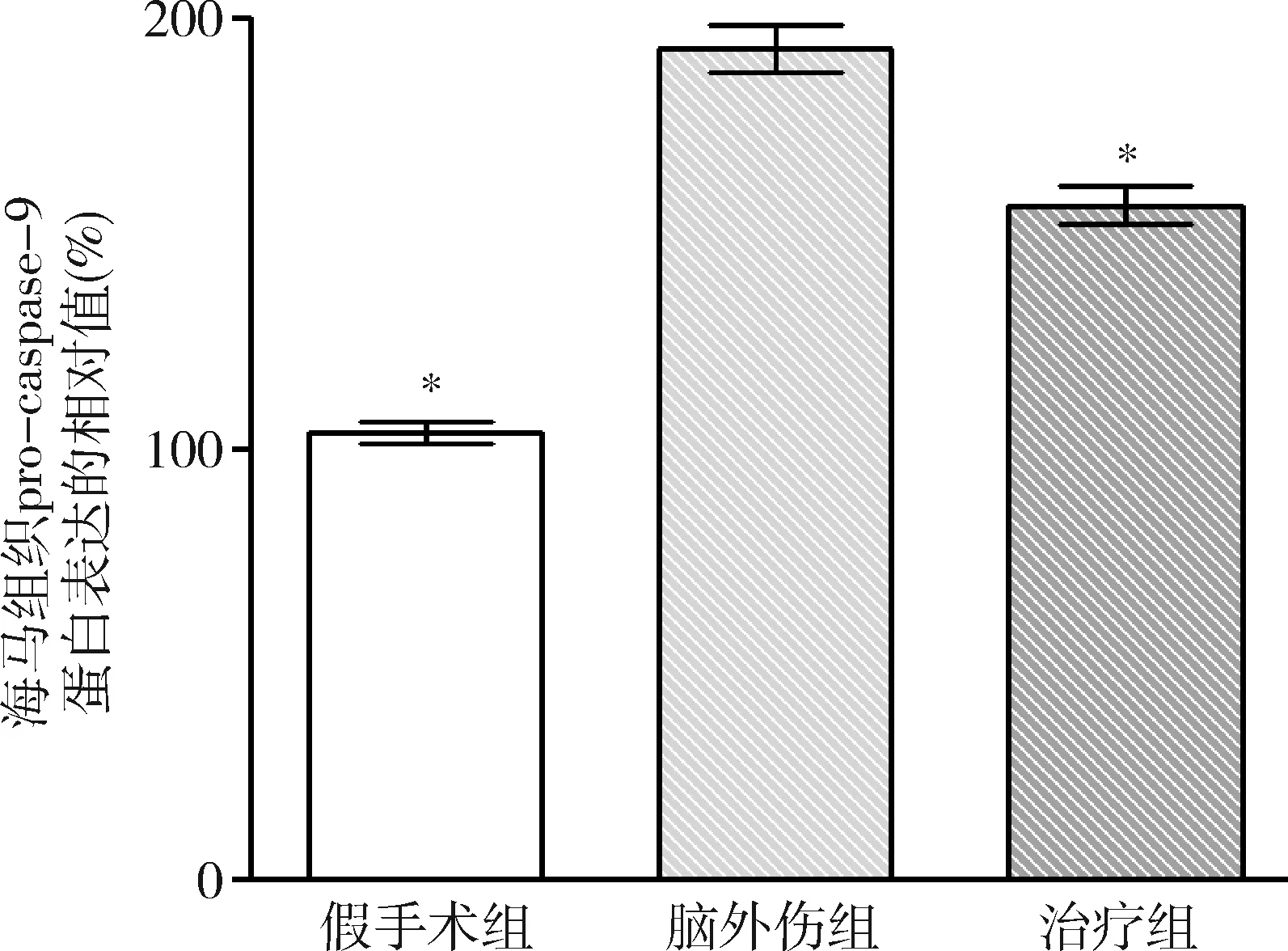
圖6 GB對大鼠海馬組織pro-caspase-9蛋白表達相對值的影響與腦外傷組比較,*P<0.01
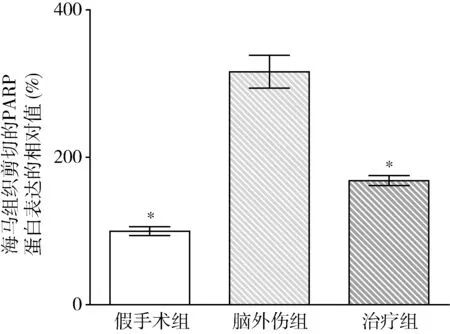
圖7 GB對大鼠海馬組織剪切的PARP蛋白表達相對值的影響與腦外傷組比較,*P<0.01
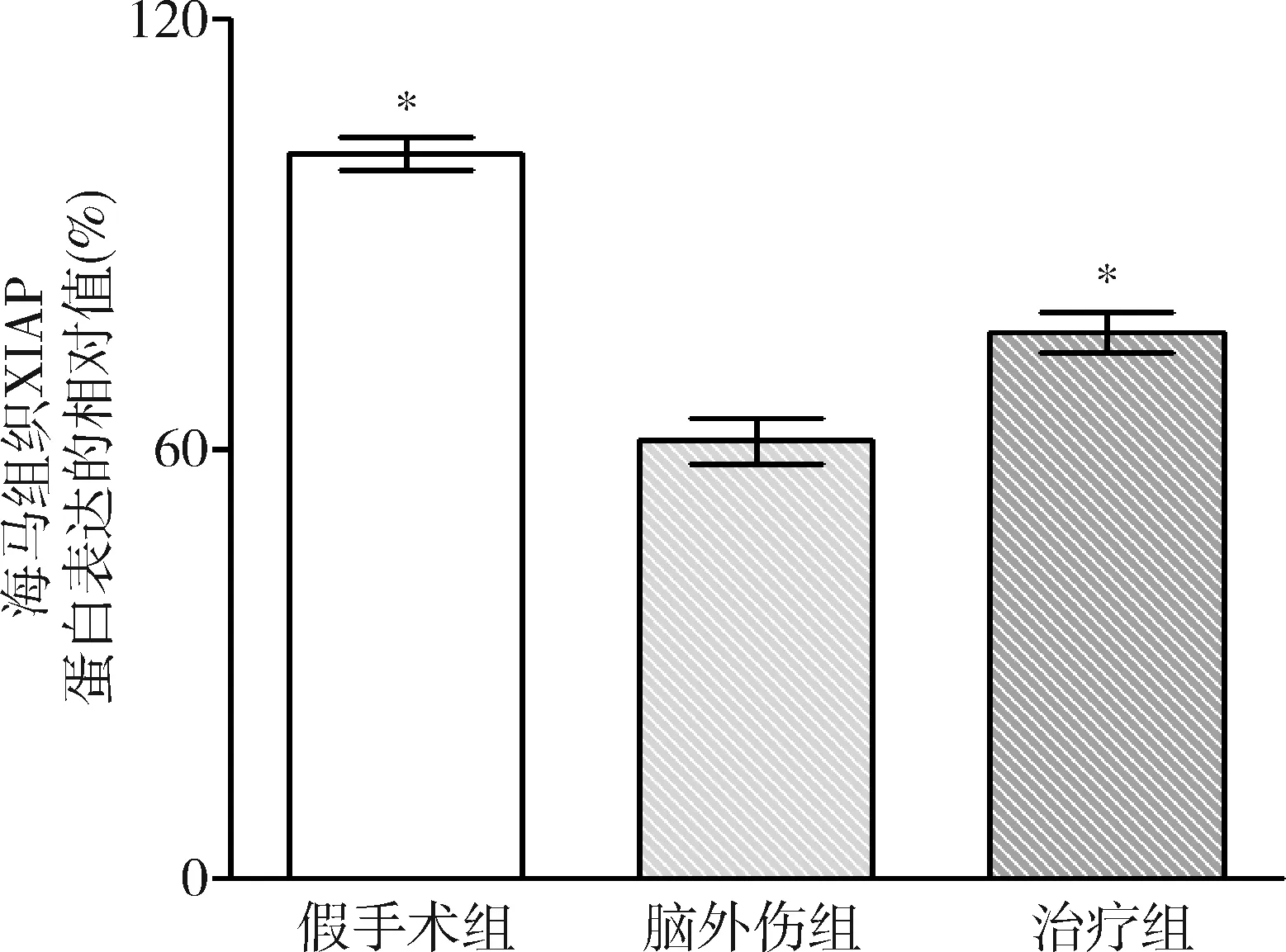
圖8 GB對大鼠海馬組織剪切的XIAP蛋白表達相對值的影響與腦外傷組比較,*P<0.01
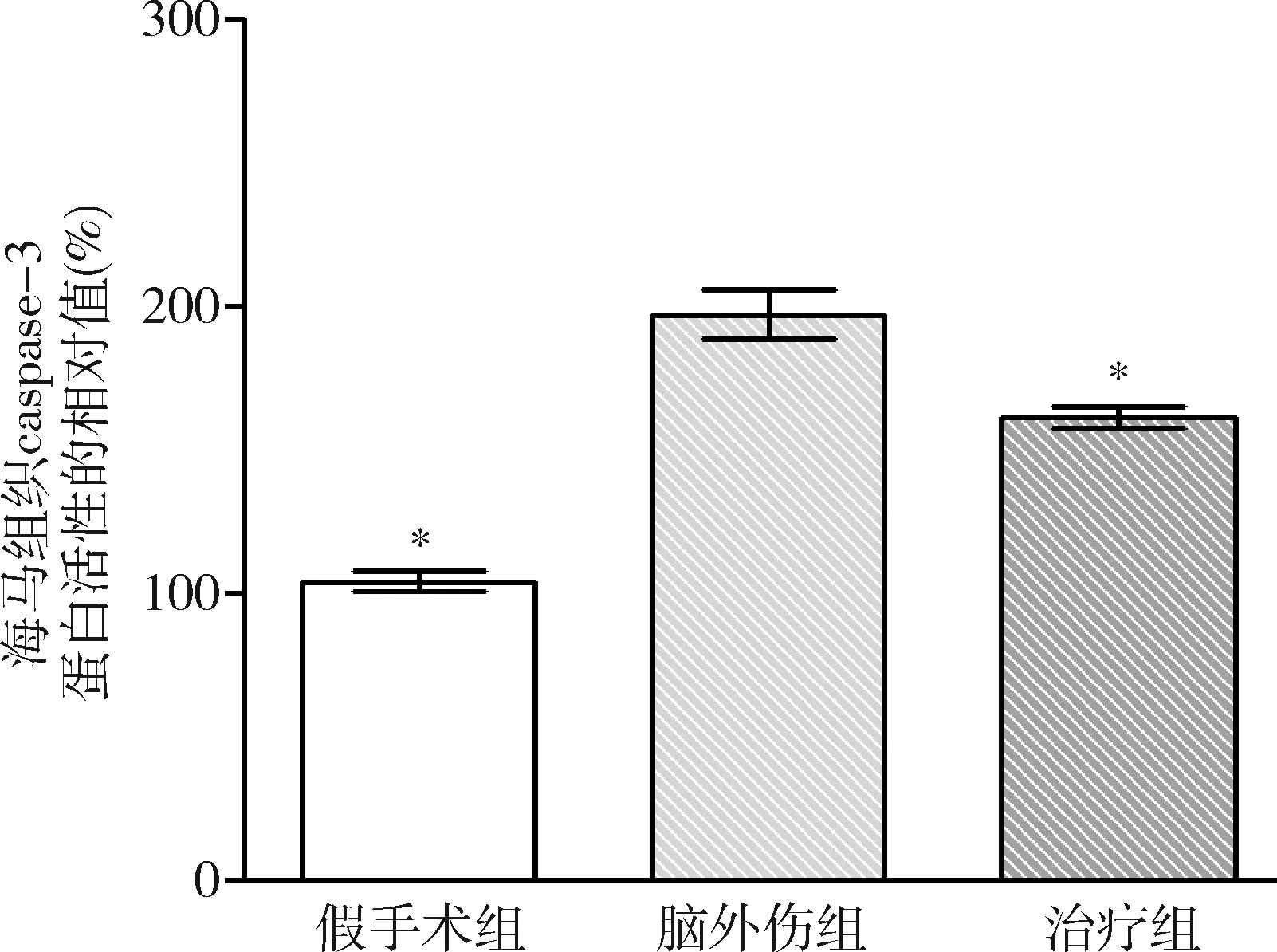
圖9 GB對大鼠海馬組織caspase-3蛋白活性相對值的影響與腦外傷組比較,*P<0.01
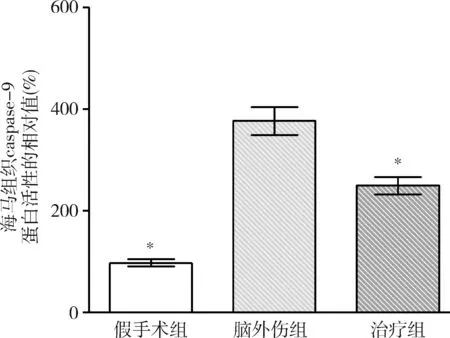
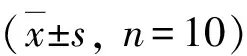
圖10 GB對大鼠海馬組織caspase-9蛋白活性相對值的影響與腦外傷組比較,*P<0.01
3.GB對大鼠海馬組織caspase-3和caspase-9蛋白活性的影響:由圖9和圖10可見,3組大鼠海馬組織caspase-3和caspase-9蛋白活性比較,差異有統計學意義(F=62.716和53.067,P均<0.01)。腦外傷組大鼠海馬組織caspase-3和caspase-9蛋白活性均較假手術組顯著升高(P均<0.01),治療組大鼠海馬組織caspase-3和caspase-9蛋白活性均較腦外傷組顯著下降(P均<0.01)。
討 論
顱腦損傷是一種嚴重的外傷形式,發生率居四肢創傷之后,但病死率和致殘率居所有外傷之首。顱腦損傷后繼發性腦損傷的病理生理機制相當復雜,涉及炎性反應、自由基反應、氨基酸毒性作用和細胞凋亡等[10~13]。哺乳細胞涉及外在途徑、內在途徑(即線粒體途徑)和內質網途徑在內的3種基本的細胞凋亡途徑。線粒體凋亡是細胞凋亡的主要途徑之一,是一種由凋亡基因調控的高度保守的死亡過程。炎性介質、缺血、缺氧及外傷等外在或內在的凋亡信號作用于線粒體,通過改變線粒體膜的通透性,導致線粒體內相關物質釋放入胞質,從而介導線粒體乃至細胞的凋亡,因此線粒體可能在細胞凋亡中起到主開關的作用[14~16]。研究證實,線粒體途徑參與顱腦損傷后神經細胞凋亡的過程[17~19]。然而,線粒體途徑也涉及復雜的信號傳遞通路,剖析這些信號通路對進一步揭示外傷性腦損傷的病理生理機制具有重要意義,也為繼發性腦損傷的藥物治療提供新思路。
Omi/HtrA2是一種在內質網合成,由MTS/MLS引導轉運進入線粒體的絲氨酸蛋白酶。Omi/HtrA2在線粒體內可通過自身蛋白酶解或被加工肽酶降解形成成熟Omi分子,并儲存在線粒體膜間隙中。線粒體膜在細胞受到刺激發生應激反應時通透性增加,Omi/HtrA2分子則從線粒體釋放并進入細胞質[3~6]。XIAP是內源性caspases抑制物,可結合和抑制活化的caspase-9。Omi/HtrA2分子在細胞受到刺激后被釋放到細胞質,從而降解XIAP,解除XIAP對caspase-9的抑制,導致下游caspase-3活化,從而DNA斷裂發生凋亡,即Omi/HtrA2通過增強caspase活性參與線粒體凋亡途徑發揮致凋亡作用[3~6]。線粒體Omi/HtrA2信號通路參與了膿毒癥性腦病、癲癇持續狀態幼鼠和腦缺血/灌注損傷大鼠神經細胞的凋亡過程[7~9]。本研究發現,顱腦損傷大鼠海馬組織Omi/HtrA2、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表達及caspase-3和caspase-9蛋白活性出現明顯的升高,而XIAP蛋白表達出現了下調。因此,線粒體Omi/HtrA2信號通路可能參與了顱腦損傷后神經細胞凋亡。
銀杏是地球上最古老的植物之一,具有獨特的藥理作用和治療價值。GB為銀杏葉提取物中主要的藥效成分之一,為二萜類酸化合物[1]。GB能通過降低Bax和caspase-3表達,增加Bcl-2表達,抑制高糖誘導的內皮細胞凋亡[20]。GB可通過抑制核因子-κB/Toll樣受體4途徑影響神經炎性反應,從而降低腦出血或腦外傷大鼠的神經細胞凋亡[21,22]。目前,GB是否通過抑制細胞凋亡線粒體途徑而降低神經細胞凋亡還不得而知。本研究發現,使用GB腹腔注射后,顱腦損傷大鼠海馬組織Omi/HtrA2、pro-caspase-3、pro-caspase-9和剪切PARP蛋白表達及caspase-3和caspase-9蛋白活性出現明顯的下降,而XIAP蛋白表達出現了上升。因此,可以推測,抑制線粒體Omi/HtrA2信號通路可能是GB抗神經細胞凋亡的機制之一。

