HPA軸損傷對實驗性重癥肌無力大鼠易感性的影響?
李 艷,何前松,況時祥△,楚 蘭,張藝凡
(1. 貴陽中醫學院第二附屬醫院,貴陽 550002; 2. 貴州醫科大學附屬醫院神經內科,貴陽 550004)
重癥肌無力(myasthenia gravis,MG)是一種慢性的、累積神經肌肉接頭突觸后膜乙酰膽堿受體的獲得性自身免疫性疾病[1]。據統計,MG的平均發病率約為7.40/10萬人/年,且呈進行性升高趨勢[2]。實驗性自身免疫性重癥肌無力(EAMG)動物模型是復制出臨床表現、免疫學、組織學、電生理及藥理學等方面類似人重癥肌無力表現的經典動物模型,其在重癥肌無力的基礎研究中奠定了重要基礎。而Lewis大鼠體內存在下丘腦-垂體-腎上腺軸(hypothalamic-pituitary-adrenal axis,HPA axis) 功能缺陷,血漿中皮質類固醇水平較低,故在復制包括MG在內的多種自身免疫性疾病的實驗研究中,常將Lewis大鼠作為首選[3],然而不同免疫及模型建立方法對EAMG模型成功率具有一定影響,因此尋求EAMG易感模型對于建立MG發病機制及防治辦法的基礎研究具有重要意義。易感性是指動物體對某種病原微生物缺乏抵抗力或免疫力時,更易復制出特有臨床癥狀的過程。本研究通過摘除Lewis大鼠雙側腎上腺致HPA軸損傷,并在此基礎上進行EAMG模型建立,結果發現,HPA軸損傷EAMG大鼠較普通EAMG大鼠更早出現重癥肌無力癥狀且癥狀更重,由此推測其在模型建立上更具易感性,現報道如下。
1 材料
1.1 實驗動物
健康SPF級雌性Lewis大鼠,6~8周齡,平均體質量160~180 g,購自北京維通利華實驗動物技術有限公司(合格證號SCXK(京)2012-0002)。實驗動物使用“3R”原則給予人道關懷,適應性飼養1周后開始實驗。無菌手術在貴陽中醫學院動物實驗研究中心進行。
1.2 試劑
鼠源性AchR-α亞基97-116肽段序列(R97-116),合肥國肽生物科技有限公司(批號GT70111-0606);弗氏完全佐劑(CFA)(批號F5881)、弗氏不完全佐劑(IFA)(批號F5506)、戊巴比妥鈉(CAS登記號57-33-0),由美國sigma公司提供;磷酸緩沖液(PBS)(HYCLONE)、大鼠AchR-Ab Elisa測定試劑盒(批號E02A0203)、大鼠皮質醇Elisa測定試劑盒(批號CSB-E05112 r)、大鼠IL-2、TNF-α、IFN-γ Elisa測定試劑盒,由武漢華美生物工程有限公司提供;ANTI-Bcl-2、ANTI-BAX(批號bs-0127R),北京博奧森生物技術有限公司;組織RNA穩定劑(批號P301-0100,GENSTAR)。
1.3 儀器設備
超低溫冰箱(中科美菱低溫科技股份有限公司);Eppendorf移液器系列0.5 μl、10 μl、20 μl、200 μl、1000 μl(德國);低溫高速離心機(thermo st 16 r,Themo Fisher);電熱恒溫水浴箱((S)HHW21,天津泰斯特儀器有限公司);自動酶標儀(美國Bio Tek公司);恒冷箱切片機(上海珂淮儀器有限公司);光學顯微鏡(尼康映像儀器銷售有限公司)。
2 方法
2.1 Lewis大鼠腎上腺切除
選取SPF級Lewis大鼠20只,大鼠預飼養7 d后,在嚴格無菌條件下,3.0%戊巴比妥鈉腹腔注射麻醉大鼠(45 mg/kg),剃去背部被毛,碘伏消毒背部皮膚,75%酒精消毒脫碘,在脊柱中線旁開1.5~2 cm肋腰處向下行縱行切口1~2 cm,暴露一側腎上腺并摘除,切口縫合,術后以5%葡萄糖代飲水,恢復7 d后再行切除另一側腎上腺,恢復7 d后再行EAMG大鼠造模。另取15只Lewis大鼠行假手術,即剃去背部被毛,常規消毒后在脊柱兩旁行縱向切口,逐層分離皮膚、肌層后暴露腎上腺再逐層縫合。
2.2 EAMG模型建立
選取經雙側腎上腺摘除后存活的Lewis大鼠15只,未經腎上腺切除Lewis大鼠35只編入EAMG模型組(20只)和假手術組(15只),體質量測量差異無統計學意義。除假手術組外,其余大鼠均進行EAMG造模,實驗動物EAMG模型參照Baggi[4]和許文華[5]等制備方法復制。首先將鼠源性AchR-α亞基97-116肽段序列(the rat sequence 97-116 of the AChR,R97-116)、完全福氏佐劑(CFA)、磷酸緩沖液(PBS)三者按1∶1.5∶1.5的比例充分混勻制成免疫乳劑;首次免疫取乳劑200 μL(含R97-116: 100μg)于造模鼠足墊、腹部、背部多點皮下注射,假手術組皮下注射等量PBS;首次免疫后第30天及第45天,將R97-116、不完全福氏佐劑(IFA)、PBS三者按1∶3∶3的比例充分混勻制成免疫乳劑后,再取乳劑200 μL(含R97-116: 50μg)強化接種,假手術組同樣注射等量PBS。
2.3 EAMG模型評估
2.3.1 大鼠行為學 分別于給藥前和給藥1周后進行行為學觀察,按Lennon評分法[6]行MG樣癥狀評分。0分:沒有肯定的無力表現;1分:輕度活動減少且易疲勞,四肢力量較差,在光滑地面上前肢打滑,抓握和頓咬無力;2分:明顯無力,活動明顯減少,休息時脊背呈隆起姿勢、頭尾下垂、大腿外展、前肢趾彎曲,動作笨拙,行走不穩;3分:嚴重無力表現,無嘶咬及抓握動作,肌肉震顫,呼吸困難,瀕死或死亡。癥狀居各級中間者分別評為0.5、1.5、2.5級。
2.3.2 血清AchR-Ab含量測定 于第二強化免疫2周后進行經尾動脈采血分離血清,采用酶聯免疫吸附試驗法(ELISA)定性測定血清AchR-Ab水平。
最終以模型組及HPA軸損傷組大鼠體質量下降,活動減少,容易疲勞,毛發稀疏,出現肌無力癥狀。同時Lennon肌無力癥狀評分≥1分,或第2次強化免疫2周后尾周動脈采血定性檢測AchR-Ab陽性作為EAMG大鼠模型造模成功標準。
2.4 取材方法
灌胃治療結束后,為防止腎上腺皮質激素晝夜分泌水平差異的影響,全部大鼠均于上午09∶00-11∶00用3%戊巴比妥鈉腹腔內注射麻醉(0.2 ml/100 g)后取材。腹主動脈取血約800 μl,離心分裝后用-80 ℃冷凍保存,用于血清AchR-Ab、皮質醇、TNF-α、IFN-γ、IL-2含量檢測。采血后剪開胸骨暴露心臟,將大號灌胃針頭從大鼠心尖部刺入升主動脈,用血管鉗夾閉同時剪開右心耳,立即從心臟快速灌洗含DEPC生理鹽水250 ml,快速斷頭完整分離大腦組織,在大腦腹側找到視交叉,在視交叉下剪下約50~70 mg下丘腦組織,置于已編號的20 ml含10%福爾馬林溶液離心管中固定待行免疫組化學檢查。
2.5 各組大鼠血清AchR-Ab、皮質醇、Th1型細胞因子(TNF-α、IFN-γ、IL-2)測定
參照ELISA試劑盒說明書,用雙抗體夾心法測定血清中AchR-Ab、皮質醇、TNF-α、IFN-γ、IL-2表達,采用酶標儀在450 nm波長下測量各反應孔的吸光度(OD值),建立標準曲線分析結果,每次至少檢測3遍。
2.6 免疫組化法檢測Bcl- 2/Bax蛋白表達
取出置于10%福爾馬林溶液中固定的下丘腦組織,用蒸餾水沖洗過剩的固定液。石蠟包埋下丘腦組織連續切片3um厚,脫蠟、水化,3%過氧化氫室溫孵育,PBS沖洗后抗原修復,以bcl-2、bax作為一抗1∶160、1∶180稀釋,4 ℃過夜,PBS沖洗,每張切片加50 μl山羊抗兔或鼠IgG抗體-HRP多聚體,PBS沖洗,每張切片加100ulDAB染色液顯色。顯微鏡下觀察,出現棕黃色后即可把切片放入自來水中終止反應,自來水沖洗,蘇木素復染,脫水透明、中性樹膠封片。利用病理圖像采集系統攝片取圖,每張切片隨機選取5個高倍(400×)陽性細胞視野,對目標組織蛋白進行陽性細胞平均光密度值(OD值)的測定與分析。
2.7 統計學方法
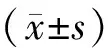
3 結果
3.1 一般觀察和體質量變化
3.1.1 Lewis大鼠雙側腎上腺切除術后一般情況 術前、雙側腎上腺切除術后Lewis大鼠體質量呈與周齡相關性增長,增長速度與假手術組大鼠無明顯差異,提示手術及應激反應與Lewis大鼠體質量變化無相關性。此外在腎上腺摘除術后1周,各組大鼠未見明顯被毛脫落、攝食異常和行為學改變等表現。
3.1.2 EAMG大鼠臨床表現及體征變化 HPA軸損傷組與模型組大鼠在首次免疫后一般情況變化不明顯,與假手術組大鼠比較,2組大鼠多在1~2周左右少部分出現叫聲低微、攝食及飲水量減少、局部鼠毛干燥、脫落等。第1次強化免疫后(4周后)左右出現明顯肢體抓持力減弱、活動減少、下牙撕咬無力、體質量增長緩慢、毛發變得稀疏、肢體抓握鼠籠時震顫等癥狀,隨著時間延長逐漸出現動作笨拙、行走緩慢、低頭隆背、易疲勞等,其癥狀在第6周進行第2次強化免疫注射1周后達到高峰。最后共死亡8只,其中腎上腺切除術后死亡5只(其中2只死于麻醉意外,3只死于術后應激反應),造模過程中HPA軸損傷組死亡1只(因造模后下牙撕咬無力進食困難而死亡),模型組死亡2只(均考慮系較早出現四肢肌無力而被同伴咬死可能)。
3.1.3 造模期間大鼠體質量變化情況 圖1顯示,與假手術組比較,第4周(強化免疫后)腎上腺切除EAMG組(HPA軸損傷組)及模型組大鼠體質量開始下降,第6周、第8周HPA軸損傷組及模型組大鼠體質量明顯低于假手術組(P<0.01)。
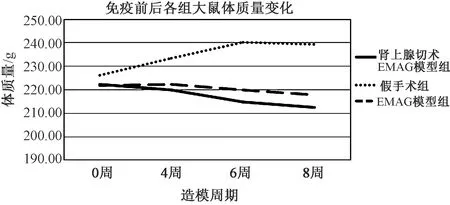
圖1 造模期間各組大鼠體質量變化
3.2 各組大鼠Lennon評分
表1顯示,模型組大鼠最終成模率達79.16%,6周后Lennon評分平均1.38分,Lennon評分2分以上達21%;HPA軸損傷組大鼠最終成模率達80%,但較EAMG大鼠更早出現肌無力癥狀,6周后Lennon評分平均1.6分,在免疫抗原接種大鼠后第8周,HPA軸損傷組大鼠臨床評分在1分以上者占模型組大鼠的82%,2分以上者達36%,均高于模型組癥狀評分,且臨床癥狀更重。
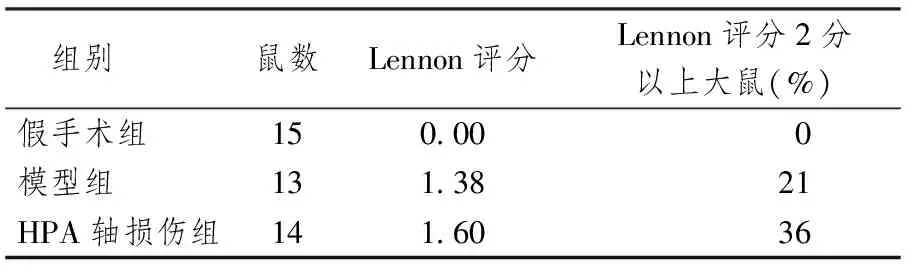
表1 各組大鼠Lennon評分比較
3.3 各組大鼠AchR-Ab、皮質醇水平的變化
表2顯示,與假手術組比較,模型組及HPA軸損傷組AchR-Ab含量均明顯增高,差異有統計學意義(P<0.01);與假手術組比較,模型組及HPA軸損傷組血清皮質醇(CORT)濃度均明顯下降,差異有統計學意義(P<0.01);而與模型組比較,HPA軸損傷組大鼠血清AchR-Ab含量更高,血清CORT濃度更低,但2組比較差異無統計學意義(P>0.05)。
3.4 Th1型細胞因子水平的變化
表2顯示,與假手術組比較,模型組、HPA軸損傷組大鼠血清中IFN-γ、TNF-α、IL-2的含量明顯增高,差異有統計學意義(P<0.05)。
3.5 下丘腦 Bcl- 2 / Bax 蛋白表達的變化
表2圖2顯示,與假手術組比較,HPA軸損傷組大鼠下丘腦組織Bcl-2蛋白表達下降,而bax蛋白表達顯著升高,差異有統計學意義(P<0.05)。
4 討論
實驗性自身免疫性重癥肌無力模型(experimental autoimmune myasthenia gravis,EAMG)目前在技術應用上趨向穩定,然而不同免疫及模型建立方法對EAMG模型成功率具有一定的影響。本實驗采用HPA軸損傷Lewis大鼠復制EAMG模型作為研究對象,研究報道Lewis大鼠體內存在免疫缺陷[7],表現為血清皮質醇(corticosteroid,CORT)水平顯著低于正常 Wistar大鼠血清皮質醇水平[8],低皮質醇可致多種自身免疫性疾病易感性,所以Lewis大鼠是重癥肌無力、類風濕關節炎等自身性免疫性疾病的理想模型。在正常應激時,HPA軸是免疫調節的負反饋環路,在HPA軸功能低下時機體易患自身免疫性疾病,是因為長期血清低皮質類固醇大大降低其對異常免疫復合物的抑制作用。本實驗通過摘除Lewis大鼠雙側腎上腺致HPA軸功能損傷,體內皮質類固醇激素分泌及釋放受到抑制,最終反作用于HPA軸,使HPA軸功能病理性亢進。在此基礎上,常規免疫Lewis大鼠進行EAMG模型復制,8周后進行癥狀學評分,并檢測各組大鼠血清皮質醇、AchR-Ab、Th1細胞因子、下丘腦細胞凋亡因子等。實驗結果顯示,與假手術組比較,模型組Lennon評分顯著升高,說明模型制作成功。而與模型組比較,HPA軸損傷組Lennon評分更高,臨床癥狀更重;此外與假手術組比較,模型組、HPA軸損傷組大鼠血清皮質醇含量均顯著降低,AchR-Ab及Th1型細胞因子(TNF-α、IFN-γ、IL-2)表達均顯著升高,HPA軸損傷組大鼠下丘腦Bcl-2的蛋白表達顯著下降,bax蛋白顯著升高。由此推測,摘除Lewis大鼠雙側腎上腺后常規復制EAMG模型可增加EAMG易感性,加重EAMG癥狀,這可能與EAMG大鼠HPA軸損傷后體內神經內分泌-免疫系統紊亂及長期低血清皮質醇造成免疫功能低下相關。
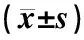
表2 各組大鼠血清 AchR-Ab、CORT、Th1細胞因子含量及下丘腦Bcl-2、Bax蛋白OD值比較
注:與假手術組比較:☆P<0.01,△P<0.05

注:A.假手術組Bcl-2;B.模型組Bcl-2;C.HPA軸損傷組Bcl-2;D.假手術組Bax; E.模型組Bax;F.HPA軸損傷組Bax圖2 各組大鼠下丘腦Bcl-2、Bax蛋白表達(免疫組化 × 400)
本研究中HPA軸損傷組皮質醇水平顯著降低,而AchR-Ab、Th1細胞因子顯著升高,多種研究已證實,Th1通過分泌IL-2、 IFN-γ和 TNF-α等細胞因子,激活巨噬細胞、刺激 NK 細胞、促進B細胞增殖及分泌抗體,并通過細胞因子受體作用于神經內分泌系統,進而導致神經內分泌-免疫紊亂,引發或加重MG病情。已有研究認為,MG患者及EAMG模型大鼠血清Th1含量均顯著升高,并與MG病情、預后相關[9-10]。這與本研究結果一致。在本研究中,與假手術比較,模型組及HPA軸損傷組大鼠血清AchR-Ab、IL-2、 IFN-γ及TNF-α均顯著升高,而HPA軸損傷組較模型組更高,二者比較差異無統計學意義。IL-2對神經-內分泌系統有廣泛的影響,與IL-1、IL-6及IFN-γ一樣,IL-2具有較強的神經內分泌效應,參與免疫反應時對HPA軸系統的激活。研究已證實,IL-2在鼠體內可提高ACTH 分泌,并直接作用于鼠的腎上腺皮質細胞誘導皮質酮產生和CRH 從下丘腦神經元的釋放[11];TNF-α在EAMG形成過程中也起關鍵作用,血清中高水平的TNF-α可直接破壞AchR或直接促進B細胞的分化、生長,從而增加 AchR-Ab的產生。張曉明等[12]研究發現,MG病人早期血清中TNF-α含量明顯升高,病情越嚴重含量越高,TNF-α同時也影響神經內分泌激素的釋放,目前報道較一致的是TNF-α可影響各種垂體前葉激素的分泌;此外,在神經內分泌調節方面,有研究報道IFN-γ可通過FSC介導而抑制ACTH、PRL、GH的釋放,對HPA軸起抑制作用[13]。由此可見,在Th1細胞因子中IL-2 和IFN-γ也通過相應細胞因子受體作用激活HPA軸的活性,而IFN則抑制HPA軸的活性[14],而Th1細胞因子表達異常,從而引起免疫調節失衡,進而作用于神經內分泌系統,造成HPA軸功能紊亂。這可能是摘除Lewis大鼠雙側腎上腺后復制EAMG模型更具易感性的重要機制之一。
HPA軸是腦調控免疫系統的主要傳出通路,對神經-內分泌-免疫系統的調節作用最為突出。近年研究表明,自身免疫疾病與Fas介導的細胞凋亡或Fas表達缺陷密切相關。一般認為,Fas系統誘導的凋亡過程是通過Bcl-2的表達負調控實現的。Bcl-2是抑制細胞凋亡的基因,通過阻止多種形式的細胞凋亡而延長細胞壽命,在免疫系統的免疫細胞成熟過程中起著重要的調節作用。Bcl-2的過度表達能抑制細胞凋亡過程,而Bax是Bcl-2的同源體,其作用是抑制Bcl-2發揮作用,Bax過度表達能誘導細胞凋亡[15]。壽旗揚等[16]通過摘除Lewis大鼠雙側腎上腺后制作自身免疫性腦脊髓炎(EAE)模型,進而通過檢測下丘腦Bcl-2/bax蛋白含量以判定HPA軸損傷對EAE模型的易感性。結果顯示,Lewis大鼠下丘腦中Bcl-2蛋白表達均明顯降低和Bax蛋白表達均明顯升高。同樣我們采取切除Lewis大鼠雙側腎上腺后復制EAMG模型,免疫組化法檢測各組大鼠下丘腦Bcl-2/bax蛋白,結果顯示EAMG模型組大鼠Bcl-2/bax蛋白表達與壽旗揚等報道一致。因此我們推測,雙側摘除Lewis大鼠腎上腺后HPA軸損傷會促進CNS細胞凋亡,加速神經元細胞固縮、胞核收縮的病理進程,而在HPA軸損傷組大鼠下丘腦組織Bcl-2蛋白表達下降,而bax蛋白表達顯著升高也進一步證實了這一點。
綜上,通過摘除Lewis大鼠雙側腎上腺可致HPA損傷,進而引起神經內分泌-免疫功能紊亂,在此基礎上建立EAMG模型可能更具易感性,這為重癥肌無力模型的研究提供了新的思路及方法。然而Lewis大鼠價格昂貴,對于非Lewis大鼠采用以上方法建立該模型是否有同樣的結果仍有待進一步研究,本實驗研究結果或許將對此具有參考意義。

