洛羅蘭糖苷激活Bcl-2通路誘導髓樣抑制性細胞凋亡研究
秦 越,龐宗然
(民族醫藥教育部重點實驗室中央民族大學,北京 100081)
洛羅蘭糖苷是從民族藥盤龍參中分離提取的,目前對于洛羅蘭糖苷的研究還很少。但盤龍參作為民間的一種療效極佳的抗癌中草藥已經受到越來越多的關注。盤龍參為蘭科綬草屬,以根或全草入藥,味甘,性溫,入肺、肝、腎三經。《湖南藥物志》記載,盤龍參可“止虛熱口渴,肺瘤咳血”,由于其分布廣泛,還被藏醫,蒙醫使用[1]。在藏藥中,盤龍參主要用于強身健體,養氣生精,但是在效能上弱于手參。也有一些民間古方將其作為治療糖尿病的藥物應用。現代醫學研究證實,盤龍參對S180肉瘤,A549肺癌細胞、BEL7402肝癌細胞、HT-29食管癌細胞、MCF-7乳腺癌細胞、SGC-7901胃癌細胞、K562白血病細胞和A498腎癌細胞都有一定毒性,具有明顯的抗腫瘤效果[2-5],但其具體機制尚未明確,對其化學組分分離,藥理、毒理方面的探索都處于相對初級的階段。
髓樣抑制性細胞(MDSCs)是骨髓細胞譜系的固有部分,包括某些腫瘤相關巨噬細胞,是樹突狀細胞、巨噬細胞和粒細胞的前體,主要存在與腫瘤微環境中,通常被描述為CD14-CD11b+細胞群,表達CD33和CD15(在小鼠中被標記為Gr1+CD11b+),具有免疫負調控的作用。MDSCs可以抑制T細胞增殖,調節巨噬細胞產生細胞因子,參與腫瘤血管生產與癌細胞遷移等[6]。大量的臨床數據顯示,在結直腸癌、乳腺癌、非小細胞肺癌等癌癥病例中,外周血MDSCs的數值與癌癥的發展階段密切相關[7]。同時,在癌旁組織中,MDSCs的存在也影響著腫瘤治療的效果,例如,乳腺癌患者的化療反應及肝癌的放射治療結果都與MDSCs的浸潤程度呈現負相關[8]。因此,靶向MDSCs可能成為腫瘤治療的一個有效途徑。
因此,本課題通過對洛羅蘭糖苷作用后MDSCs的增殖、凋亡、蛋白表達幾個方面的研究,從改善腫瘤微環境的角度去探求洛羅蘭糖苷的藥用價值及其抗腫瘤機制。
1 材料與方法
1.1 材料
1.1.1 材料 MDSCs細胞系中永生化的細胞MSC-2(獲贈于 Francois Ghirnghelli,腫瘤內科);洛羅蘭糖苷粉末(民族醫藥教育部重點實驗室前期提取);DMEM培養基。
1.1.2 儀器 細胞計數板(中國博大博聚科技有限公司),流式細胞儀(美國BD公司),GUAVA微毛細管細胞分析儀(美國BD公司)。
1.2 方法
1.2.1 DMEM+/+培養基的配置 DMEM+/+培養基購自Invitrogen公司。取DMEM+/+培養基加入10%的新生牛血清,以及100 U/mL的雙抗(鏈霉素和青霉素)。
1.2.2 磷酸鹽緩沖液(PBS)的配制 所配制的1×PBS 緩沖液中含有:NaCl 8 g,KCl 0.2 g,Na2HPO4·12H2O 3.63 g,KH2PO40.24 g和 1 000 mL 超純水。
1.2.3 洛羅蘭糖苷母液的制備 取洛羅蘭糖苷粉末加入DMEM+/+培養基,震蕩均勻得到濃度為10 mg/mL的懸液,在細胞間內再0.22 μm濾器過濾,得到無菌洛羅蘭糖苷母液。
1.2.4 MSC-2細胞培養 將水浴鍋調至37℃,在離心管加入3 mL培養基,在培養瓶內加入10 mL培養基。取出凍存細胞快速放入水浴鍋中,待細胞融化后,用紙巾拭去管壁周圍的水份,在超凈工作臺內打開,將細胞轉入離心管。離心,1 200 rpm,3 min。棄上清,彈起細胞,將細胞均勻接種入培養瓶內,37℃,5%CO2培養箱進行培養。
1.2.5 MTT法檢測洛羅蘭糖苷抑制MSC-2細胞效果 實驗設對照組和實驗組,每組設6個復孔。MSC2細胞接種于96孔板,細胞密度為5×104個/孔。實驗組中加入洛羅蘭糖苷,濃度分別為 0、0.3、0.6和1.2 mg/mL;對照組加入等體積的DEME+/+培養基。邊孔中加入1×PBS 200 μL以防止邊緣效應。放入37℃,5%CO2細胞培養箱中培養24 h后取出,每孔避光加入MTT試劑10 μL后放回細胞培養箱中培養。培養4 h后取出,加入三聯溶解液(10%SDS,5%異丁醇,0.012 mol/L HCL,蒸餾水溶解)溶解 6 h后,用酶標儀(美國 BIO-RAD Laboratories,Philadelphia,PA)測量570 nm處吸光度。
1.2.6 流式細胞學分析 MSC-2細胞接種于96孔板,細胞密度為5×104/孔,加入洛羅蘭糖苷,終濃度為0.6 mg/mL。陰性對照每孔加入等體積的DMEM+/+培養基至終體積100 μL/孔。37℃細胞培養箱培養1 d。適當力度吹打細胞后吸出液體,分別注入 1.5 mL 離心管,離心(4 000 r/min,4℃)5 min。去上清,加入含2%NCS的PBS 50 μL,依比例加入流式染料,抗體為FITC-AnnexiV和7AAD,冰上放置,抗體染色 30min(7AAD最后染 5 min)后,離心(4 000 r/min,4℃)5 min,沉淀用 200 mL含 2%NCS的PBS重懸,將細胞懸液轉移至流式管,上機檢測,流式細胞儀為FACScan flow cytometer(美國 BD Calibur),采用 Flowjo 7.6 進行結果分析。
1.2.7 Western Blotting檢測 MSC-2細胞經過洛羅蘭糖苷處理后,用RIPA細胞裂解液進行裂解,置冰中40 min后,先各取1 μL蛋白待測,再加入4×Loading Buffer,100℃加熱10 min后放入-80℃冷藏。將待測蛋白稀釋至50 μL,并配置BSA及AB液,60℃放置15 min后用酶標儀測量562 nm處吸光值。測得數值代入公式計算蛋白上樣量。
配置10%和12%凝膠電泳分離膠,放入加好電泳液的電泳儀中,按量向兩膠中加入蛋白,并在兩側加入5 μL MarkerⅢ,80 V恒壓電泳置溴酚藍跑出。取出膠體轉膜,100 V恒壓電泳70 min后將10%膠轉得膜中目標蛋白相應位置所在條帶剪下。用3%BSA封閉1 h,后分別按比例配置、加入目標蛋白的相關一抗,80 min后洗5×5 min,再加入目標蛋白對應二抗。60 min后洗5×5 min,取出條帶,加入顯影液后進行置于曝光儀中進行曝光。
1.2.8 統計學分析 統計分析使用Graphpad prism 5 軟件,計量資料用均數±標準差(x±s)表示,多組間比較采用單因素方差分析檢驗,組間兩兩比較若方差齊采用LSD法,若方差不齊采用Dunnett's T3法,P<0.05 為差異有統計學意義。
2 結果
2.1 洛羅蘭糖苷對MSC-2的毒性作用 將MSC-2細胞用不同濃度的洛羅蘭糖苷處理24 h。當濃度為0.3~1.2 mg/mL 時,洛羅蘭糖苷對 MSC-2 具有明顯的抑制作用(P<0.01),且呈現劑量-效應關系。RAW為小鼠來源的巨噬細胞系,MTT結果顯示,此濃度范圍內,洛羅蘭糖苷對RAW細胞無毒性作用。見表1,圖 1。
表1 洛羅蘭糖苷對MSC-2及RAW細胞增殖的抑制作用(±s)Tab.1 Inhibitory effect of loroglossin on the proliferation of MSC-2 and RAW cells(x±s)
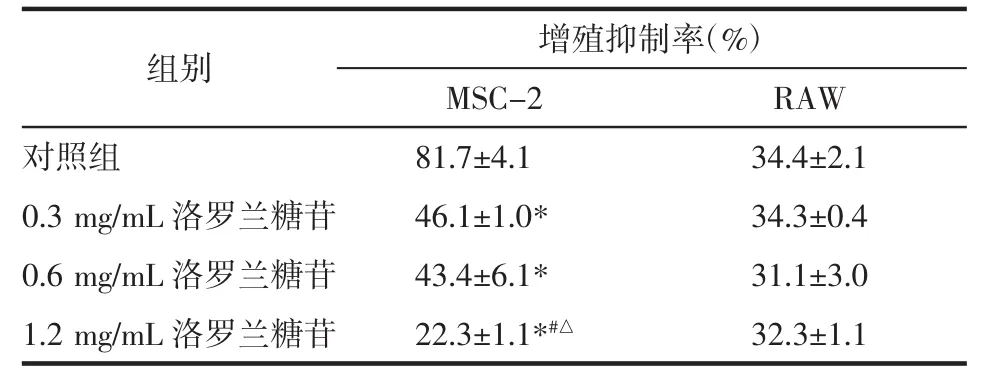
表1 洛羅蘭糖苷對MSC-2及RAW細胞增殖的抑制作用(±s)Tab.1 Inhibitory effect of loroglossin on the proliferation of MSC-2 and RAW cells(x±s)
注:與對照組比較,*P<0.01;與 0.3 mg/mL 洛羅蘭糖苷組比較,#P<0.01;與 0.6 mg/mL 洛羅蘭糖苷組比較,△P<0.01。
組別 增殖抑制率(%)MSC-2 RAW對照組 81.7±4.1 34.4±2.1 0.3 mg/mL 洛羅蘭糖苷 46.1±1.0* 34.3±0.4 0.6 mg/mL 洛羅蘭糖苷 43.4±6.1* 31.1±3.0 1.2 mg/mL 洛羅蘭糖苷 22.3±1.1*#△ 32.3±1.1
2.2 洛羅蘭糖苷促進MSC-2凋亡 MTT結果顯示,洛羅蘭糖苷作用下,MSC-2細胞的數量減少。為進一步確定藥物的影響,用不同濃度(0、0.3、0.6、1.2 mg/mL)處理 24 h,然后用 Annexin V-FITC/PI進行雙重染色,并進行流式細胞分析。結果表明,早期凋亡細胞百分比由14.7%上升至52.2%。見圖2。統計分析顯示,洛羅蘭糖苷可促進MDSCs的凋亡,且呈劑量依賴性。見表2。
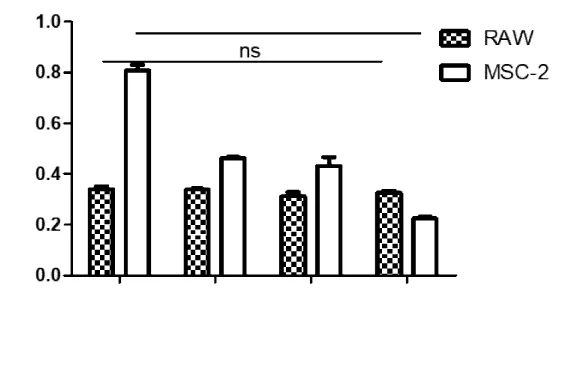
圖1 洛羅蘭糖苷對MSC-2細胞活性有抑制作用Fig.1 Loroglossin suppressed proliferation of MSC-2 cells

圖2 洛羅蘭糖苷誘導MSC-2細胞凋亡Fig.2 Loroglossin induced apoptosis of MSC-2 cells

表2 洛羅蘭糖苷誘導MSC-2細胞凋亡Tab.2 Loroglossin induced apoptosis of MSC-2 cells
2.3 洛羅蘭糖苷激活Bcl-2信號通路 為明確洛羅蘭糖苷促進MSC-2細胞凋亡的具體機制,用洛羅蘭糖苷(0.6mg/ml)刺激 MSC-2 細胞,于不同時間段內提取蛋白,Western blot結果顯示,JNK2、細胞色素C、caspase-9、caspase-3表達明顯上調,而Bcl-2表達下降。因此,洛羅蘭糖苷通過Bcl-2信號通路誘導MSC-2細胞凋亡。見圖3。

圖3 洛羅蘭糖苷對Bcl-2、cytochrome C、Caspase 9、JNK2及Caspase 3蛋白表達水平的影響Fig.3 Effect of loroglossin on the expression of Bcl-2,Cytochrome C,Caspase 9,JNK2 and Caspase 3 protein
3 討論
在腫瘤微環境中,髓樣抑制性細胞的功能主要表現為抑制CD8+T細胞的活化及殺傷腫瘤細胞的功能從而促進腫瘤的生長。另外,髓樣抑制性細胞還可通過下調穿孔素和IFN-γ的表達來抑制自然殺傷細胞的細胞毒活性,抑制樹突狀細胞、巨噬細胞的分化而下調抗免疫應答[9]。實驗表明,應用GR1單克隆抗體去除體內髓樣抑制性細胞可以增強荷瘤小鼠的免疫反應,表現出對多種腫瘤的排斥反應[10]。因此,以髓樣抑制性細胞為靶點的針對性藥物研發對腫瘤免疫治療的發展具有非常誘人的前景。
本實驗室前期研究從中草藥盤龍參中分離提取到一種苷類化合物洛羅蘭糖苷。目前,洛羅蘭糖苷的相關研究文獻很少,因此,本課題中筆者首先對洛羅蘭糖苷的細胞毒性進行篩選,結果顯示,洛羅蘭糖苷可以特異性的殺傷髓樣抑制性細胞。同時,細胞凋亡標記檢測顯示,洛羅蘭糖苷對髓樣抑制性細胞的殺傷性主要表現為誘導細胞凋亡。對其凋亡機制的探究表明,洛羅蘭糖苷可以下調Bcl-2的表達,上調JNK2、細胞色素C、Caspase-9及Caspase-3的表達。
細胞凋亡可分為內源性凋亡和外源性凋亡兩種途徑[11]。外源性凋亡是由膜上受體介導的凋亡,通常這些受體的配體為TNF-α、TRAIL和Fas-L等。內源性凋亡是通過線粒體的凋亡途徑,其受到Bcl-2家族的嚴格控制。洛羅蘭糖苷處理后,JNK2的表達上調抑制了Bcl-2的表達,從而釋放更多的細胞色素C。細胞色素C的大量釋放可以激活下游的Caspase家族,進而促進細胞凋亡。
綜上,洛羅蘭糖苷通過激活Bcl-2信號通路誘導髓樣抑制性細胞凋亡,增強腫瘤微環境中的免疫調控,從而具有一定的抗腫瘤作用。

