L-精氨酸對實驗性牙移動大鼠牙周組織CD133表達的影響
李 慧,李明賀,汪 洋,黃 蕾,周雪純
(1.首都醫科大學密云教學醫院 口腔科,北京101500;2.吉林大學口腔醫院 a.口腔頜面外科;b.正畸科)
正畸牙移動的過程就是牙周組織改建的過程,研究牙周組織改建的機制對正畸臨床有重要的意義。雖然學者們[1,2]做了大量的研究,提供加速牙周組織改建的方法,即加速牙移動的方法,如適當的給藥、物理方法的使用等,但這些方法的具體應用仍處于探索階段。本研究旨在通過建立大鼠實驗性牙移動模型,注射一氧化氮(NO)前體左旋精氨酸(L-Arg),觀察CD133在大鼠牙周組織中的表達情況,本課題組前期研究[3,4]表明:CD133陽性細胞參與了實驗性牙移動牙周組織早期的血管改建,在此基礎上進一步探討其在牙周組織改建信號傳導通路中的作用,從而進一步闡釋實驗性牙移動牙周組織改建的機制,并為L-Arg的臨床相關應用提供實驗依據。
1 材料與方法
1.1 實驗動物和分組
取健康雄性6周齡Wistar大鼠40只,體質量為(0.15±0.02)kg,由吉林大學動物實驗室提供。隨機分為對照組與實驗組,每組20只,按文獻[5]描述建立實驗性牙移動動物模型(在大鼠上頜切牙和右側第一磨牙之間放置NiTi螺簧,以大鼠的上頜切牙為支抗牙,用50 g力拉動右上頜第一磨牙移動向近中),加力后立即采用L-Arg 300 mg·kg-1[6]溶解于0.5 mL生理鹽水中,對實驗組大鼠進行腹腔注射,對照組注射等量生理鹽水,每天1次。
1.2 主要試劑和儀器
兔抗大鼠CD133多克隆抗體(北京博奧森試劑公司);免疫組織化學SP試劑盒(福州邁新公司);L-Arg(美國 Sigma 公司);防脫片劑:Poly-L-lysine多聚賴氨酸(福州邁新公司)。XL-I型正畸測力計(西北工業大學);病理圖文分析儀:HPIAS-1000圖像分析系統(同濟醫科大學)。
1.3 標本制作
在加力注射后的1、3、5、7、14 d用經1‰DEPCS水處理過的4%多聚甲醛經心臟灌注分別處死大鼠,制作牙周組織及牙的聯合標本,用4%多聚甲醛將其固定過夜。經常規脫鈣、脫水及石蠟包埋,制作5 μm厚的組織切片,以右上頜第一磨牙為中心、近遠中方向。常規HE染色作組織的定位參照片,以CD133為一抗(1∶200)行SP法免疫組織化學染色,以PBS代替一抗作為陰性對照,二氨基聯苯胺(DAB)顯色。
1.4 鏡下觀察與圖像分析
1.4.1CD133陽性反應灰度積分 CD133染色之后,從每組標本的切片中隨機選取3張,光鏡下對比觀察實驗組與對照組CD133陽性表達的分布情況。每張切片中隨機選擇5個非重疊視野(×200)測定CD133陽性反應強度灰度,將其轉化為灰度積分(陽性產物面積/測量面積×陽性強度的灰度值)。
1.4.2CD133陽性新生血管計數 按Weidner方法[7],首先低倍鏡下查找血管的密集區,再于高倍視野下(×200)計數每個視野含CD133陽性細胞的微血管數:即微小血管由2-3個內皮細胞或內皮細胞簇構成,以下情況不計數:5個以上內皮細胞構成管腔或管腔帶有較厚肌層、達8個紅細胞大小的血管。隨機選擇5個非重疊視野,測定值取平均值。
1.5 統計學分析
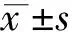
2 結果
2.1 光鏡觀察
2.1.1HE染色 對照組與實驗組相似,因機械牽拉牙周膜分為壓力側和張力側。壓力側牙周膜纖維排列紊亂,血管管腔變窄,破骨活躍,可見骨吸收陷窩;張力側牙周膜纖維排列具有方向性,牙周膜相對增寬,血管擴張,成骨細胞排列成排,可見新骨形成。壓力側和張力側均可見新生血管。實驗組大鼠的微血管結構更豐富。見圖1和2。
2.1.2CD133免疫組織化學染色 各時間點對照組和實驗組均有不同程度的棕黃色顆粒陽性表達,在部分新生血管內皮細胞、成骨細胞及其前體細胞、成纖維細胞胞漿中可見。相同時間點實驗組染色強度普遍高于對照組,尤其在加力3、5天時,實驗組大鼠CD133在新生血管內皮細胞、成骨細胞及其前體細胞中表達明顯。見圖3-6。
2.2 圖像分析
2.2.1實驗性牙移動牙周組織中CD133陽性反應平均灰度積分 對照組CD133陽性反應灰度積分

圖1 對照組7天牙周組織(HE,×100) 圖2 實驗組7天牙周組織(HE, 圖3 對照組3天牙周組織CD133
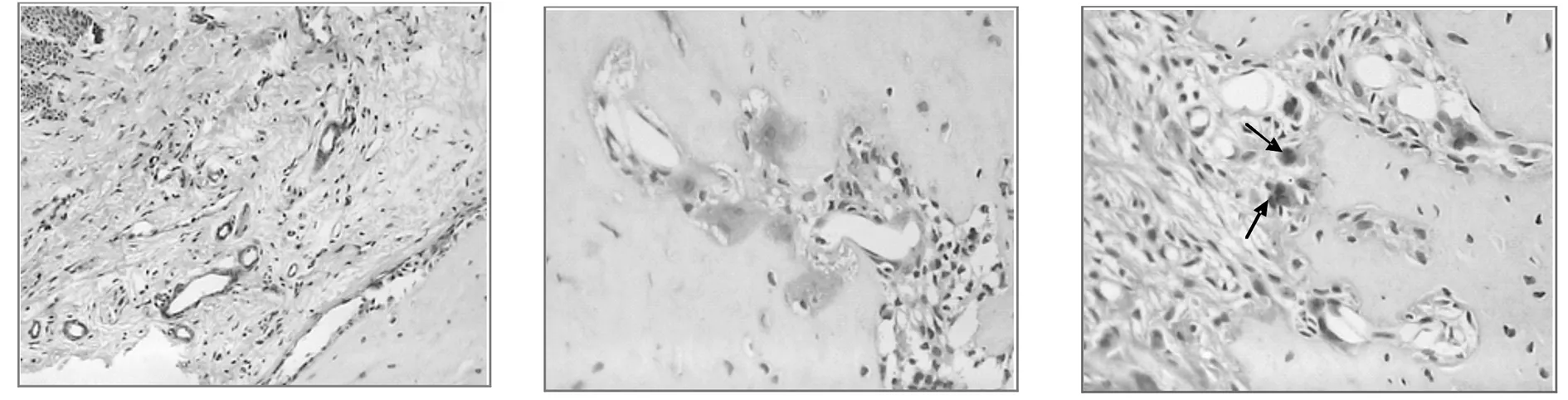
圖4 實驗3天組牙周組織CD133的表達(SP,×100)CD133染色陽性的新生血管較多 圖5 實驗組3天牙周組織CD133的表達(SP,×200)成骨細胞CD133染色陽性 圖6 實驗組5天牙周組織CD133的表達(SP,×200) 箭頭所指為成骨細胞前體細胞CD133染色陽性
高峰出現在加力后1 d,實驗組在加力后5 d出現最高值,峰值落后于對照組。實驗組在加力3、5 d時表達明顯高于對照組(P<0.05)。見表1。
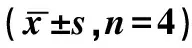
表1 兩組大鼠CD133陽性反應平均灰度積分
注:NS無統計學意義,P<0.05有統計學意義
2.2.2實驗性牙移動牙周組織中CD133陽性新生血管計數 加力1天后在實驗組和對照組大鼠中均觀察到CD133表達陽性的新生血管,且對照組達高峰,實驗組在加力3天達高峰,且明顯高于對照組(P<0.05)。見表2。
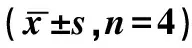
表2 兩組大鼠CD133陽性新生血管計數
注: NS無統計學意義,P<0.05有統計學意義
3 討論
實現牙移動需要通過牙周組織的改建[8],牙齒移動速度和正畸矯治療程取決于牙周組織的改建水平。CD133是一種跨膜蛋白,是研究最多、較有研究價值的干細胞表面特異標記分子之一,通過CD133 可以分選干細胞及前體細胞等[9],排除成熟內皮細胞。目前,CD133 的生物學功能還未完全明確,僅是其參與的信號通路與干細胞激活有關被基本確認[10]。在組織缺血、缺氧等內源性刺激以及加入生長因子、藥物等外源性刺激的生理或病理條件下,骨髓中的造血/內皮祖細胞將被動員進入外周血并歸巢參與組織中血管改建部位[11]。已有研究顯示加入細胞因子,激素或藥物等外源性刺激[12]可促進其的動員歸巢。
本研究選用L-Arg作為外源性刺激。L-Arg是NO的前體也是促進劑,其在內皮細胞中產生的NO與細胞吸收的L-Arg幾乎配對。外源性L-Arg能增加血管NO生物活性,并能明顯促進NO合成和造血/內皮祖細胞增殖。而NO是最重要的一種內皮源性血管活性因子,介導和調節多種病理生理反應,具有擴張血管、信息傳遞、組織修復等作用。NO途徑是一種重要的新血管形成的調節器,而且可以調節成血管細胞活性,影響其增殖,動員和遷移通過局部缺血及慢性損傷反應。研究[13]表明NO可調節造血/內皮祖細胞從骨髓的釋放,對動員其入血起了關鍵作用。Qi等[14]的研究顯示:外源性增加NO可顯著提高循環造血/內皮祖細胞水平。而增加NO及提高其生物利用度則可以使造血/內皮祖細胞功能障礙得以恢復[15]。NO介導的信號通路更被認為是造血/內皮祖細胞動員的基礎[16]。
本實驗結果顯示:對照組大鼠在牙周組織受到正畸力后,CD133有少量表達;而在受力3-5 d時,實驗組的CD133陽性反應平均灰度積分明顯高于對照組,即注射L-Arg后,在一段時間內CD133陽性表達確有增高。而實驗組中CD133陽性新生血管表達也在一段時間內高于對照組,說明加入外源性刺激L-Arg促進了牙周組織改建中CD133陽性細胞數量的增多及作用的發揮。分析機制可能為NO是骨髓微環境的組成和調節成分,加入L-Arg促進內皮細胞產生和釋放NO,進而促使基質金屬蛋白酶-9(MMP9)的激活,從而促進CD133陽性細胞的動員和歸巢[17]。而也正是由于這一過程使得CD133在實驗組的牙周組織及新生血管中的表達高峰與對照組相比均后移。
實驗組中CD133在牙根周圍牙槽骨表面成骨細胞、成骨細胞前體細胞中表達較對照組明顯,提示L-Arg促進CD133陽性細胞通過成骨細胞分化參與早期實驗性牙移動牙周組織的骨改建。原因可能為雖然骨改建的發生很大程度上受血管化作用的影響,但已有研究表明造血/內皮祖細胞,既能分化為內皮細胞,也能分化成為成骨類細胞[18]。另有證據也表明,早期和功能性高活性的CD34/CD133+循環內皮祖細胞具有成骨潛能[19]。在其基礎上由于NO對骨的作用,即NO是骨反應的重要媒介,其在進行骨改建及破骨細胞、成骨細胞等的功能分化過程中均起了重要的調控作用。因此注射L-Arg后,可見破骨活躍,破骨細胞活化明顯,成骨也被促進,使得CD133陽性細胞的成骨分化增強。
綜上所述,L-Arg通過上調實驗性牙移動牙周組織中CD133的表達,促進CD133陽性細胞參與實驗性牙移動的牙周組織改建,從而在促進實驗性牙移動牙周組織的血管改建與骨改建方面發揮了作用。

