菊芋菊糖粗提液的微生物除雜
李雪雁,武曉堯,孫春麗,謝輝燦,王金龍
(蘭州理工大學 生命科學與工程學院,甘肅 蘭州,730050)
菊芋(Jerusalemartichoke)塊莖中菊糖含量為其干重的55%~83%,是自然界已知含有菊糖的36 000種植物中含量最高的植物之一[1]。菊糖,又稱菊粉,是由呋喃構型的D-果糖經β-(2,1)糖苷鍵脫水聚合而成的果聚糖混合物[2]。不同聚合度的果糖具有不同的生理功能,低聚合度的果糖可以促進人體腸道雙歧桿菌的增殖,改善腸道功能,提高免疫力和抗病力[3-5]。
由于菊糖易溶于水,加熱溶解更快[6],因此工業上提取菊糖一般都采用熱水浸提法,在提取過程中一些雜質如蛋白質、果膠、色素等也隨之被提取出來,因而菊芋粗提液需進行脫色、脫蛋白等去雜過程[7]。目前脫蛋白主要采用Sevage法、三氯乙酸法、HCl法、石灰乳法、樹脂純化法等[8-12]。菊芋提取液中還含有果糖、葡萄糖等還原糖,要得到高純度的菊糖,還需額外采用一些方法(如膜過濾等)將還原性糖去除[13-14]。由于現行菊糖的工業化生產工序較復雜,導致成本較高。基于微生物在生長繁殖過程中消耗糖類和蛋白質作為其碳源和氮源,因此將篩選的不降解菊糖的微生物菌株接入菊芋粗提液中,在適宜條件下培養,可逐漸將粗提液中的還原糖和蛋白質消耗,即可達到菊糖純化和精制的目的,并使原工藝簡化。將微生物用于菊芋提取液除雜的研究尚未見文獻報道,本文對此進行了研究,以期為工業生產的應用提供依據。
1 材料與方法
1.1 材料與試劑
紫皮菊芋20 kg,購于蘭州市某市場。將新鮮菊芋洗凈切片,于60 ℃電熱恒溫鼓風干燥箱中干燥24 h,制得菊芋干片,備用;菌株,蘭州理工大學生命科學與工程學院實驗中心保藏的11株酵母菌菌株,分離自寧夏賀蘭山東麓葡萄酒產區的葡萄果實表皮和根際土壤中[15];菊糖,即菊粉,購自甘肅省白銀市某菊粉生產企業。
YPD培養基(g/L):葡萄糖20,酵母粉10,蛋白胨20,pH 5.5。
產酶種子培養基,參照文獻[16]略做修改:菊糖10,蛋白胨20,酵母粉10,pH 5.5。
產酶發酵培養基(g/L)[17]:菊糖30,蛋白胨20,酵母粉10,(NH4)2SO45,KH2PO43,pH 5.5。
WL營養培養基(g/L)[18]:酵母浸粉4,胰蛋白胨5,葡萄糖50,瓊脂20,儲液A(KH2PO45.5 g,KCl 4.25 g,CaCl21.25 g,MgSO41.25 g,定容至400 mL,按1∶25比例添加),儲液B(FeCl30.25 g,MnSO40.25 g,定容至100 mL,按1∶1 000比例添加);儲液C(0.44 g溴甲酚綠溶于100 mL體積分數50%乙醇溶液中,按1∶1 000比例添加),1×105Pa滅菌20 min。
牛血清蛋白(BSA,生物試劑),考馬斯亮藍(優級純),蔗糖、果糖、酒石酸鉀鈉、3,5-二硝基水楊酸、苯酚、蒽酮等試劑均為分析純。
1.2 主要儀器與設備
WPL-125BE型恒溫培養箱,天津市泰斯特儀器有限公司;UV-3000PC型紫外分光光度計,上海美譜達儀器有限公司;TGL-16型高速冷凍離心機,湖南湘儀離心機儀器有限公司;FA2004型分析天平,上海良平儀器儀表有限公司;SHB-111型真空抽濾泵,天津賽得利斯實驗分析儀器制造廠;GZX-9030MBE型電熱恒溫鼓風干燥箱,上海博迅實業有限公司醫療設備廠。
1.3 實驗方法
1.3.1 菌株鑒定及其菊粉酶活力的測定
1.3.1.1 菌株初步鑒定[19]
將11株酵母菌分別轉接至WL鑒別培養基,28 ℃培養5~7 d,依據各菌株在WL培養基的菌落形態和顏色特征等,參照WL培養基的酵母菌鑒別表,進行初步鑒定。
1.3.1.2 菊粉酶粗酶液的制備
將11株酵母菌菌株分別接入YPD培養基中,28 ℃活化培養24 h;之后轉接入產酶種子培養基中,28 ℃恒溫振蕩培養12 h;再將種子液轉接入50 mL產酶發酵培養基中(接種量為10%體積分數),30 ℃恒溫振蕩培養96 h。將發酵液在3 500 r/min,離心15 min,取上清液即為粗酶液。
1.3.1.3 菊粉酶活力的測定
首先參照文獻[20]制作標準果糖曲線。
將粗酶液經適當稀釋后取1 mL,加入20 g/L菊糖(用0.2 mol/L,pH 4.5醋酸緩沖液配制)4 mL,50 ℃下反應30 min,沸水加熱5 min滅酶活,采用3,5-二硝基水楊酸法(DNS比色法)[16]測還原糖,以沸水浴加熱10 min失活的粗酶液作為對照。在果糖標準曲線上查出糖含量,計算反應生成的還原糖量(以果糖計),以每分鐘轉化生成 1 μmol/L還原糖所需的酶量為1個酶活力單位,該法測得的是內切菊粉酶活力,以I表示。以2% 蔗糖代替菊糖,其他步驟同上。以每分鐘轉化生成1 μmol/L還原糖所需的酶量為1個酶活力單位,即為外切菊粉酶活力,以S表示。每個菌株實驗結果取3次的平均值。
一般認為當I/S>10時,菊粉酶主要表現為內切酶活性,而I/S<10時,主要表現為外切酶活性[21]。
1.3.2 菊糖粗提液的制備
新鮮菊芋洗凈切片,于60 ℃電熱恒溫鼓風干燥箱中干燥24 h,得菊芋干片。以粉碎的菊芋干粉為原料,菊糖熱水提取條件為:料液比1∶15(g∶mL)、溫度80 ℃、時間80 min,重復提取2次,經活性炭脫色,得菊糖粗提液。
1.3.3 酵母菌除雜實驗
1.3.3.1 分析方法
總糖的測定采用硫酸-蒽酮法;還原糖測定采用DNS法;蛋白質含量測定采用考馬斯亮藍法,以牛血清白蛋白繪制標準曲線[20]。
菊糖=總糖-還原糖
(1)
還 原糖脫除率/%=
(2)
蛋 白質脫除率/%=
(3)
菊 糖損失率/%=
(4)
1.3.3.2 單因素試驗
將選取的菊粉酶活力較低的酵母菌株先用YPD培養基,28 ℃活化培養24 h,之后轉接入已滅菌的菊糖粗提液中,28 ℃恒溫振蕩培養12 h,即為除雜酵母種子液。取40 mL菊糖粗提液于250 mL三角瓶中,經滅菌后接入體積分數3%除雜酵母菌種子液,對培養時間、溫度以及搖瓶轉速進行單因素實驗,測定菊糖提取液中的還原糖和蛋白質的脫除率,確定3個因素的適宜條件。
1.3.3.3 正交試驗
基于單因素試驗結果,進行培養時間、溫度及轉速3因素3水平正交試驗,進一步優化酵母菌除雜條件。按公式(5)計算:

×0.5
(5)
1.3.3.4 正交試驗驗證
以正交試驗優化組合條件進行脫除還原糖和蛋白質的驗證試驗;同時對在優化條件下的菊糖損失率進行測定。
1.3.4 菌株的分類學鑒定
將菌株送到上海生工進行測序,引物用上海生工提供的酵母菌通用引物,得到菌株序列后使用Mega 5.1軟件構建系統進化樹將其進行進一步鑒定。
2 結果與分析
2.1 菌株鑒定及其菊粉酶活力測定結果
2.1.1 菌株初步鑒定結果
依據11菌株在WL培養基上經過5 d培養后所形成菌落的顏色和形態特征進行鑒定,其中4株為釀酒酵母(Saccharomycescerevisiae),編號S-1-4;3株為有孢漢遜氏酵母(Hanseniasporauvarum),編號H-1-3;4株為假絲酵母(Candidaspccies),編號Z-1-4。
2.1.2 菌株菊粉酶活力測定結果
從表1可以看出,所有測試菌株的菊粉酶活力普遍低于一些文獻報道[16-17,22-24],因菊糖經過菊粉酶的水解作用可以產生果糖或低聚果糖,對于利用微生物去除菊芋粗提液中單糖的操作是不利的,故要選擇菊粉酶活力較低的菌株。測定菌株中4株釀酒酵母的內切菊粉酶活力(I)均較其他菌株低,其中S-4菌株的I值最低,但其活力比值I/S<10,表現為外切酶活性相對較高,外切型菊粉酶水解菊糖的產物主要為果糖,對純化產生不利影響,不適宜作為除雜菌株。S-2菌株的內切菊粉酶(I)活力僅高于S-4菌株而低于其他菌株,且其I/S>28,因此選擇S-2作為除雜菌株進行以下試驗。
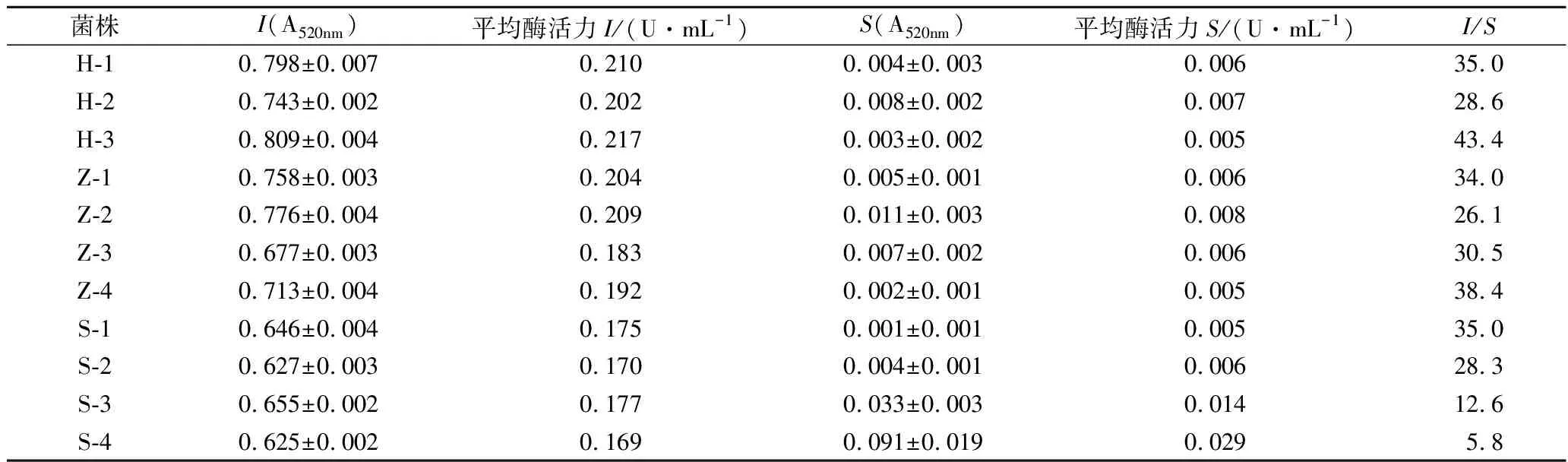
表1 酵母菌株菊粉酶活力Table 1 Inulinase activity of yeast strain
2.2 單因素試驗結果
2.2.1 培養時間對還原糖和蛋白質脫除率的影響
酵母菌培養時間對脫除還原糖和蛋白質的影響見圖1。隨著培養時間的延長,還原糖和蛋白質的脫除率逐漸提高,在50~60 h,脫除率基本穩定。由于菊芋熱水粗提液中含有一定量的果糖、葡萄糖、低聚糖及蛋白質,可作為酵母菌的營養物質,在酵母菌生長繁殖的前中期,營養相對豐富,酵母菌生長速率較高,還原糖和蛋白質的消耗速率較快,表現為其去除率上升趨勢明顯,在40 h之后,糖和蛋白質逐漸被酵母菌消耗殆盡,脫除率即保持相對穩定;培養至70 h之后,還原糖脫除率基本穩定,而蛋白質脫除率略有下降,其原因可能是由于酵母菌開始老化,部分菌體自溶,菌體蛋白溶入提取液中,導致蛋白質含量略有增加。由此可見,控制適當的培養時間對還原糖和蛋白質的脫除是很重要的。
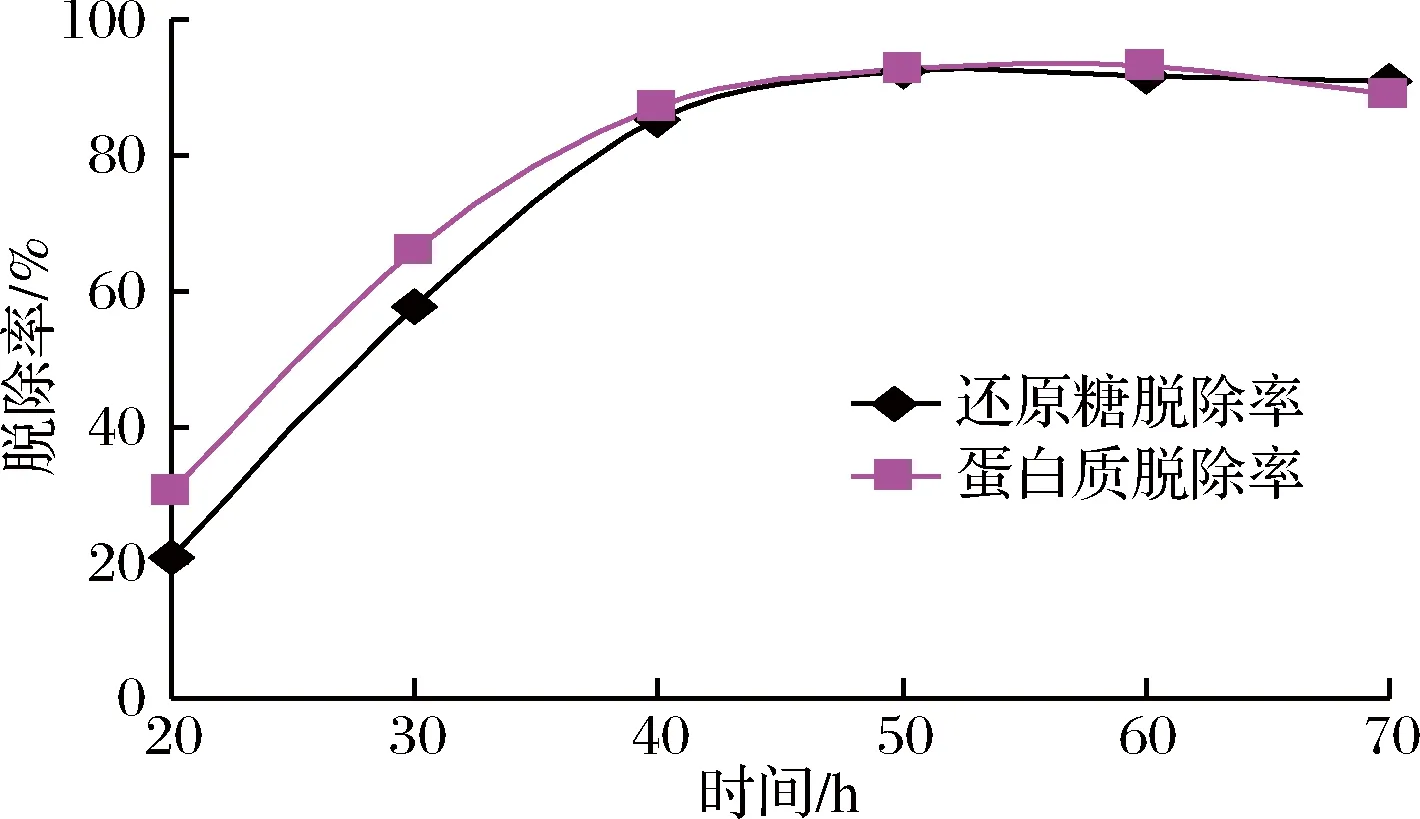
圖1 培養時間對除雜的影響Fig.1 Effect of incubation time on impurity removal
2.2.2 培養溫度對還原糖和蛋白脫除率的影響
溫度對反應體系的影響是多方面的,既影響微生物的生長繁殖、酶的活性,也會影響反應體系的理化狀態。通常酵母菌最適的生長溫度在28~30 ℃,溫度過低或過高,都會影響酵母菌的生長繁殖,由圖2可知,30 ℃左右也是除雜效果較好的溫度。隨著培養溫度的升高,一方面,酵母菌的生長將受到不利的影響,特別是在培養初期溫度偏高還將導致中后期菌體早衰,還原糖和蛋白的脫除率呈現下降趨勢;另一方面,菊粉酶適宜溫度一般為50 ℃左右[25],溫度升高,酵母菊粉酶活性略有提高,菊糖水解產生少量果糖,在一定程度上使還原糖脫除率下降。
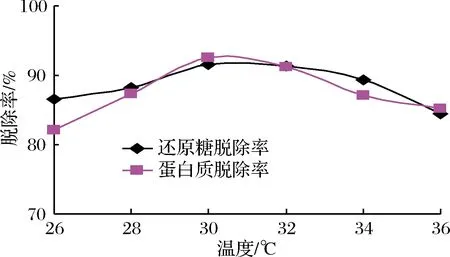
圖2 溫度對除雜的影響Fig.2 Effect of temperature on impurity removal
2.2.3 轉速對還原糖和蛋白脫除率的影響
酵母菌為兼性厭氧微生物,溶解氧含量較高時酵母菌進行有氧代謝,產能效率較高,生長繁殖速率較快。搖瓶轉速的高低直接影響反應體系的供氧量,由圖3可知,隨著轉速的增大,溶氧量增加,酵母菌生長速率加快,還原糖和蛋白脫除率隨之提高;但當轉速在160 r/min以上時,酵母菌的生長繁殖速率趨于穩定,表明溶氧量已超過臨界溶氧濃度,已不再是限制性因素,酵母菌對糖和蛋白質的脫除率也就基本穩定。因此搖瓶轉速在160~180 r/min較適宜。
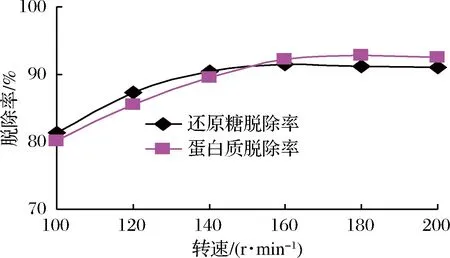
圖3 轉速對除雜的影響Fig.3 Effect of rotational speed on impurity removal
2.3 正交試驗結果
正交試驗結果及分析見表2、表3。
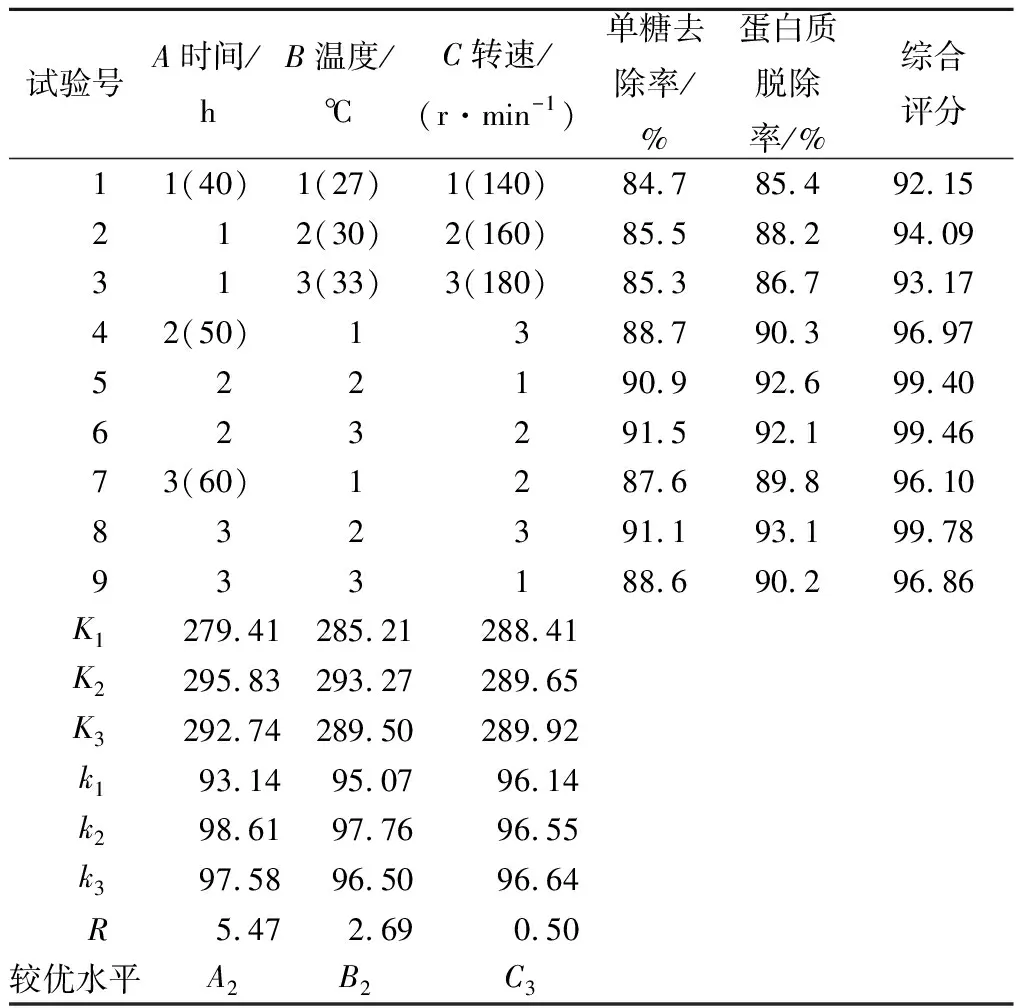
表2 正交試驗結果與分析Table 2 Results of orthogonal tests and rangeanalysis table
注:綜合評分采用加權評分法,分別把2項中最大的指標定為100分,權重系數均為0.5。
從表2和表3可以看出,酵母菌培養時間和溫度對還原糖脫除率的影響極顯著(P<0.01),而搖床轉速在140~180 r/min對還原糖脫除率影響不顯著;3個因素對蛋白質脫除率的影響均極顯著(P<0.01)。通過對還原糖脫除率和蛋白質脫除率的綜合評分,3個因素的影響主次順序為時間>溫度>轉速;較優組合為A2B2C3。
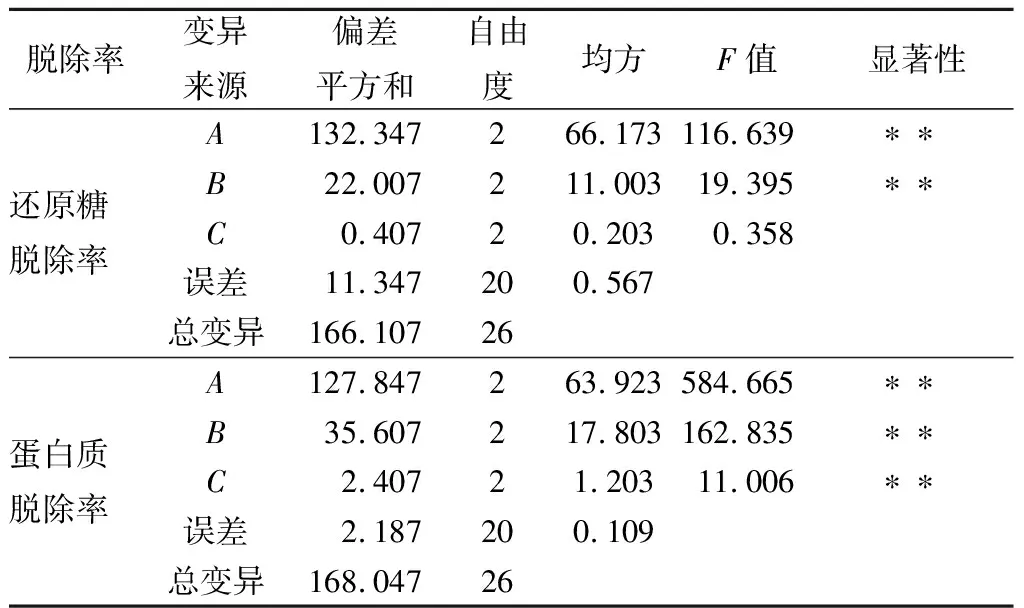
表3 正交試驗方差分析結果Table 3 Result of variance analysis for orthogonalexperiment
2.4 正交試驗驗證結果
因酵母菌搖床培養時轉速在160~180 r/min對脫除率綜合影響不顯著,故以較優組合A2B2C3和A2B2C2做進一步驗證,結果見表4。A2B2C3組合的酵母菌還原糖和蛋白質脫除率分別達92.6%和93.1%,但菊糖損失率略高于A2B2C2組合。考慮到工業化培養微生物時,溶解氧常常是限制性因素,因此可選擇溶氧水平較低的條件,即溫度30 ℃、時間50 h、轉速160 r/min,在此條件下,酵母菌對還原糖和蛋白質的脫除率分別為92.4%和92.9%,菊糖損失率為2.86%,除雜效果達到或優于其他方法[7,12,21-23]。
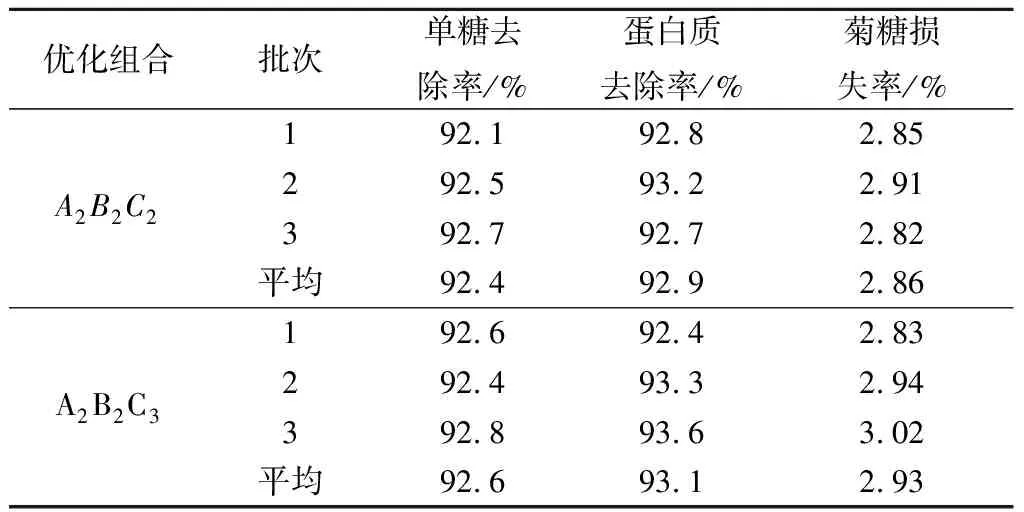
表4 正交試驗驗證結果Table 4 Verification results of orthogonal tests
2.5 分類學鑒定結果
從圖4看出,菌株S-2與來自NCBI數據庫的幾種釀酒酵母(Saccharomycescerevisiae)在一個進化分支上,并且在NCBI中的序列比對結果顯示其相似性在98%以上,表明S-2菌株屬于釀酒酵母。

圖4 系統進化樹Fig.4 Phylogenetic tree
3 結論
本實驗通過對11株酵母菌菌株的菊粉酶酶活力的測定與分析,篩選出1株菊粉酶活力較低的菌株S-2,且該菌株主要表現為內切酶活性。
在對影響酵母菌脫除還原糖和蛋白質的培養時間、培養溫度及搖床轉速單因素試驗的基礎上,進行了正交試驗優化及驗證,結果表明,在培養時間為50 h、溫度30 ℃、搖瓶轉速在160~180 r/min條件下,菌株S-2對還原糖的脫除率大于92%,對蛋白質的脫除率在93%左右,菊糖損失率低于3%。體現出脫雜效果好、菊糖損失少的優點,說明利用微生物脫除菊芋粗提液中的還原糖和蛋白質是可行的。
本實驗所選擇的除雜酵母菌S-2經系統鑒定為釀酒酵母,在食品生產中釀酒酵母已被美國FDA認證為GRAS菌株,不存在食品安全問題。除雜過程中培養產生的菌體可做進一步開發利用,或可通過微生物育種,選擇菊粉酶活性低而菌體蛋白含量高的酵母菌株除雜,菌體可作為飼料蛋白添加劑使用。

