T淋巴細胞對高脂飲食引起的腸道炎癥的影響①
余 璐 劉世博 董莉君 王 輝
(新鄉醫學院醫學檢驗學院,新鄉 453003)
肥胖是一種多因素的、在全球范圍內流行的疾病,與多種慢性疾病相關[1,2]。肥胖及由它引起的各種代謝疾病,包括2型糖尿病、腦血管病(CVD)和癌癥等,已成為21世紀威脅人類健康的重要因素,因此肥胖及相關的代謝綜合征已成為當前研究的熱點。
造成肥胖的因素很多,其中比較重要的便是飲食結構的改變,高脂飲食可誘導肥胖發生。而近年來的許多研究表明,高脂飲食可以改變人體腸道功能與菌群的群落結構,而腸道菌群可以影響人體脂代謝平衡,與肥胖的產生密切相關[3-6]。我們的研究提示高脂飲食會促進小鼠腸道菌群的變化、腸壁變薄以及通透性增加,比如淋巴細胞可能從腸道中漏出,然后通過微循環遷移至脂肪組織[7]。同時高脂飲食條件下,小鼠腸道內特別是中段小腸內發生一些與脂代謝、細胞周期及炎癥免疫有關的分子改變,在尚未出現血清TNF-α升高的時候,腸道組織中特別是小腸組織中TNF-α已經出現升高,腸道炎癥成為肥胖早期的信號。T細胞在免疫系統中處于核心地位,參與各種免疫應答,肥胖可以引起T淋巴細胞介導的各種免疫反應,那么T細胞對高脂飲食引起的腸道炎癥過程中發揮什么樣的作用呢?目前尚缺乏清晰答案。因此本研究通過使用T細胞缺失的小鼠模型,來探究T細胞對肥胖引起的腸道炎癥的影響。
1 材料與方法
1.1材料
1.1.1實驗動物 8周齡、質量約20 g的C57BL/6J小鼠購自北京維通利華公司;CD3ε基因敲除的小鼠由新鄉醫學院梁銀明教授饋贈。兩種小鼠各12只,均隨機分成兩組,每組6只,一組喂食正常飼料,一組喂食高脂飼料,實驗重復3次。所有小鼠均飼養于SPF級別環境,8周大小開始高脂喂養小鼠,每7 d稱量一次小鼠體重,監測生活狀態。
1.1.2試劑 Trizol、逆轉錄試劑盒和SYBR green購自TaKaRa試劑公司。蘇木素染色液、伊紅染色液購于碧云天試劑公司。引物合成于華大基因公司。
1.2方法
1.2.1樣本取材與處理 在實驗后期,用苯巴比妥霧化吸入法麻醉小鼠,通過摘除眼球的方式取血,接著分離小鼠皮下脂肪、附睪脂肪、腸系膜脂肪以及腸道,分離出的皮下脂肪、附睪脂肪、腸系膜脂肪稱量后,分別取3/5組織于新EP管中,標記清楚,立刻放于-80℃冰箱保存,各剩余2/5部分放于包埋框中,置于4%多聚甲醛中,浸泡48 h后,放于脫水機中進行脫水。從胃以下取下整個腸道組織后,用滅菌過的PBS進行沖洗,分出十二指腸、空腸、回腸、盲腸和結腸部分,沖洗干凈后分別取3/5組織于新EP管中,標記清楚,立刻放于-80℃冰箱保存,各剩余2/5部分放于包埋框中,置于4%多聚甲醛中,浸泡24 h后放于脫水機中,脫水后的組織取出后石蠟包埋。
1.2.2組織學分析和免疫組化 脂肪及腸道組織用4%多聚甲醛固定,脫水浸蠟后進行石蠟包埋、切片、攤片、烤片,然后分別進行蘇木精-伊紅染色(H&E)以及進行免疫組織化學(IHC)觀察。
1.2.3實時熒光定量PCR(qRT-PCR) 各種組織的總RNA的抽提使用TaKaRa試劑公司的Trizol試劑及逆轉錄試劑盒,并嚴格按照配套說明書進行操作。基因的轉錄本使用Applied Biosystems公司的7500 Fast real-time PCR system進行擴增,基因相對表達量采用2-ΔΔCt。所用引物序列如表1所示。
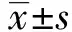

表1 Real-time PCR引物序列Tab.1 Primers used in real-time PCR
2.1高脂飲食誘導肥胖模型產生 我們將小鼠分成4組后,分別對野生型小鼠的一組和CD3ε基因敲除小鼠的一組進行高脂飲食喂養,構建肥胖模型。本實驗體重數據是由每周測一次體重得到,取第2、4、6、8、10、12、14、16周的數據,繪制小鼠體重變化曲線,進行統計學分析。各組小鼠的體重第4周時開始出現明顯的變化,到高脂喂養16周結束后,高脂飲食后的野生型小鼠質量顯著高于正常飲食的野生型小鼠[(40±2.02)g vs (30±2.00)g],高脂飲食后的CD3ε基因敲除小鼠質量也高于正常飲食的CD3ε基因敲除小鼠[(33±0.50)g vs (29±1.10)g],肥胖組小鼠體重增長速率明顯高于對照組,存在顯著性差異(圖1B)。接著我們處死小鼠,解剖取出白色脂肪,分別稱量了4組小鼠的皮下脂肪(SAT)、附睪脂肪(EAT)、腸系膜脂肪(MAT)以及腎周脂肪(PAT)的重量,高脂飲食組明顯高于正常飲食組小鼠(圖1C),且在整個體重的占比中,高脂飲食組也是明顯高于正常飲食組小鼠(圖1D)。這些證據表明,肥胖模型建立成功。
2.2高脂飲食導致野生型小鼠腸道組織發生炎癥 有文獻報道肥胖時,脂肪組織中出現炎癥,同時也會影響其他組織及器官[8],同時我們之前做過研究,高脂飲食后腸道中會出現炎癥[7],于是我們對各組小鼠腸道組織的相關炎性因子及腸道形態進行了檢測。我們采用qRT-PCR方法測定結腸組織炎癥因子mRNA的表達水平,在高脂飲食的野生組小鼠IL-1β、IL-5、IFN-γ、TNF-α基因的mRNA表達水平相比對照組均被顯著上調(P<0.05),同時IL-6的表達水平也出現上調現象(P<0.05)(圖2A),說明高脂飲食能夠引發結腸炎癥。同時通過對結腸組織的病理學切片H&E染色可以看到高脂飲食組腸黏膜發生炎性改變(圖2B),同時高脂飲食組結腸組織肌層厚度明顯變薄(圖2C),說明了高脂飲食可以誘發結腸組織炎癥,與之前的報道結果一致。
2.3T細胞缺失對高脂飲食導致的結腸組織炎癥的作用 為了證實T細胞在高脂飲食導致的腸道炎癥中起作用,我們采用了T細胞缺失的小鼠模型。T細胞根據其表達受體(TCR)類型的不同分為αβT(CD4+或CD8+SP) 細胞和γδT(CD4-CD8-DN)細胞[9,10],眾所周知,CD3是T細胞的表面標志性分子,不論是αβT細胞,還是γδT細胞,都表達ε,因此將CD3ε基因敲除后,T細胞是不存在的。于是分別取野生型與CD3ε基因敲除組小鼠的脾臟和血液進行流式檢測,基因敲除組小鼠脾臟和血液中不含T細胞,說明敲除成功(圖1A)。通過qRT-PCR檢測相關炎性因子,高脂飲食的基因敲除組小鼠的促炎因子IL-1β、TNF-α(P<0.01)、IL-5、IFN-γ(P<0.05)、 IL-6的mRNA表達與高脂飲食的野生型組相比顯著降低(圖3A),說明T細胞缺失時對高脂飲食引起的炎癥反應有一定抑制作用,同時HE染色圖可以更加直觀地觀察到腸道的變化(圖3B),可以看到當基因敲除組的小鼠高脂飲食后,與野生型小鼠高脂飲食后的結腸HE圖對比腸壁厚度增加(圖3C),因此當T細胞缺失時,由高脂飲食導致的腸道炎癥逐漸恢復,T細胞缺失對高脂飲食導致的腸道炎癥有抑制的作用。

圖1 高脂飲食誘導肥胖發生Fig.1 High fat diet induced obesity
2.4T細胞在高脂飲食導致的腸道炎癥過程中對免疫細胞有影響進而影響炎癥 為了探究T細胞在高脂飲食導致的腸道炎癥中如何發揮影響,對免疫細胞有什么影響,我們取小鼠結腸部分進行免疫組化實驗,

圖2 高脂飲食導致野生型小鼠腸道組織發生炎癥Fig.2 High fat diet causes inflammation in intestinal tissue of wild type mice

圖3 T細胞缺失對高脂飲食導致的結腸組織炎癥有作用Fig.3 Absence of T cells has an effect on colonic tissue inflammation induced by high-fat diet

圖4 T細胞在高脂飲食導致的腸道炎癥過程中對免疫細胞有影響進而影響炎癥Fig.4 T cells affect immune cells in process of intestinal inflammation caused by high-fat diet and then affect inflammation
通過對巨噬細胞F4/80的染色,也可以看到,當野生型小鼠高脂飲食后,巨噬細胞浸潤明顯增多(圖4),而T細胞缺失的小鼠高脂飲食后,巨噬細胞反而減少(圖4),說明T細胞的缺失影響了腸道中巨噬細胞的浸潤,進而也對高脂飲食導致的腸道炎癥有影響。
3 討論
肥胖是由不同炎癥因子誘導產生的一種全身性的慢性低度炎癥狀態[11]。在肥胖個體的脂肪或血清中,能夠觀察到高水平的炎癥因子如IL-1β、IL-6、IL-8、TNF-α等。同時已有一些證據提示,肥胖會導致機體其他器官發生炎癥[12,13]。而長期的高脂飲食會導致腸道中出現炎癥性細胞因子水平的增高,特別是腸道組織中IL-6、TNF-α出現升高,因此腸道炎癥成為肥胖早期的信號,最終導致代謝炎癥的發生[14,15]。
本研究使用T淋巴細胞缺失的小鼠進行實驗,通過對CD3ε基因敲除小鼠和野生型小鼠高脂飲食后發現,高脂飲食使野生型小鼠相關炎性因子,如IL-1β、IL-5、TNF-α、IL-6、IFN-γ表達上調,當T淋巴細胞缺失后(CD3ε基因敲除),高脂飲食組基因敲除小鼠相關炎性因子,相比野生型小鼠明顯下調。有文獻報道IFN-γ、TNF-α、IL-6等細胞因子在炎性反應時會明顯升高[16,17],我們的發現與之前的報道結果一致,說明肥胖引起了腸道炎癥的發生。同時,我們發現高脂飲食后野生型小鼠腸黏膜炎性發生改變,免疫組化結果提示結腸組織巨噬細胞增多,符合腸道炎癥改變,與炎性因子的表達也是一致的。當T淋巴細胞缺失后,小鼠結腸組織腸壁變厚,免疫組化結果顯示結腸組織中巨噬細胞浸潤減少,當T淋巴細胞缺失后,小鼠結腸組織腸壁變厚,免疫組化結果顯示結腸組織中巨噬細胞浸潤減少,可能是由于T淋巴細胞的缺乏,導致T淋巴細胞分泌的促炎因子減少,從而使腸道炎癥減弱。說明T淋巴細胞在肥胖導致的炎癥發生中起到了重要作用。
眾多臨床研究證實肥胖會導致機體發生炎癥,而通過免疫細胞來探究腸道炎癥與肥胖之間關系的報道仍舊很少,而我們的研究從免疫細胞的角度探究了免疫細胞與肥胖導致的炎癥的關系。總的來說,我們的研究通過采用了全身缺失T淋巴細胞的小鼠模型,揭示了T淋巴細胞對高脂飲食引起的腸道炎癥有減緩的作用,并初步探究T淋巴細胞可以通過改變巨噬細胞的數量發揮功能。然而,在高脂飲食誘導腸道炎癥發生的過程中,T淋巴細胞究竟是如何招募或活化免疫細胞來發揮作用的?而高脂飲食后形成肥胖以及高脂飲食過程中發生腸道炎癥這兩個過程,是腸道炎癥發生進而產生肥胖,還是肥胖誘導了腸道炎癥的發生,機制仍舊是未知的,這些問題都需要我們進一步研究。

