QuEChERS/超高效液相色譜-串聯質譜法同時測定水產品中四溴雙酚A與六溴環十二烷
于紫玲,左 優,2,馬瑞雪,朱曉輝,朱俊彥,2,陳希超,劉立婷,3,向明燈*,于云江*
(1.環境保護部華南環境科學研究所 國家環境保護環境污染健康風險評價重點實驗室,廣東 廣州 510535; 2.長安大學 環境科學與工程學院 旱區地下水文與生態效應教育部重點實驗室,陜西 西安 710064;3.錦州醫科大學 公共衛生學院,遼寧 錦州 121001)
四溴雙酚A(Tetrabromobisphenol A,TBBPA)和六溴環十二烷(Hexabromocyclododecane,HBCD)作為添加型阻燃劑,廣泛應用于電子產品、塑料、紡織品和建筑材料等[1-2]。其中,HBCD主要有α-HBCD、β-HBCD和γ-HBCD 3種同分異構體。近年來,TBBPA和HBCD對人體健康的影響備受關注。美國國家毒理學計劃(NTP)的研究顯示,TBBPA暴露能增加雌性大鼠的子宮腫瘤發生率[3]。此外,國際癌癥研究中心也將TBBPA提升為2A類致癌物[4]。歐洲化學品管理署指出HBCD是一類具有持久性、生物累積性和毒性的化合物,并將其列入《斯德哥爾摩公約》禁止在全球范圍內使用[5]。目前,各環境介質和生物樣本中均檢出TBBPA和HBCD[6-8]。Schecter等[9]對美國市場310份食品中HBCD的調查顯示,HBCD的含量范圍為23~593 pg/g。Shi等[10]對中國16個省份人體母乳中TBBPA和HBCD的檢測結果顯示,其平均含量分別為7.58 ng/g(脂重)和10.1 ng/g(脂重)。歐洲食品安全局(EFSA)呼吁各成員國提供食品中TBBPA和HBCD的研究數據,以評估兩者的環境風險[11-12]。但提供的652份樣品中TBBPA的分析結果大多低于檢出限,且未檢出的樣品類型主要為魚類等水產品(n= 465)[11]。因此,迫切需要建立更為準確可靠的水產品中TBBPA和HBCD的分析方法。
目前,單獨對TBBPA和HBCD的儀器分析技術已相對成熟,主要采用液相色譜-質譜聯用儀測定[13-14],TBBPA和HBCD作為溴代阻燃劑的添加劑,通常同時存在,且分析檢測方法相近,因此可將這兩類物質進行同時分析[15-16]。通常這兩類物質的前處理主要采用索氏提取法、超聲提取法和加速溶劑萃取法等提取后,再經層析柱、自動凝膠滲透色譜(GPC)等凈化手段,操作過程繁瑣,無法滿足常規監測的時效性要求[6-10,17]。施致雄[17]建立了同時測定動物源性食品中TBBPA和HBCD的超高效液相色譜-質譜方法,其中前處理采用傳統的索氏提取法,樣品凈化采用GPC結合濃硫酸除脂,該方法雖能達到很高的回收率,但操作復雜,耗時(20 h)且所耗溶劑較多(150 mL)。QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)方法是美國農業部Anastassiades教授等[18]提出的一種新的快速樣品前處理技術,具有準確、簡便、快速、高效、成本低等優點。但該方法主要針對農產品中農藥殘留的高效分析,應用于水產品中TBBPA和HBCD的分析檢測報道甚少[19-21]。本文建立了基于QuEChERS提取和凈化為一體的水產品中TBBPA和HBCD的超高效液相色譜-串聯質譜(UPLC-MS/MS)分析方法,通過快速、有效的樣品前處理步驟,保證TBBPA和HBCD的有效提取,為水產品健康風險評估提供了更為簡便、靈敏和可靠的分析方法。
1 實驗部分
1.1 儀器與試劑
Agilent 1260 超高效液相色譜(美國安捷倫科技有限公司),AB SCIEX4000Qtrap MS三重四極桿串聯質譜儀(SCIEX 公司);E-916/914加速溶劑萃取儀、R-215旋轉蒸發儀(瑞士Buchi公司);N-EVAPTM112氮吹儀(美國Oranomation Associates);Milli-Q超純水器(美國Millipore公司);R-470C冷凍干燥機(美國SP Scientific公司);SX-13-10馬弗爐(滬越科學實驗儀器廠);Model 945617渦旋混合器(美國Talboys公司);高速離心機(美國賽默飛世爾科技公司)。
甲醇(色譜純,德國Merck公司);丙酮、二氯甲烷、正己烷、乙腈(色譜純,德國CNW科技公司);N-丙基乙二胺(PSA)、C18(天津博納艾爾杰公司);無水硫酸鈉(廣州市化學試劑廠)。
TBBPA、α-HBCD、β-HBCD、γ-HBCD、13C-TBBPA標準物質(美國Cambridge Isotope Laboratories),D18-α-HBCD、D18-β-HBCD、D18-γ-HBCD內標(美國AccuStandard公司)。
1.2 儀器條件
1.2.1液相色譜條件CORTECS?C18色譜柱(4.6 mm×100 mm×2.7 μm,美國Waters公司);流動相:A為甲醇,B為超純水。梯度洗脫程序為:0~4.5 min,90% A;4.5~5.5 min,90%~100% A;5.5~6.5 min,100% A;6.5~10 min,100%~90% A。流速為0.7 mL/min,進樣量為10 μL,柱溫為40 ℃。
1.2.2質譜條件采用電噴霧離子源(ESI),在負離子模式下以多反應監測(MRM)方式分析。電噴霧電壓為-4 500 V;入口電壓為-10 V;碰撞室出口電壓為-15 V;TBBPA和HBCD各單體的母離子、子離子、去簇電壓和碰撞能量見表1。

表1 TBBPA和HBCD優化的質譜條件Table 1 MS parameters for the analysis of TBBPA and HBCD
* quantitative ion
1.3 樣品前處理
準確稱取1 g(精確至0.001 g)樣品至15 mL離心管中,加入20 μL 2.5 mg/L13C-TBBPA 和D18-HBCD混合內標,加入2 mL飽和氯化鈉和4 mL乙腈,渦旋振蕩10 min,7 500 r/min離心5 min,轉移上清液至15 mL離心管中。重復萃取2次,氮吹定容至1 mL后轉移溶液至2 mL裝有50 mg無水硫酸鎂和50 mg C18的離心管中,渦旋振蕩10 min,10 000 r/min離心5 min,上清液過0.22 μm親水聚四氟乙烯(PTFE)濾膜,待測。
2 結果與討論
2.1 質譜與液相色譜條件的優化
2.1.1質譜條件的優化采用針泵進樣的方式,將500 μg/L 的TBBPA和HBCD各單標溶液以20 μL/min的流速連續注入ESI源中,在負離子監測模式下分別進行Q1和Q3掃描確定母離子和子離子對,然后優化各化合物的去簇電壓和碰撞能量等質譜參數。TBBPA和HBCD的最佳質譜條件如“1.2.2”所示。
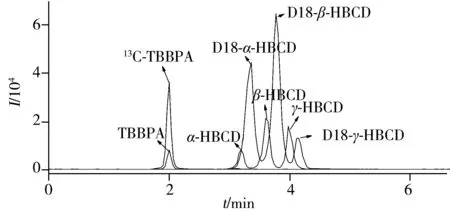
圖1 TBBPA和HBCD單體的總離子流圖Fig.1 Total ion chromatograms(TIC) of TBBPA and HBCD isomers
2.1.2液相色譜條件的優化采用CORTECS?C18(4.6 mm×100 mm×2.7 μm)為分離色譜柱,比較了乙腈-水和甲醇-水溶液作為流動相的分離效果。結果表明,此2種流動相均能達到良好的分離效果,但乙腈-水作流動相時目標峰的響應值較低,因此本研究選用甲醇-水為流動相。10 μg/L 加標貝肉組織勻漿樣品中TBBPA和HBCD各單體的總離子流圖見圖 1。
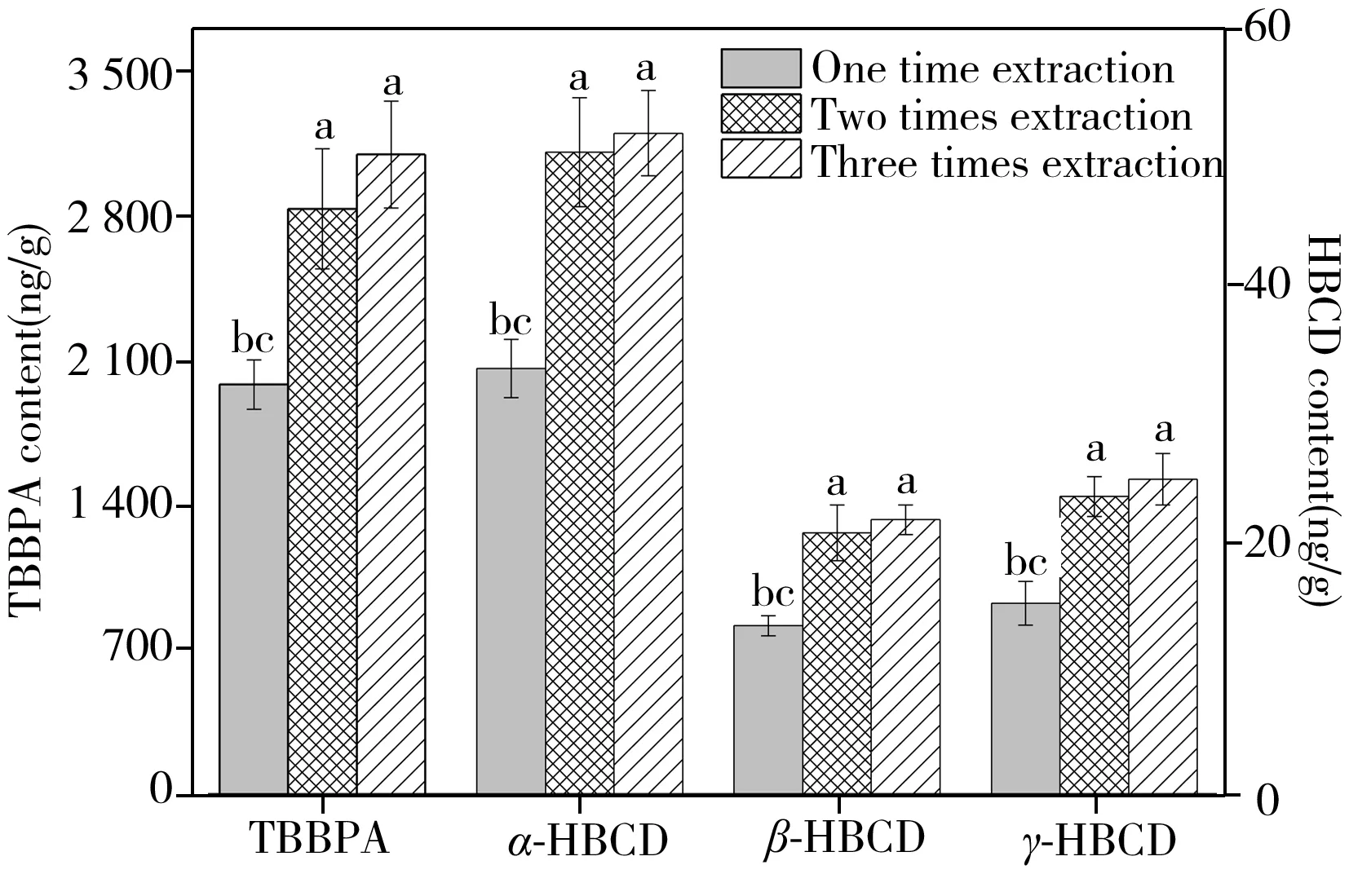
圖2 不同萃取次數對TBBPA和HBCD提取效果的影響Fig.2 Effects of extraction time on extraction efficiencies of TBBPA and HBCD isomers compare with one time(a),two times(b) and three times(c) extraction,p<0.05

圖3 不同C18用量對TBBPA和HBCD回收率的影響Fig.3 Effects of C18 content on recoveries of TBBPA and HBCD isomers compare with C18 of 25 mg(a),50 mg(b) and 100 mg(c),p<0.05
2.2 提取條件的優化
2.2.1萃取次數的影響以1 μg/L HBCD和0.5 μg/L TBBPA暴露7 d后的河蚌組織勻漿樣品為研究對象,選用QuEChERS樣品提取方法,比較了不同萃取次數對TBBPA和HBCD各單體的提取效率(圖2)。結果表明,樣品萃取1、2和3次時,TBBPA的含量分別為1 984±119、2 833±291和3 097±259 ng/g(干重),其中萃取2次和3次提取出的TBBPA含量顯著高于萃取1次(p<0.05),而萃取2次和3次提取的含量不存在顯著差異(p>0.05)。萃取次數對HBCD各單體提取效率的影響與TBBPA類似。因此,為減少溶劑消耗以及提高處理效率,本研究選擇萃取次數為2次。
2.2.2與加速溶劑萃取方法的比較對比了QuEChERS法和加速溶劑萃取法(ASE)對樣品中TBBPA和HBCD的提取效率。ASE法參照文獻[22]:以正己烷-二氯甲烷(體積比1 ∶ 9)為提取溶劑,萃取溫度為90 ℃,靜態提取時間為4 min,循環3次。結果表明,ASE法提取的TBBPA含量(2 919±146 ng/g)略高于QuEChERS法(2 833±291 ng/g),但差異不顯著(p>0.05);ASE法提取的HBCD各單體含量略高于QuEChERS法,也不存在顯著差異(p>0.05)。因此,QuEChERS方法用于提取水產品中TBBPA和HBCD基本能滿足分析需要。
2.3 凈化方法的優化
2.3.1吸附填料的選擇QuEChERS法的常用凈化劑為C18、PSA及石墨化炭黑(GCB)等吸附填料[23-24]。C18主要去除脂肪等弱極性的干擾物;PSA主要去除極性物質、有機酸、碳水化合物及少量色素;GCB主要去除色素成分,但同時也對苯環官能團具有較強的吸附能力。因此本研究比較了PSA、C18以及PSA+C18組合對TBBPA和HBCD凈化回收率的影響。結果表明,PSA和PSA+C18均能完全吸附TBBPA,C18對TBBPA的回收率則為(86.6±7.2)%。對于HBCD,使用PSA時,α-HBCD、β-HBCD和γ-HBCD的回收率分別為(84.9±2.8)%、(79.0±2.8)%和(78.4±0.83)%;使用PSA+C18時,各單體的回收率分別為(88.3±4.9)%、(79.8±2.6)%和(84.1±2.8)%;而使用C18時,各單體的回收率可達到80%~100%。綜上,C18凈化對TBBPA、α-HBCD、γ-HBCD的回收率顯著高于PSA(p<0.5),而PSA對β-HBCD的回收率無顯著影響。因此,本研究選用C18作為凈化劑。
2.3.2C18用量的選擇考察了C18用量(25、50、100 mg)對TBBPA和HBCD凈化回收率的影響(圖3)。結果顯示,25、50、100 mg C18對TBBPA和HBCD各單體凈化的回收率均可達到81%~116%;其中50 mg 和100 mg的C18對β-HBCD凈化的回收率顯著高于25 mg C18(p<0.05);而C18不同用量對TBBPA、α-HBCD和γ-HBCD的凈化回收率則無顯著差異(p>0.05);進一步增加C18用量對凈化效果并無明顯改善,因此本研究選用50 mg C18進行凈化。
2.3.3與GPC凈化方法的比較對比了QuEChERS法和GPC法對樣品中TBBPA和HBCD的凈化效果。GPC法參照文獻[25-27]方法并做了優化:先將GPC柱中溶劑放出至填料露出液面,上樣后用70mL正己烷-二氯甲烷(1 ∶ 1)淋洗,最后用50 mL正己烷-二氯甲烷(1 ∶ 1)洗脫。結果表明,采用QuEChERS法對TBBPA的回收率為(118±7.5)%,GPC法的回收率為(110±11.2)%;對于HBCD各單體,QuEChERS法的回收率為(102±1.6)%~(120±2.3)%,GPC法則為(113±10.6)%~(123±12.5)%。兩種方法無顯著差異(p>0.05),但由于GPC法涉及樣品轉移、旋蒸濃縮、氮吹濃縮等步驟,過程相對繁瑣,因此本研究選擇QuEChERS方法凈化。
2.4 基質效應評價
基質效應(Matrix effect,ME)可通過ME=(基質標準溶液所作曲線的斜率/無基質標準溶液所作曲線的斜率-1)×100% 進行評價,ME為負值表示存在基質抑制效應,正值表示存在基質增強效應,其絕對值越大則基質效應越強[20-21,24,28]。當|ME|<20% 時,為弱基質效應,可忽略;20%≤|ME|≤50% 時,為中等程度基質效應;|ME|>50% 時,為強基質效應,需對基質效應進行補償[29]。本研究采用空白魚肉樣品制備的萃取液和乙腈溶劑分別配制待測物的基質匹配標準曲線和無基質匹配的標準曲線,質量濃度分別為0.5、1、5、25、50、100、200、300、500 μg/L,用于評價本方法的基質效應。結果顯示,TBBPA、α-HBCD、β-HBCD和γ-HBCD的ME分別為-0.30%、-34.5%、-2.17%和-7.37%,表現為弱到中等的基質抑制效應。因此,本研究采用基質匹配標準曲線,以降低基質效應的影響。
2.5 線性范圍、檢出限與定量下限
在優化實驗條件下,用空白魚肉樣品提取液配成0.5、1、5、25、50、100、200、300、500 μg/L的基質匹配標準溶液,采用本方法進行分析,以目標物的質量濃度(X,μg /L)為橫坐標,相應的峰面積與對應內標峰面積的比值(Y)為縱坐標繪制基質匹配標準曲線。結果顯示,TBBPA和HBCD各單體在0.5~500 μg/L范圍內呈良好的線性關系(r>0.998)。分別以目標物母離子的3倍信噪比(S/N=3)和10倍信噪比(S/N=10)確定方法檢出限(LOD)和定量下限(LOQ),得到TBBPA、α-HBCD、β-HBCD和γ-HBCD的LOD分別為0.08、0.07、0.04、0.16 μg/kg;LOQ分別為0.25、0.25、0.12、0.55 μg/kg。
2.6 回收率與相對標準偏差
選用魚、蝦和貝肉3種空白樣品,對TBBPA和HBCD進行加標回收試驗,加標水平為5、20、50 μg/kg,每個加標水平重復測定6次,采用內標法定量。結果表明,TBBPA和HBCD的回收率為74.0%~121%,相對標準偏差(RSD)為 0.20%~23%(表2)。

表2 TBBPA和HBCD的回收率及相對標準偏差(n=6)Table 2 Average recoveries and relative standard deviations of TBBPA and HBCD(n=6)
2.7 實際樣品的測定
采用該方法對清遠采集的鯉魚、日本沼蝦和田螺3種淡水生物體中TBBPA和HBCD含量進行分析(表3)。結果表明,上述樣品中TBBPA的含量為26.0~370 ng/g(干重,下同),α-、β-和γ-HBCD的含量分別為8.64~38.3 ng/g、2.01~22.9 ng/g和3.70~16.2 ng/g。
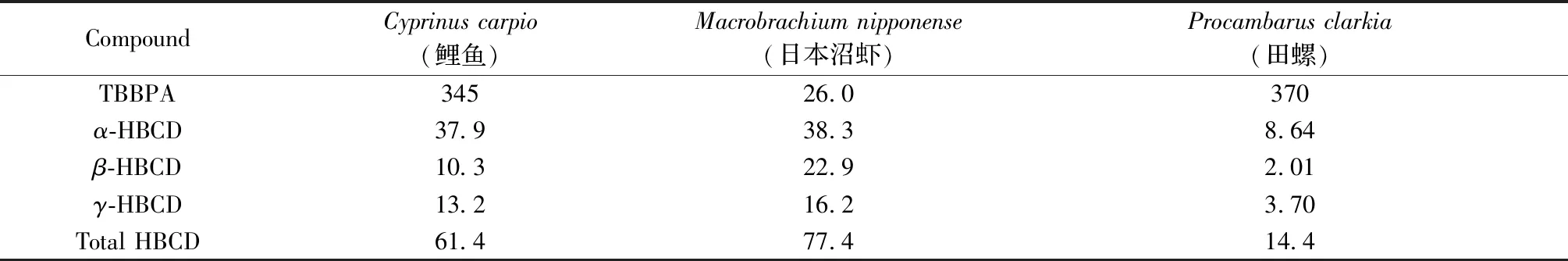
表3 實際樣品中TBBPA和HBCD的分析結果(ng/g,干重)Table 3 Contents of TBBPA and HBCD in real samples(ng/g dry weight)
3 結 論
本文建立了快速分析水產品中TBBPA和HBCD含量的QuEChERS/UPLC-MS/MS方法,檢出限為 0.04~0.16 μg/kg,定量下限為0.12~0.55 μg/kg,實際樣品的加標回收率為74.0%~121%,RSD為 0.20%~23%。該方法簡便、快速、靈敏度高,可滿足批量水產品中TBBPA和HBCD的定量分析需求。

