慢性束縛應激對小鼠食管上皮細胞間距增寬及炎癥發生的研究
買買提·依斯熱依力 趙新勝 艾克拜爾·艾力 李義亮 阿孜古麗·阿力木江賽米·賽麥提 閆晶 克力木·阿不都熱依木
胃食管反流病(gastroesophageal reflux disease,GERD)是消化系統常見的疾病,其發生發展與心理因素密切相關。焦慮和抑郁等心理疾病增加罹患GERD的風險,同時會導致GERD癥狀的加重[1]。食管上皮的通透性取決于緊密連接(tight junction,TJ)蛋白的完整性。研究發現,食管黏膜暴露于酸或酸化的胃蛋白酶環境會使TJ蛋白破壞,從而造成細胞旁通路對水、電解質和小分子物質的通透性增加,導致食管鱗狀上皮出現細胞間隙增寬(dilated intercellular space,DIS)[2]。GERD患者食管上皮TJ蛋白表達異常可直接導致食管上皮DIS,這一組織學變化也許能作為GERD食管形態超微結構異常的客觀指標[3]。這可能是部分難治性GERD患者使用質子泵抑制劑(proton pump inhibitors,PPI)治療后,癥狀仍持續存在的原因之一。國內外的研究發現,活性氧(reactive oxygen species,ROS)在許多疾病發展中發揮著重要作用,也被認為是GERD、Barrett食管的發病重要機制之一[4]。因此,本研究通過建立小鼠慢性束縛應激(Stress)模型,探討心理應激對食管ROS、抗氧化蛋白、TJ蛋白以及炎癥發生的作用。
材料與方法
一、對象
8周齡,SPF級雄昆明小鼠20只,購于新疆實驗動物研究中心,許可證號:SCXK(新)2011-0001;實驗小鼠飼養于新疆維吾爾自治區維吾爾醫藥研究所IVC系統動物中心。全例小鼠采用Microsoft Office Excel軟件隨機分2組(每組10只),即慢性束縛應激組和對照組。小鼠單只飼養在自由進食水的鼠籠內,每日給予12 h晝夜循環,光照均始于8:30分,止于20:30分。
二、方法
1.Stress模型的建立:造模方法,參照我們的前期研究[5-7],大體實驗步驟如下;10只慢性束縛應激組小鼠置于用50 ml離心管所制的自制式束縛器中(離心管提前燙制出直徑約5 mm的通氣孔若干,分布于左右及上側管壁,管口塑料蓋做1小孔以暴露小鼠尾巴),束縛應激均在每日上午10:30~12:30進行,每日限制活動2 h,期間禁食禁水,后放回鼠籠內自由活動,連續束縛14 d。對照組小鼠自由飲水攝食,其余時間2組小鼠處理相同。
2.取材與標本處理:束縛應激第14天下午17:00開始對2組小鼠均進行禁食,于次日上午11:00進行取材。麻醉的小鼠以平臥位固定,從腹部正中至劍突取切口取3 cm切口,下腔靜脈取血注入于1.5 ml EP管中。在距離胃食管交界處0.3 cm處和1.5 cm處剪斷取材,置于4%中性甲醛固定。
3.食管組織病理學檢查:食管標本4%中性甲醛固定24 h后水洗、脫水、透明、浸蠟、包埋,制成4 μm厚切片行H&E染色。
4.間隙測量:2組食管組織常規HE染色后,光學顯微鏡(油鏡)下放大1000倍,并在不同部位上拍攝10張光鏡照片,使用Image J等圖像處理軟件數字化測量細胞間隙。
5.實時定量RT-PCR:采用實時定量(reverse transcription-polymerase chain reaction,RT-PCR)方法檢測Nox-4、核轉錄因子E2相關因子2(Nuclear factor erythroid 2 related factor 2,Nrf-2)、血紅素氧合酶-1(Heme oxygenase,HO-1)、閉合蛋白-1(Claudin-1)、閉合蛋白-4(Claudin-4)、咬合蛋白(Occludin)及胞質緊密黏連蛋白-1(Zonula occludens, ZO-1)、單核細胞趨化蛋白-1(Monocyte chemotactic protein 1,MCP-1)、白細胞介素-1β(Interleukin-1β,IL-1β)以及腫瘤壞死因子α(Tumor necrosis factor α,TNF-α)的指標的mRNA表達。取每只小鼠食管組織25 mg,采用TRIzol試劑提取總RNA,采用天根公司Fast Quant RT試劑盒合成第1鏈cDNA。由上海生工生物工程股份有限公司設計并合成引物,各指標及β-肌動蛋白(actin)引物序列見表1。RT-PCR反應嚴格按照本研究組前期研究以及試劑盒操作說明進行。反應結束后由電腦自動得出熒光曲線及CT值,采用2-△△CT計算出目標基因的相對表達倍數。
6.酶聯免疫吸附(ELISA)測定:取血后不經任何處理,4℃下靜置2 h,之后以3500 rpm/min的速度低溫離心5 min,取上層血清,-80℃保存,用于后續測定。采用酶聯免疫吸附測定(Enzyme linked immunosorbent assay,ELISA)法檢測血清中NADPH氧化酶-4(NADPH oxidase-4,Nox-4)、8-羥基脫氧鳥苷(8-hydroxydeoxyguanosine,8-OHdG)及丙二醛(Malondialdehyde,MDA)的含量。實驗過程及測量指標濃度的計算嚴格按試劑盒說明書進行。
三、統計學分析
運用SPSS 22.0軟件進行分析,符合正態分布的計量資料均以(±s)表示,2組間比較采用t檢驗。以P<0.05為差異有統計學意義。
結 果
一、Stress對小鼠食管上皮細胞間距增寬的影響
對照組小鼠食管上皮細胞鏡下測量的平均細胞間隙為(0.64±0.04)μm,慢性束縛應激組(1.16±0.02)μm,差異有統計學意義(t=20.63,P<0.05)。見圖1。
二、Stress對食管氧化應激的影響
ELISA實驗結果顯示,與對照組相比,慢性束縛應激組小鼠血液中Nox-4[(9.72±1.80)ng/mlvs(4.54±0.46)ng/ml]、8-OHdG[(4.94±0.58)ng/mlvs(1.44±0.16)ng/ml以及MDA(3.56±0.41)ng/mlvs(1.02±0.12)ng/ml]的釋放濃度明顯高于對照組,且差異有統計學意義(t=25.54,19.62,13.67,P均<0.05)。見圖2。
三、Stress對食管抗氧化蛋白的影響
抗氧化蛋白的RT-PCR實驗結果顯示,慢性束縛應激組食管組織中Nrf-2和HO-1的mRNA轉錄水平顯著低于對照組,差異有統計學意義(t=-10.36,-9.28,P<0.05)。見圖3。

表1 實時定量RT-PCR引物序列

圖1 2組食管上皮細胞間隙測量

圖2 2組食管組織氧化應激指標的mRNA表達情況
四、Stress對食管TJ蛋白的影響
2組小鼠食管組織TJ蛋白重要指標的RT-PCR實驗結果顯示,慢性束縛應激組TJ蛋白如Claudin-1、Claudin-4、Occludin及ZO-1的mRNA轉錄水平明顯低于對照組,差異有統計學意義(t=-10.23、-9.65、-7.81、-8.75,P<0.05)。見圖4。
五、Stress對食管炎癥因子的影響
2組小鼠食管組織炎癥因子指標的RT-PCR實驗結果顯示,慢性束縛應激組炎癥因(MCP-1、IL-1β、TNF-α)的mRNA轉錄水平顯著高于對照組,差異有統計學意義(t=31.42、42.37、46.83,P<0.05)。見圖5。
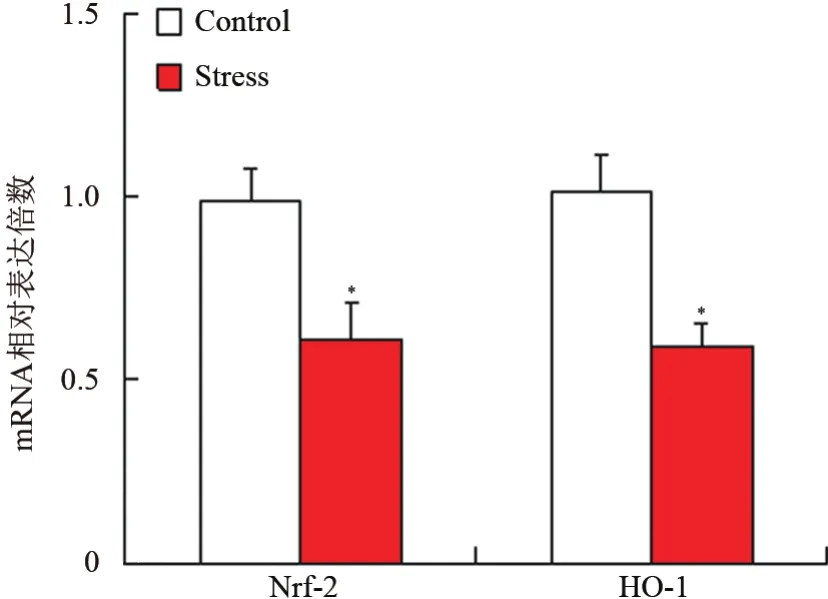
圖3 2組食管氧化蛋白的mRNA表達情況
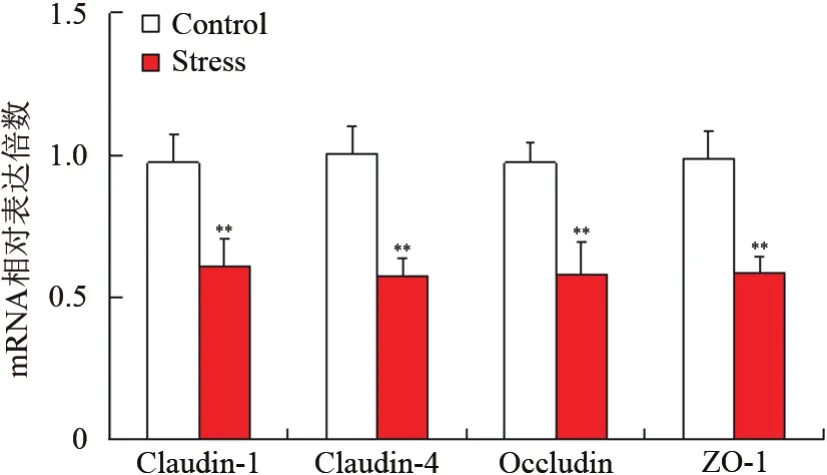
圖4 2組食管組織TJ蛋白的mRNA表達情況

圖5 2組食管組織炎癥因子的mRNA表達情況
討 論
食管黏膜防御功能主要由上皮屏障構成,任何一種或多種防御機制的缺陷均可導致食管對胃內容物(胃酸)清除能力降低,繼而引起食管上皮損傷,食管上皮TJ蛋白的表達下降是其重要發生機制[8]。食管鱗狀上皮對酸性胃液非常敏感。GERD患者在長期持續的胃液刺激下,食管下段的黏膜發生炎癥細胞浸潤,上皮細胞增生以及DIS等一系列的改變[9]。研究發現,酸反流無明顯的GERD患者與健康對照組患者相比食管上皮DIS非常明顯,反流性食管炎和非糜爛性食管炎患者均存在不同程度的食管上皮的DIS[10]。當食管上皮DIS持續存在時,伴隨H+過多彌散入細胞胞漿和細胞間隙,碳酸氫鹽等化學屏障不能夠緩沖H+時,H+刺激細胞間隙的酸敏感傷害感受器,導致燒心癥狀的產生[11]。
GERD是一種多疾病癥候群而非單一的發病機制所致,反流癥狀(燒心、疼痛)會嚴重影響患者的精神和心理狀態。心理應激是機體在受到心理、環境及生理性應激源刺激時所出現的非特異性全身反應。焦慮、抑郁等心理應激與食管高敏感性有著較密切的聯系[12]。國外的研究者,在心理壓力大鼠模型中發現,壓力后大鼠無出現明顯的酸反流,而食管上皮細胞間隙出現明顯的增寬、通透性增加以及酸敏感受體的大量表達等現象[13]。本研究發現,接受為期2周的心理應激后小鼠出現食管上皮的DIS(1.16±0.02)μm,與對照組(0.64±0.04)μm相比,存在明顯的差異。
心理壓力增高是誘導ROS發生的重要機制,而ROS也在GERD、Barrett食管和腺癌等諸多疾病的進程中發揮著重要作用[14]。細胞內產生的過量的ROS就能引起生物膜脂質過氧化,細胞內蛋白及酶變形,DNA損害,最后導致細胞凋亡,組織氧化損傷。ROS與促炎癥細胞因子常常在炎癥部位同時存在,ROS能上調促炎癥因子的基因表達水平,同時,促炎癥細胞能誘導ROS的生成,兩者形成正反饋環[15]。國外研究者發現,反流大鼠模型中,GERD發病機制由內源性ROS過度產生有關的,使用抗氧化劑后發現食管組織ROS的產生被抑制,黏膜炎癥發生同時也得到了有效的控制[16]。ROS參與食管黏膜的損傷過程,激活細胞內核因子Kappa B(Nuclear factor-kappa B,NF-κB)信號傳導通路并促進炎癥因子如白細胞介素-8(IL-8)和TNF-α的轉錄水平,使炎癥效應繼續擴大,食管黏膜的損傷不斷加重[17]。NADPH氧化酶(NADPH oxidase,Nox)為細胞內一組具有氧化活性的酶復合體,是主要的ROS來源,有6個同源物(Nox-1, Nox-3, Nox-4, Nox-5, DUOX1,DUOX2),其中Nox-4與ROS關系較密切的氧化酶[18]。8-OHdG的形成是反應組織DNA氧化損傷和致癌的重要生物標記物(Bio-marker)。ROS的代謝產物MDA和不飽和醛引起蛋白質交聯,使蛋白質失去功能,還具有致突變,致癌活性等作用[19]。這些重要ROS標記物在食管組織中表達及上皮細胞DIS發生中的意義仍需進一步的研究。
細胞內同時具有幾種抗氧化蛋白體系,例如;Nrf-2以及下游基因HO-1是細胞內抗氧化防御的重要蛋白,能防止活性氧的損傷作用[20]。Nrf-2/HO-1通路調控組織或細胞內內源性解毒酶及抗氧化應激酶的表達[21]。Chen等[22]研究發現,Nrf-2基因敲除小鼠出現胃酸反流并導致食管及胃底角化,Nrf-2缺乏進一步減少了被回流抑制的單層細胞的跨膜電阻值,從而引起食管DIS、黏膜損傷并使得食管上皮屏障功能異常。因此,機體受到心理應激作用導致ROS產生過多,超出機體氧化物的清除能力,使氧化與抗氧化系統失衡,而引起氧化損傷的加重。本研究結果顯示,Stress小鼠食管組織中ROS重要指標(Nox-4、8-OHdG、MDA)和抗氧化蛋白(Nrf-2、HO-1)的mRNA表達以及血液中的釋放濃度與對照組相比,存在明顯的差異,證實了心理應激可誘導食管組織ROS的過量表達和抗氧化蛋白的降低。更重要的是,心理應激后小鼠食管上皮TJ蛋白指標(Claudin-1、Claudin-4、Occludin、ZO-1)以及促炎癥因子(MCP-1、IL-1β、TNF-α)的mRNA表達量,與對照組相比,存在明顯的差異。因此,我們認為氧化/抗氧化防御系統的平衡在維持食管黏膜穩態及屏障中發揮著重要的作用。
綜上,食管黏膜的損傷,酸反流,食管動力學的改變等都不能完全全面地解釋GERD燒心、胸痛的癥狀的發生[23]。以DIS為代表的食管上皮屏障破壞,可使迷走神經末梢暴露,引起其對各種刺激的反應敏感化,甚至使分布于黏膜上層內的神經突起產生興奮,從而導致軸突末梢釋放神經遞質,直接引起食管感覺異常及疼痛反應[24]。本研究前期的工作中發現,不同亞型GERD(非糜爛性反流病、反流性食管炎)患者中酸反流可激活致敏指標(TRPV-1、PAR-2)受體,進而引起食管高敏感性產生[25]。結合我們前期研究和根據本研究結果,我們認為心理壓力使食管氧化、抗氧化防御系統受損,進而出現食管上皮存在的TJ蛋白結構和功能的異常,可能是GERD發病機制之一。然而,那些有GERD癥狀而無酸反流的患者癥狀產生機制尚未清楚,心理壓力與食管超微結構改變的確切的機制也待進一步研究明確。

