抗反流手術對體重的影響
吾布力卡斯木·吾拉木 艾克拜爾·艾力 李義亮 買買提·依斯熱依力賽米·賽麥提 阿卜杜喀迪爾·阿卜杜熱合曼 克力木·阿不都熱依木
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃內容物反流至食管引起胃灼熱和反酸為主的食管內癥狀以及食管外癥狀的上消化道常見病,其發病率在不同國家、地區存在較大的差異。食管裂孔疝(hiatal hernia,HH)是指腹腔內臟器,主要是胃,通過膈食管裂孔進入胸腔所致的疾病,在膈疝中最常見的一種,其占90%以上。HH是GERD常見的病因之一,兩者有著密切的聯系。本研究通過對GERD合并HH患者行腹腔鏡下食管裂孔疝修補術聯合Nissen胃底折疊術,根據術后隨訪記錄,主要分析該手術對體重的影響。
資料與方法
一、對象
納入2017年11月至2018年12月于新疆維吾爾自治區人民醫院微創、疝和腹壁外科住院患者中行GerdQ評分、24 h動態pH監測、食管測壓、胃鏡及上消化道鋇餐造影檢查已明確診斷GERD合并食管裂孔疝的患者共73例。其中男性43例,女性30例;年齡52.14(37~79)歲。本研究經醫院倫理委員會審查通過,所有患者均簽署知情同意書。
納入標準:(1)年齡>18歲;(2)GerdQ量表評分≥8;(3)術前胃鏡、食管高分辨率測壓、24 h食管動態pH檢測、上消化道鋇餐造影檢查等均支持GERD合并HH診斷[1];(4)對于非糜爛性胃食管反流病(non-erosivegastroesophagealrefluxdisease,NERD)的診斷,要求GerdQ量表評分≥8,食管24 h動態pH監測陽性,但內鏡下未見糜爛性食管炎或Barrett食管;(5)患者自愿接受隨訪并配合專職人員做好相關記錄。
排除標準:(1)合并嚴重心肺疾病對手術不能耐受的患者;(2)不愿承擔手術風險未能簽署手術同意書的患者;(3)麻醉過敏患者;(4)手術后失訪患者。
二、方法
1.手術方法:采用腹腔鏡食管裂孔疝修補聯合Nissen胃底折疊術,麻醉方式為氣管插管全麻,手術體位選擇頭高腳低右傾斜臥位,兩腿外展分開。手術步驟:常規消毒,鋪無菌巾單,經臍上12 mm縱形切口戳孔注氣建立人工氣腹,氣腹壓力控制為12 mmHg(1 mmHg=0.133 kPa)。從此切口插入10 mm Trocar,置入腹腔鏡,觀察腹腔有無損傷,有無大網膜與腹壁黏連,肝膽脾腸盆腔有無異常。之后分別于兩側肋緣下鎖骨中線、左肋緣下腋前線處插入10 mm、5 mm及5 mm Trocar,放入超聲刀、分離鉗,另于劍突下正中偏左開一3 mm小切口插入3 mm倒“7”字形鈍頭鋼絲,腹腔內放入小號乳膠引流管,套入于鋼絲并吊牽肝左葉以充分暴露胃小彎和食管賁門周圍,用超聲刀切開近端胃小彎的肝胃韌帶,出血血管予以鈦夾夾閉,游離食管右側,顯露右側膈肌腳并此處標志性留置一塊干紗布,然后超聲刀切開胃脾韌帶;游離胃底和食管賁門左側,使食管下端賁門周圍完全游離,并兩側膈肌腳充分顯露。手術過程中,不可盲目分離,應注意辨認迷走神經、心包及大血管。最后根據患者食管裂孔大小,選擇相應修補方案:食管裂孔<5 cm的患者,采用不可吸收線縫合修補后,間斷縫合膈肌腳缺損部位2~3針;食管裂孔缺損直徑>5 cm的患者,應用HH專用補片覆蓋修補后,還需用疝補片釘合器釘合于雙側膈肌腳及膈肌上以進一步固定,后行Nissen胃底折疊術以抗反流。抗反流大致步驟如下:將胃底從賁門后方牽拉包裹食管賁門一圈,并分別縫食管右側胃底和胃短血管處胃底,固定于食管前壁,使寬3 cm胃底包裹食管,縫合2針,超聲刀電凝止血刨面,生理鹽水沖洗腹腔,放置負壓引流管一根并引出體外固定。確認無明顯創面滲血及出血,洗凈吸液及氣體,退出腹腔鏡。
2.術后隨訪:術后3個月、6個月、12個月采用住院、門診、電話及信件等方式進行隨訪。常規測身高、體重、腰圍、并且行上消化道鋇餐造影、胃鏡及食管測酸測壓等檢查。
三、統計學分析
運用SPSS 23.0軟件對樣本數據進行處理分析。符合正態分布的計量資料以均數±標準差描述,兩樣本均數比較用t檢驗,多組間比較采用方差分析(One way of ANOVA)檢驗比較組間差異;非正態分布計量資料以中位數描述,計數資料以率描述,以P<0.05為差異有統計學意義。
結 果
一、本組患者一般情況
本研究所納入的73例患者中,男性43例(59%),女性30例(41%);年齡為37~79歲,中位數為53歲;平均病史為7.2年,服用質子泵抑制劑(proton pump inhibitor,PPI)患者62例(92%),平均服用PPI時間為6.2年。所有患者手術均在腹腔鏡下成功完成,無中轉開腹。平均手術時間為71.5(62~95)min,術后平均住院時間為4.3(4~7)min。患者均術后2個月過渡到正常飲食。患者術后均未出現明顯的貧血、維生素及微量元素明顯缺乏。
二、本組體重指數及脂代謝指標測定
73例患者術后隨訪12個月,患者術前平均身高為162.03 cm,術前、術后3、6、12個月平均體重以及BMI進行比較,各組間有差異,且差異具有統計學意義(P均<0.05)。
表2 術前、后患者體重及BMI比較(±s)
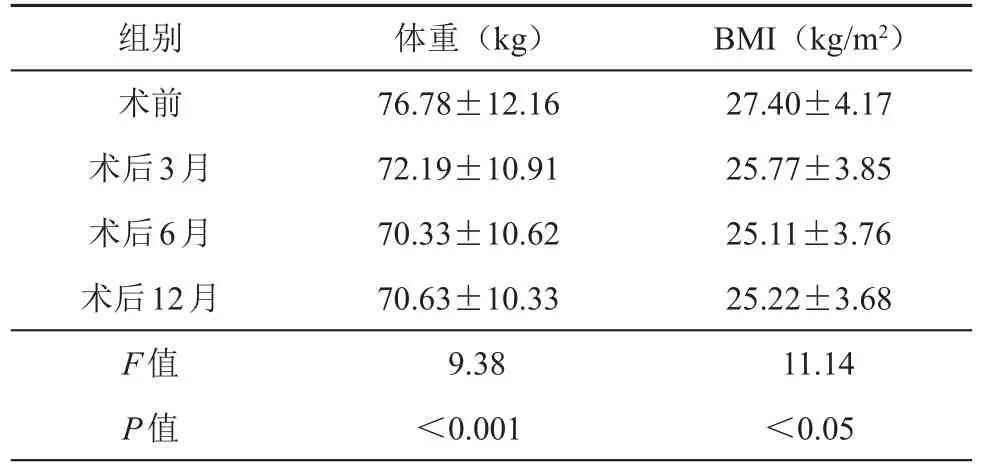
表2 術前、后患者體重及BMI比較(±s)
組別術前術后3月術后6月術后12月F值P值體重(kg)76.78±12.16 72.19±10.91 70.33±10.62 70.63±10.33 9.38<0.001 BMI(kg/m2)27.40±4.17 25.77±3.85 25.11±3.76 25.22±3.68 11.14<0.05
討 論
胃食管反流病作為最常見的上消化道疾病,其在全球范圍內發病率報道有較大差異。據近期流行病學報道,GERD發病率在東亞及東南歐地區最高(>25%),東南亞、加拿大及法國最低(<10%)[2]。眾所周知,HH是GERD的常見病因之一。HH患者一旦出現癥狀,其表現與胃食管反流病極其相似。當疝內容物較大壓迫心肺、縱隔,可以產生氣急、心悸、咳嗽、發紺等癥狀。壓迫食管時可感覺在胸骨后有食管停滯或吞咽困難。
在臨床上,患有HH的患者因隨著食管裂孔的不斷擴大,食管韌帶進行性松弛,從而食管下括約肌(lower esophageal sphincter,LES)失去正常的生理位置,影響其抗反流屏障功能。因此,HH患者往往合并有GERD。對于嚴格的內科治療效果不佳或者患者不能耐受長期藥物治療,以及患者合并食物反流引起的呼吸道疾病或嚴重HH時,臨床上被認為有抗反流手術指征。腹腔鏡下Nissen胃底折疊術(laparoscopic Nissen fundoplication,LNF)已成為HH合并GERD標準的外科治療。目前已有研究報道標準的Nissen胃底折疊術對術后體重有明顯的影響。大部分研究結果表明,Nissen胃底折疊術后患者體重明顯降低,并且對于體重下降的原因,研究者們持有不同的看法[3]。
Kamolz等[4]報道稱,約>50%的患者術后1周內開始出現吞咽困難,直到術后3個月患者吞咽障礙得以緩解,只有2%的患者仍存在嚴重的吞咽困難。因此認為,術后前3個月出現的體重下降可能與吞咽苦難有關。我們的研究結果表明,與術前BMI相比,術后前3個月內患者體重下降較明顯,基本與上述研究結果相符。Nissen胃底折疊術后減重的另一個重要原因與患者飲食習慣的改變有關。通常情況下,LNF術后患者被囑咐少食多餐,細嚼慢咽,充分咀嚼,清淡規律飲食,避免高脂肪、過甜飲食。因此,飲食習慣的改變被認為是術后是否減重的決定性因素[5]。有研究結果顯示,LNF術后減重患者達90.9%,體重平均降低3.9 kg,認為其原因歸根于術后綜合性飲食干預[6]。
雖然大部分研究表明LNF術后體重下降較明顯,但也有研究表明LNF術后會出現輕度體重增加[7]。其原因在于,酒精刺激酸分泌并且導致LES的松弛而加重反流癥狀,因此多數患者術前因喝酒或吃甜食加重心前區不適而遠離這些高熱量食物[8]。除此之外,胃排空的改變也可以解釋LNF術后減重的原因。由于LNF術后瞬間出現胃容積及順應性的減小,從而導致短暫性胃排空增強。但是有研究[9]報道稱,胃排空能力于術后30 d基本能夠恢復到術前的狀態,因此長期減肥并不能用這一機制來解釋。Nissen胃底折疊術具有消除LES迷走神經功能的作用,因此當LES壓力減弱與賁門容受性舒張時可能出現胃排空增強[10]。
綜上,本研究主要分析HH合并GERD患者行腹腔鏡食管裂孔疝修補術聯合Nissen胃底折疊術對體重的影響。然而我們的研究結果顯示,Nissen胃底折疊術具有較顯著的減重效果,術后至隨訪結束期間平均減重6.15 kg。該術式對體重的影響可能與術后飲食習慣的改變、早飽、性別等因素有關。由于本研究研究對象數量偏少,缺乏代表性,需開展多中心、大樣本研究來進一步證實觀點及其意義。

