實時熒光環介導等溫擴增技術檢測土壤中的類鼻疽伯克霍爾德菌
, , , , ,,, ,
類鼻疽伯克霍爾德菌(Burkholderiapseudomallei)又稱類鼻疽桿菌,隸屬于伯克霍爾德菌屬(Burkholderia),是借鞭毛而運動的革蘭陰性桿菌,無芽孢[1];分布廣泛,主要存在于水及土壤中,其耐受力極強,可在土壤中存活幾十年之久;類鼻疽伯克霍爾德菌污染的土壤和水被人和動物接觸后,可引起人和動物的類鼻疽,是一種典型的熱帶疾病致病菌,能感染機體幾乎任何器官,被美國CDC列為B類生物恐怖劑[2]。類鼻疽臨床表現多樣且缺乏特異性,易被誤診為肺炎、肺結核、肺膿腫或其他化膿菌所致的菌血癥,有似“百樣病”之稱[3];此外,類鼻疽伯克霍爾德菌表現出對多類抗生素的固有耐藥,包括β-內酰胺類、氨基糖苷類、大環內酯類和多粘菌素等,給臨床治療帶來很大的困難,導致患者死亡率高[4]。類鼻疽主要流行于澳大利亞北部、泰國等熱帶地區,我國自1990年首次報道皮膚類鼻疽病例以來,陸續有類鼻疽病例的報道,且死亡率高達50%以上;廣東、廣西、海南等地也是其重災區,就目前而言,類鼻疽已經成為了嚴重的公共衛生問題[5]。
目前,檢測類鼻疽伯克霍爾德菌的主要方法有細菌分離培養[6]、生化鑒定[7]、抗原檢測[8]、抗體檢測[9]、氣液相色譜分析[10]和分子檢測[11]等。雖然鑒定臨床標本中分離培養的的類鼻疽伯克霍爾德菌是診斷類鼻疽的標準方法,但是培養和鑒定耗費時間長,易錯過最佳治療時間;傳統的生化培養常常出現錯誤;抗體檢測在類鼻疽流行地區的應用存在背景抗體的干擾;近年來,分子診斷類鼻疽伯克霍爾德菌引起了研究學者的關注,但是傳統的PCR技術耗費時間較長、操作繁瑣。2000年,Notomi[12]等發明了一種新型的核酸等溫擴增技術-環介導等溫擴增技術(Loop-mediated isothermal amplification,LAMP),利用具有鏈置換活性的BstDNA聚合酶(BstDNA polymerase)提供反應的動力,在恒溫條件下幾十分鐘即可完成靶基因的高效擴增。該方法規避了常規PCR反應的變性、退火、延伸等一系列復雜的過程,大大節省了反應時間和成本,已被廣泛應用于對細菌、病毒、寄生蟲的快速檢測和動物胚胎性別鑒定等領域[13]。本文根據類鼻疽伯克霍爾德菌filc基因片段設計LAMP引物[14],同時利用反應產物與熒光染料結合發出熒光的特點,向反應體系中加入熒光染料EvaGreen,隨著反應產物的增加,與其結合的熒光染料也越來越多,熒光信號強度也隨之增強,通過實時熒光定量儀對熒光信號進行搜集,實現實時定性檢測,建立實時熒光環介導等溫擴增技術檢測類鼻疽伯克霍爾德菌的方法。
1 材料與方法
1.1 材料
1.1.1菌株 類鼻疽伯克霍爾德菌、土拉弗朗西斯氏菌、布魯氏菌、鼠疫菌和蜱蟲DNA、副溶血弧菌、腸出血性大腸桿菌O157∶H7型、單核細胞增生李斯特氏菌、沙門氏桿菌、金黃色葡萄球菌、肺炎克雷伯菌、脆弱擬桿菌、雙歧桿菌、乳酸桿菌DNA均由生物應急與臨床POCT北京市重點實驗室提供。
1.1.2主要試劑與儀器 PCR擴增試劑盒(上海生工生物工程股份有限公司);BstDNA聚合酶大片段(New England Biolabs);EvaGreen染料(上海開放生物科技有限公司);細菌核酸提取試劑盒(北京開景基因技術有限公司);甜菜堿(Sigma-Aldrich);Line-Gene 9600 Plus 實時熒光PCR儀(杭州博日科技有限公司);XMTD-6000電熱恒溫水浴鍋(北京市長風儀器儀表公司);DYY-8C型電泳儀(北京市六一儀器廠);質粒提取試劑盒(天根生化科技有限公司,北京)。
1.2 方法
1.2.1引物的設計與合成 根據類鼻疽伯克霍爾德菌filc基因序列(GenBank accession no.: KJ814953.1),利用軟件PrimerExplorer V5 (日本榮研化學株式會社)在線設計特異的LAMP引物對(包括外引物F3/B3,內引物FIP/BIP,環引物LF/LB),序列如表1所示。

表1 引物序列Tab.1 Information of the primers
1.2.2細菌DNA模板的制備 采用熱裂解法制備細菌DNA模板。取培養過夜的類鼻疽伯克霍爾德菌菌液1 mL,8 000×g離心1 min棄上清液。加入100 μL無菌水充分懸浮菌體,沸水浴中煮沸10 min,10 000×g離心2 min,上清液即可作為擴增模板,保存溫度為-20 ℃。
1.2.3RealAmp反應體系 10×Thermopol buffer(1 μL),EvaGreen(0.2 μL), 2 mmol/L MgSO4(0.2 μL),10 mmol/L dNTPs Mix(0.4 μL),5 mmol/L Betaine(2 μL),10 pmol/μL外引物(F3 / B3)各0.1 μL,10 pmol/μL內引物(FIP / BIP)各0.6 μL,10 pmol/μL環引物(LF / LB)0.4 μL,128 U/mL Bst DNA Polymerase(0.4 μL),模板(2 μL),H2O補足至10 μL。擴增反應條件:63 ℃,60 min。
1.2.4產物電泳驗證 取以類鼻疽伯克霍爾德菌核酸為模板的RealAmp擴增產物5 μL,與1 μL的10×loading buffer混合均勻,于2%瓊脂糖凝膠進行電泳分析,觀察階梯狀條帶,證實是否發生了反應。
1.2.5RealAmp的特異性驗證 依據基于類鼻疽伯克霍爾德菌filc基因建立的RealAmp技術,配制反應體系,將類鼻疽伯克霍爾德菌、土拉弗朗西斯氏菌、布魯氏菌、鼠疫菌、副溶血弧菌、腸出血性大腸桿菌O157∶H7型、單核細胞增生李斯特氏菌、沙門氏桿菌、金黃色葡萄球菌、肺炎克雷伯菌、脆弱擬桿菌、雙歧桿菌、乳酸桿菌以熱裂解法提取細菌DNA為模板,于63 ℃進行RealAmp反應,驗證該檢測方法的特異性。
1.2.6 RealAmp的靈敏度實驗
1.2.6.1細菌核酸檢測靈敏度 采用熱裂解法,提取過夜培養的類鼻疽伯克霍爾德菌菌液的DNA,用無菌水進行10倍倍比稀釋至1×101CFU/mL~1×108CFU/mL,分別取2 μL作為反應模板,進行RealAmp擴增,檢測方法的靈敏度。
1.2.6.2克隆質粒檢測靈敏度 采用熱裂解法,提取類鼻疽伯克霍爾德菌克隆株質粒,用無菌水進行10倍倍比稀釋至1×101copies/μL~1×109copies/μL,分別取2 μL作為反應模板,進行RealAmp擴增。
1.2.7 普通LAMP的靈敏度實驗
1.2.7.1普通LAMP反應體系 10×Thermopol buffer(1 μL),2 mmol/L MgSO4(0.2 μL),10 mmol/L dNTPs Mix(0.4 μL),5 mmol/L Betaine(2 μL),10 pmol/μL外引物(F3 / B3)各0.1 μL,10 pmol/μL內引物(FIP / BIP)各0.6 μL,10 pmol/μL環引物(LF/ LB)0.4 μL,128 U/mL Bst DNA Polymerase(0.4 μL),模板(2 μL),H2O補足至10 μL。擴增反應條件:63 ℃,60 min。
1.2.7.2細菌核酸檢測靈敏度 采用熱裂解法,提取過夜培養的類鼻疽伯克霍爾德菌菌液的DNA,用無菌水進行10倍倍比稀釋至1×100CFU/mL~1×107CFU/mL,分別取2 μL作為反應模板,進行LAMP擴增,檢測方法的靈敏度。
1.2.7.3克隆質粒檢測靈敏度 采用熱裂解法,提取類鼻疽伯克霍爾德菌克隆株質粒,用無菌水進行10倍倍比稀釋至1×101copies/μL~1×109copies/μL,分別取2 μL作為反應模板,進行LAMP擴增。
1.2.8 人工污染土壤
1.2.8.1人工污染土壤模擬樣本的制備 篩除大顆粒雜質的土壤,用蒸餾水制成懸濁液(0.25 g土壤加0.5 mL蒸餾水),取濃度為1×102CFU/mL~1×109CFU/mL類鼻疽伯克霍爾德菌克隆株菌懸液1 mL加入到9 mL的土壤懸液中,振蕩混勻,4 ℃放置過夜,使細菌與土壤充分吸附,即為污染土壤。每個濃度污染3份標本,共制備污染土壤24份,同時制備只加滅菌蒸餾水的陰性對照。
1.2.8.2RealAmp檢測人工污染土壤的靈敏度實驗 以類鼻疽伯克霍爾德菌終濃度為4.4×10-1CFU/g~4.4×1010CFU/g CFU/g的土壤模擬樣本,分別取2 μL作為反應模板,進行RealAmp擴增。
1.2.9人工污染土壤RealAmp與實時熒光定量PCR的對比檢測 以類鼻疽伯克霍爾德菌終濃度為4.4×101CFU/g~4.4×108CFU/g的土壤模擬樣本,通過RealAmp技術和熒光定量PCR對比檢測,比較分析這兩種方法的檢出率和實際應用價值。
2 結 果
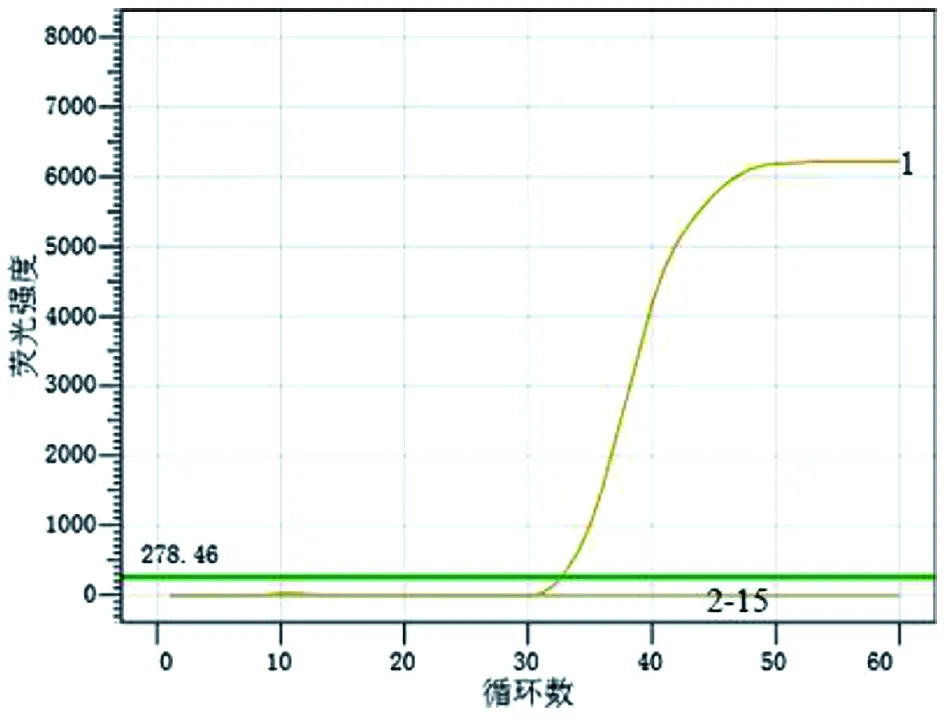
2.1RealAmp檢測類鼻疽伯克霍爾德菌方法的建立 如圖1所示,當反應進行至25個循環(1 min/循環)時,陽性對照管的熒光強度大幅度增加,熒光曲線斜率增加,當反應進行至40個循環,熒光信號增加強度逐漸變緩,直至反應結束,儀器判定為陽性結果,說明發生了擴增反應。陰性對照管熒光曲線一直處于平滑的狀態,直到反應終止也沒有曲線斜率的變化,儀器判定為陰性結果,說明沒有發生擴增反應。

1:陽性對照 2:陰性對照
2.2產物的電泳結果分析 如圖2所示,1泳道有階梯狀條帶產生,說明陽性對照管發生了擴增反應,2泳道沒有條帶,說明沒有發生擴增反應,檢測結果與圖1所示檢測結果一致。

M:100 bp marker;1:陽性對照;2:陰性對照
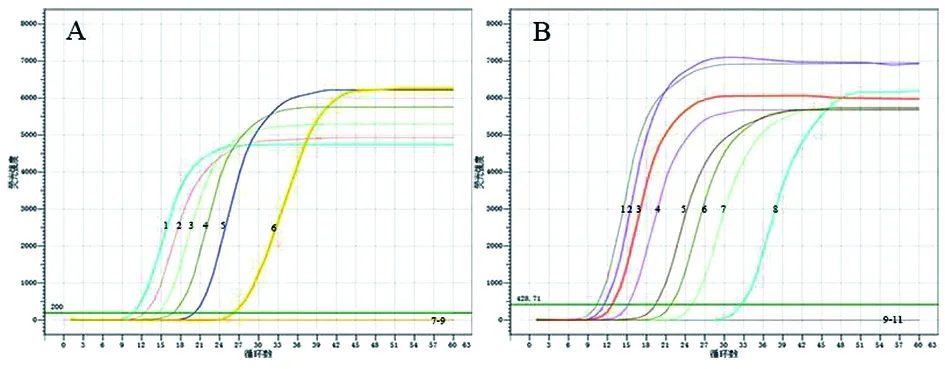
2.3RealAmp檢測類鼻疽伯克霍爾德菌方法的特異性 如圖3所示,類鼻疽伯克霍爾德菌有明顯的擴增出現,其他12株細菌和脾的DNA均未產生擴增峰,表明基于類鼻疽伯克霍爾德菌filc基因建立的RealAmp技術特異性強。
1:類鼻疽伯克霍爾德菌;2:土拉弗朗西斯氏菌;3:布魯氏菌;4:鼠疫菌;5:副溶血弧菌;6:腸出血性大腸桿菌O157:H7型;7:單核細胞增生李斯特氏菌;8:沙門氏桿菌;9:金黃色葡萄球菌;10:乳酸桿菌;11:肺炎克雷伯菌;12:脆弱擬桿菌;13:雙歧桿菌;14:蜱蟲DNA;15:陰性對照
2.4RealAmp與普通LAMP檢測類鼻疽伯克霍爾德菌方法靈敏度的比較
2.4.1普通LAMP檢測類鼻疽伯克霍爾德菌方法的靈敏度 類鼻疽伯克霍爾德菌核酸的終濃度為1×107CFU/mL,10倍倍比稀釋后,進行普通LAMP擴增,如圖4(A)所示,1~5泳道出現明顯的階梯狀條帶,為陽性結果,即普通LAMP檢測類鼻疽伯克霍爾德菌的靈敏度為1×103CFU/mL;類鼻疽伯克霍爾德菌質粒終濃度為1×108copies/μL,10倍倍比稀釋后,進行普通LAMP擴增,如圖5(B)所示,1~7泳道管出現明顯的階梯狀條帶,為陽性結果,即普通LAMP檢測類鼻疽伯克霍爾德菌質粒的靈敏度為1×102copies/μL。
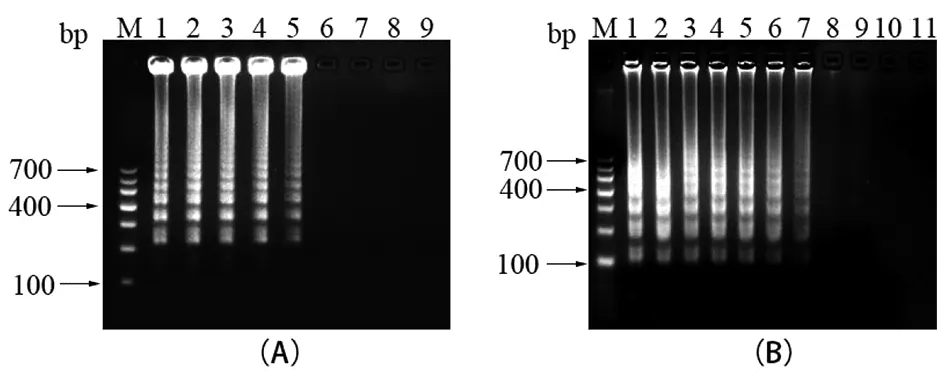
M:100 bp marker;A:普通LAMP檢測類鼻疽伯克霍爾德菌核酸的靈敏度 1~8:類鼻疽伯克霍爾德菌核酸的終濃度依次為 1×107、1×106、1×105、1×104、1×103、1×102、1×101、 1×100 CFU/mL;9:陰性對照;B:普通LAMP檢測類鼻疽伯克霍爾德菌質粒的靈敏度 1~10:類鼻疽伯克霍爾德菌質粒的終濃度依次為 1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100、1×10-1 copies/μL;11:陰性對照
2.4.2RealAmp檢測類鼻疽伯克霍爾德菌方法的靈敏度 以2.4.1中的類鼻疽伯克霍爾德菌核酸,進行RealAmp擴增,如圖5(A)所示,1~6號管出現明顯的擴增峰,為陽性結果,即RealAmp檢測類鼻疽伯克霍爾德菌的靈敏度為1×102CFU/mL;同樣以2.4.1中的類鼻疽伯克霍爾德菌克隆質粒,進行RealAmp擴增,如圖5(B)所示,1~8號管出現明顯的擴增峰,為陽性結果,即RealAmp檢測類鼻疽伯克霍爾德菌的靈敏度為1×101copies/μL。綜上所述,RealAmp靈敏度是普通LAMP的10倍。
A:RealAmp檢測類鼻疽伯克霍爾德菌核酸的靈敏度 1~8:類鼻疽伯克霍爾德菌核酸的終濃度依次為 1×107、1×106、1×105、1×104、1×103、1×102、1×101、 1×100 CFU/mL;9:陰性對照;B:RealAmp檢測類鼻疽伯克霍爾德菌質粒的靈敏度 1~10:類鼻疽伯克霍爾德菌質粒的終濃度依次為 1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100、1×10-1 copies/μL;11:陰性對照
2.5RealAmp檢測人工污染土壤的檢出限 人工污染的土壤中類鼻疽伯克霍爾德菌核酸的終濃度為4.4×10-1CFU/g~4.4×1010CFU/g,分別以每個稀釋度的核酸為模板,進行RealAmp擴增,結果見圖6,1~10號管均出現了明顯的擴增峰,為陽性結果,即RealAmp檢測人工污染土壤中的類鼻疽伯克霍爾德菌的檢出限為4.4×101CFU/g。

1~12:人工污染模擬土壤樣本中類鼻疽伯克霍爾德菌核酸的終濃度依次為 4.4×1010、4.4×109、4.4×108、4.4×107、4.4×106、4.4×105、4.4×104、4.4×103、4.4×102、4.4×101、4.4×100、4.4×10-1 CFU/g;13:陰性對照
2.6RealAmp與實時熒光定量PCR的對比檢測人工土壤中的類鼻疽伯克霍爾德菌 如圖7(A)所示,實時熒光定量PCR檢測24份靈敏度范圍內的人工污染土壤模擬樣本,出現了明顯的擴增信號,為陽性結果,檢出率為100%,但檢出時間較長;如圖7(B)
所示,以RealAmp技術檢測相同的樣本,也均出現了擴增信號,為陽性結果,檢出率為100%,且在30 min左右即可查看檢測結果。結果表明,RealAmp檢測土壤模擬樣本的檢測結果與預期完全一致,與行業認可的標準方法實時熒光定量PCR的檢測結果說明相吻合,且檢測時間僅為熒光定量PCR檢測時間的1/5,既節省了大量時間,又達到了熒光定量PCR的檢測效果。
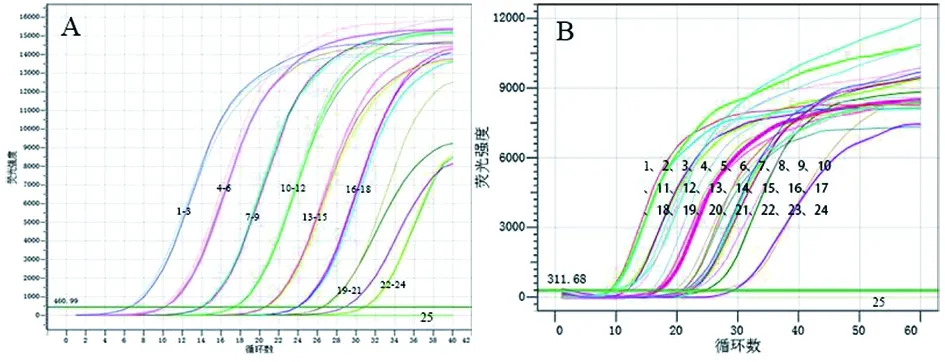
A:qPCR檢測人工污染土壤模擬樣本:人工污染模擬土壤樣本中類鼻疽伯克霍爾德菌核酸的終濃度依次1~3:為4.4×108 CFU/g;4~6:4.4×107 CFU/g;7~9:4.4×106 CFU/g;10~12:4.4×105 CFU/g;13~15:4.4×104 CFU/g;16~18:4.4×103 CFU/g;19~21:4.4×102 CFU/g;22~24:4.4×101 CFU/g;25:陰性對照;B:Real Amp檢測人工污染土壤模擬樣本:人工污染模擬土壤樣本中類鼻疽伯克霍爾德菌核酸的終濃度依次1~3:為4.4×108 CFU/g;4~6:4.4×107 CFU/g;7~9:4.4×106 CFU/g;10~12:4.4×105 CFU/g;13~15:4.4×104 CFU/g;16~18:4.4×103 CFU/g;19~21:4.4×102 CFU/g;22~24:4.4×101 CFU/g;25:陰性對照
3 討 論
類鼻疽伯克霍爾德菌與土拉桿菌、炭疽芽孢桿菌皆具有強致病性,可引起高死亡率的類鼻疽。類鼻疽初期的癥狀與肺炎類似,合并菌血癥、多器官損傷和和敗血癥的患者病死率可高90%,且發病范圍廣、傳播途徑多、臨床治療困難,從而導致類鼻疽已經成為亟待解決的公共衛生安全問題,類鼻疽伯克霍爾德菌也被視為經典的生物恐怖劑。
鞭毛蛋白(flagellin,FilC)作為類鼻疽伯克霍爾德菌表面主要抗原,其氨基酸序列高度保守,是引起免疫反應的重要抗原成分之一,由filc基因編碼。本次研究針對類鼻疽伯克霍爾德菌filc基因設計一套環介導等溫擴增引物,于反應體系中加入熒光染料EvaGreen,利用實時熒光監測儀進行核酸擴增,成功建立了快速檢測類鼻疽伯克霍爾德菌的RealAmp技術。在研究過程中,采用建立后的RealAmp技術檢測類鼻疽伯克霍爾德菌、布魯氏菌等13忠細菌和蜱蟲DNA,僅類鼻疽伯克霍爾德菌呈陽性結果,特異性強。靈敏度測試采用了類鼻疽伯克霍爾德菌核酸和克隆株質粒進行測試,從類鼻疽伯克霍爾德菌活菌中提取的類鼻疽伯克霍爾德菌核酸保證了實驗的可靠性;為了避免活菌裂解不完全,影響靈敏度檢測結果,采用構建質粒的方式進一步精確計算靈敏度。RealAmp檢測類鼻疽伯克霍爾德菌的核酸和克隆株質粒靈敏度分為100 CFU/mL、10 copies/μL,達到文獻報道[15]的實時熒光定量PCR檢測類鼻疽伯克霍爾德菌的靈敏度10 copies/μL,且為普通LAMP技術檢測類鼻疽伯克霍爾德菌靈敏度的10倍。土壤資源是生態基礎中非常重要的部分,在進行類鼻疽伯克霍爾德菌自然疫源地進行調查時,該菌在水源和土壤中的數量與人的類鼻疽的發病率有一定的相關性[16];同時,土壤也是各種生物生存發展的基礎,土壤環境中存在成千上萬種微生物,環境復雜,進行類鼻疽伯克霍爾德菌的檢測時,易受土壤環境中其他微生物和其他物質的干擾。優化后的RealAmp技術可直接對土壤中的類鼻疽伯克霍爾德菌進行檢測,且檢出限達44 CFU/g,與對照方法實時熒光定量PCR同時檢測24份涵蓋超低濃度和高濃度的樣本,檢出率均為100%,驗證了RealAmp技術檢測類鼻疽伯克霍爾德菌的實用價值。此外,該方法可直接讀取反應結果,并在結果讀取后可直接終止反應,節約了時間,同時避免了普通LAMP技術觀察沉淀的不確定性和用電泳檢測的繁瑣;上機檢測過程中,每管封閉式檢測避免了反應過程中由于溫度升高而易導致氣溶膠污染的現象。
但由于RealAmp技術建立的時間不長,依然存在有不足之處:檢測結果只有陽性與陰性兩種,只能定性,不能準確定量;設計類鼻疽伯克霍爾德菌的環介導等溫擴增引物時,采用了6條引物,雖在恒溫條件下進行擴增,但引物之間仍可能形成互補而擴增出非特異性的條帶,造成假陽性;RealAmp擴增效率極高,過于靈敏和產物量大,實驗室一旦遭到擴增產物氣溶膠污染,易出現假陽性,因此在操作的過程中應劃分區域,陰性樣本和陽性樣本應在不同的密閉實驗室進行添加,實驗器材不能混用,試劑分裝后再進行使用;RealAmp實驗需要在反應體系中加入熒光染料EvaGreen,其濃度對反應影響很大,濃度過高會抑制反應的進行,濃度過低則會導致熒光信號不明顯,不易被儀器搜集,因此熒光染料EvaGreen的添加濃度需要經過實驗摸索后確定。
綜上所述,此次研究針對類鼻疽伯克霍爾德菌filc基因建立的RealAmp技術具有特異性強、靈敏度高、簡便高效等特點,為類鼻疽伯克霍爾德菌的快速檢測提供了新的發展方向,有望成為常規的快速檢測手段,具有良好的應用價值和發展前景。

