化療止吐藥物聯合應用的研究進展
李曉男,潘 潔,張大昕
(哈爾濱醫科大學附屬第一醫院腫瘤科,哈爾濱 150001)
化療所致惡心嘔吐(chemotherapy-induced nausea and vomiting,CINV)屬于腫瘤患者化療過程中常見的不良反應,具有較高的發生率,可導致化療患者出現脫水狀況,嚴重者電解質發生異常紊亂[1-2]。因該不良反應具有嚴重危害,因此導致患者生理不能耐受及心理畏懼而放棄化療,難以確保化療的順利進行,亦不利于病情控制[3]。對此,有效預防CINV的發生至關重要。若未給予使用高度催吐風險化療藥物(high emetic risk chemotherapy,HEC)的患者積極防治,則其中90%的患者將出現惡心嘔吐癥狀,故CINV是化療過程中需要進行防治的重點工作[4-5]。對于HEC,多國指南均建議采用5-羥色胺3(5-hydroxytryptamine 3,5-HT3)受體拮抗劑、地塞米松及神經激肽1(neurokinin 1,NK-1)受體拮抗劑三藥聯合方案防治CINV[5-9]。美國國家綜合癌癥網絡首次將老藥新用的(非典型抗精神病藥)奧氮平與帕洛諾司瓊(5-HT3受體拮抗劑)、地塞米松三藥聯合方案列入美國國立綜合癌癥網絡(National Committee on Computer Network,NCCN)止吐指南[9]。雖然該聯合方法可改善延遲期惡心嘔吐,但是仍未達到防治CINV滿意的效果。2017 NCCN止吐指南[9]將奧氮平、阿瑞匹坦、5-HT3受體拮抗劑及地塞米松4種藥物聯合應用作為止吐推薦方案,是防治CINV的新突破。現就化療藥物催吐風險分類、CINV發生機制、HEC應用過程中止吐藥物聯合方案的進展予以綜述。
1 化療藥物催吐風險分類
防治CINV過程中止吐藥物選擇及聯合應用方案基于化療藥物的催吐風險[10]。催吐風險是指不給予防治,化療藥物應用過程中出現嘔吐的風險。另外,患者發生嘔吐的概率與藥物催吐風險大小及患者給藥途徑、劑量等因素有關[8-9]。根據化療藥物引起嘔吐的發生率,將其分為4個催吐等級[5]:若嘔吐發生率>90%,則評價為高度催吐風險;若嘔吐發生率在30%~90%,則評價為中度催吐風險;若嘔吐發生率在10%~30%,則評價為低度催吐風險;若嘔吐發生率低于10%,則評價為輕微催吐風險。其中HEC引起的惡心嘔吐是防治的重點,靜脈型HEC 包括順鉑、阿霉素>60 mg/m2AC方案 (阿霉素/表阿霉素+環磷酰胺)、表阿霉素>90 mg/m2、 環磷酰胺>1 500 mg/m2、 異環磷酰胺≥2 g/m2、卡莫司汀>250 mg/m2、氮芥,在應用時需要多種止吐藥物聯合進行防治CINV的發生。
2 CINV的機制
CINV的發生機制是化療止吐藥物開發和聯合應用方案選擇的基礎,但其機制尚未明確,目前大部分學者的研究均是探究化療引起嘔吐現象的機制。
2.1CINV的中樞機制 研究報道,CINV主要通過兩種不同的機制發揮作用,分別為中樞和外周機制,其中包含復雜的反射過程。一種是中樞機制。嘔吐反射由位于延髓的腦干嘔吐中樞進行調節,腦干嘔吐中樞包括極后區、孤束核及迷走神經運動背核[10]。位于極后區的化學受體觸發區接受刺激,并將沖動傳遞至腦干嘔吐中樞的鄰近結構,引起嘔吐[10]。另一種是外周機制。當化療藥物進入到人體后,作用于胃腸道細胞,導致胃腸道細胞損傷,從而釋放神經遞質,而其作用于迷走神經和內臟神經的傳入纖維,最終直接或間接作用于嘔吐中樞,極后區的學受體觸發區,從而完成嘔吐反射。
2.2CINV相關的神經遞質及受體 在CINV的發生過程中,神經遞質與受體的相互作用是完成嘔吐反射的基礎。參與的神經和受體主要包括5-HT3、P物質和NK-1受體、多巴胺、組織胺、毒蕈堿受體等[11-12]。研究報道,在CINV不同階段,發揮關鍵性作用的神經遞質及受體亦不同。依據患者不良反應發生的時間,CINV可分為兩個階段,即急性期和延遲期。急性期指化療后0~24 h發生的惡心嘔吐;延遲期指惡心嘔吐發生在化療后24 h,持續至數天者[6-7,10]。5-HT被證實在急性期發揮重要作用,其與5-HT3受體結合在化療藥物引起的急性期嘔吐中具有主導作用[11]。P物質是速激肽家族中的一員,由于該物質在極后區大量存在,而被發現與嘔吐反射相關。NK-1受體是P物質結合的受體,研究證實采用非肽類拮抗劑拮抗NK-1受體,可以抑制嘔吐,在嘔吐的急性期和延遲期均發揮重要作用。此外,炎性介質與急性期及延遲期的CINV有關[11-12]。
3 止吐藥物
雖然對CINV發生機制的認識尚未完全明確,但相應止吐藥物的作用機制已明確。部分止吐藥物通過阻滯相應的神經遞質與受體結合而發揮作用,目前常用止吐藥物如下。
3.1地塞米松 地塞米松是止吐的常規用藥。對于其作用機制,國內外研究尚未統一觀點。該藥物的功效與其強大的抗炎作用有關,單獨應用無效,需要與其他藥物聯合應用。該藥屬于皮質類固醇激素,主要通過抑制患者前列腺合成及抗原體反應引起的組織損害,對患者5-HT進行抑制,同時促進啡肽的產生,從而達到改善患者病情的效果。地塞米松半衰期為36~54 h,通常需要聯合其他藥物使用,以提高療效。常見的聯合藥物有昂丹司瓊、鹽酸托烷司瓊、奧氮平及地西泮等[5-8]。
3.25-HT3受體拮抗劑 5-HT3受體拮抗劑通過阻滯5-HT3受體而發揮作用,現已成為預防和治療HEC的基礎藥物[13]。自首個5-HT3受體拮抗劑昂丹司瓊用于臨床后,相繼研發出藥效相近的格拉、多拉、托烷和雷莫司瓊,研究證實一代藥物間藥效相近,且安全性較好[14]。帕洛諾司瓊是唯一的二代5-HT3受體拮抗劑,經過美國食品藥品管理局認證用于CINV的治療中,與受體有更好的結合力及更長的半衰期(40 h比3~9 h)[14],與一代藥物比較,帕洛諾司瓊具有更有效、更安全等特點[15-17]。體外細胞的研究發現,帕洛諾司瓊與5-HT3受體特殊的結合方式可進一步阻止P物質與NK-1受體結合,與NK-1受體拮抗劑聯合應用,具有增效的作用[18]。
3.3NK-1受體拮抗劑 NK-1受體拮抗劑作用機制為:通過P物質進行阻滯,進而發揮止吐效果,對多巴胺受體與5-HT3這兩者的親和力微乎其微。研究報道,NK-1受體拮抗劑、5-HT3受體拮抗劑與地塞米松聯合用藥,可增強抑制化療患者嘔吐的效果[19]。目前,NK-1受體拮抗劑包括福沙匹坦、羅拉吡坦、奈妥吡坦、阿瑞匹坦等。阿瑞匹坦為首個通過美國食品藥品管理局批準上市的NK-1受體拮抗劑,目前已證實該藥對各個階段的CINV均有效,且不良反應輕微,患者亦可耐受[19];福沙匹坦是阿瑞匹坦的前體,為靜脈劑型,通過在體內轉化為阿瑞匹坦而發揮作用,常用于術后和不方便服藥患者;羅拉吡坦為高親和力NK-1受體拮抗劑,與其受體結合可達90%或以上,作用時間相對較長,可達到5 d,半衰期約180 h,其作為預防延遲期惡心嘔吐的藥物,有別于奈妥吡坦和其他NK-1受體,不誘導或抑制細胞色素P450)[20-21];奈妥吡坦主要用于與帕洛諾司瓊結合為新型的止吐合劑NEPA。
3.4NEPA NEPA是由帕洛諾司瓊和奈妥吡坦組合而成的口服止吐藥物,該藥已于2014年由美國食品藥品管理局認證用于CINV[22]。在作用機制上,NEPA可同時阻斷急性和延遲性CINV兩種關鍵途徑。由于藥物半衰期較長,延遲期效果控制較好,在一定程度上可以簡化CINV的管理,目前該藥被應用于Ⅲ期臨床試驗中,用于預防由中度致吐性化療藥物和高度致吐性化療藥物HEC的CINV。相關研究表明,NEPA聯合地塞米松的與以往的三藥聯合方案的止吐效果相似[23-24]。
3.5奧氮平 奧氮平是精神科用藥,而腫瘤內科醫師對奧氮平治療CINV的獨特作用機制及止吐效果了解甚少[25]。研究發現,奧氮平可同時對5-HT3、多巴胺、組胺等多種受體有親和作用,是一種多受體阻滯劑,并且該藥能有效緩解兩個階段的CINV[26]奧氮平對患者受體系統可產生較大的影響,如患者體內的兒茶酚胺、乙酰膽堿、組胺、血清素、多巴胺等,可有效控制患者嘔吐癥狀,尤其對于遲發性惡心嘔吐。嘔吐癥狀改善后,應當指導患者適當增加飲水量及進食量,同時改善患者液體輸入量,進而改善其生活質量。此外,該藥可改善患者的睡眠質量,但也會引起一些不良反應,如體重增加、嗜睡等。
4 化療止吐藥物的聯合應用
4.1指南中止吐藥物的聯合方案 循證醫學制訂的相關指南是指導臨床醫師選擇嘔防方案的關鍵。基于當前對CINV及止吐藥物作用機制的認識,現階段,最新止吐指南有NCCN 2017、癌癥支持療法多國學會(MASCC) 2016、歐洲腫瘤內科學會(ESMO) 2016、腫瘤治療相關嘔吐防治指南2014版、美國臨床腫瘤學會(ASCO) 2015。多國指南已達共識,預防CINV的發生是根本目標,建議不同作用機制和無重疊毒性的藥物聯合應用[5-7]。對于靜脈注射HEC引起的惡心嘔吐治療,臨床醫師將多巴胺受體拮抗劑與地塞米松作為首選方案。然而,隨著藥物的不斷研發應用,多國指南亦更新為NK-1受體拮抗劑、5-HT3受體拮抗劑和地塞米松三藥聯合方案,并且該方案處于止吐的主導位置[5-7]。奧氮平在CINV中的應用使延遲期惡心嘔吐的控制有了新的希望,奧氮平聯合帕洛諾司瓊、地塞米松三藥方案已列入更新較快的NCCN指南作為HEC的防治推薦方案。NCCN止吐指南對HEC引起惡心嘔吐的防治方案推薦如下,見表1。
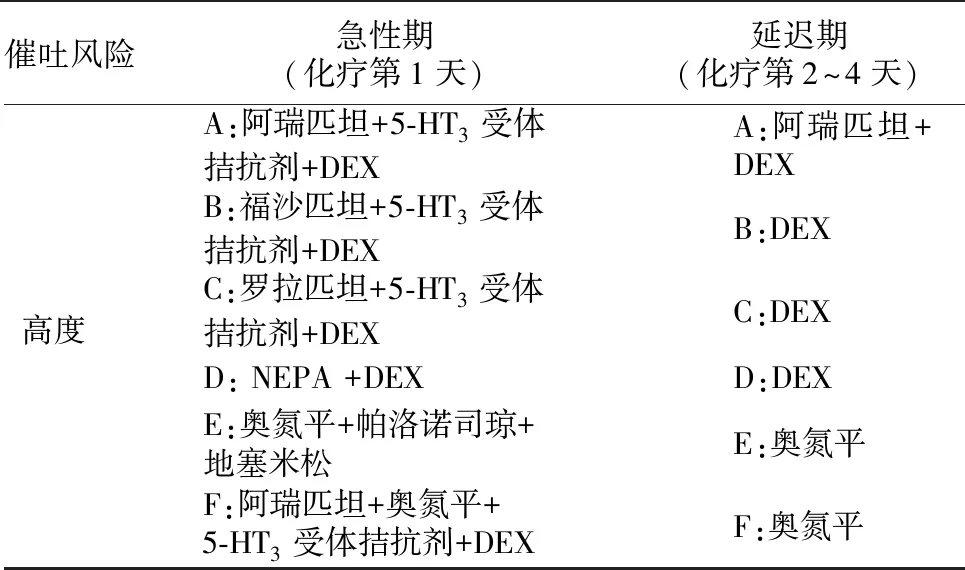
表1 HEC引起惡心嘔吐的防治方案
HEC:高度催吐風險化療藥物;A-F為不同的止吐方案,分為急性期及延遲期用藥;DEX:地塞米松;5-HT:5-羥色胺;NEPA:帕洛諾司瓊和奈妥吡坦的合劑
4.2止吐藥物聯合方案的相關研究 目前,醫師在臨床實踐中對CINV進行了大量相關研究,并且以患者于急性期、延遲期(化療后2~5 d)或全程(化療后1~5 d)的完全緩解率(無嘔吐,無解救治療)評估其止吐效果。
如上述指南中推薦的含有A、B、C方案概括為含NK-1受體拮抗劑、5-HT3受體拮抗劑聯合地塞米松三藥方案。同時,5-HT3受體拮抗劑為一類藥物,可隨意選擇。在相同機制下,選用二代司瓊類藥物可獲得較好的效果,其延遲期惡心嘔吐控制更好。一項Meta分析回顧了帕洛諾司瓊與一代司瓊藥物的作用效果,結果表明,帕洛諾司瓊在急性期和延遲期的完全緩解率及惡心控制率均高于一代司瓊的效果[15]。NEPA由奈妥匹坦、帕洛諾司瓊兩者組合構成,將其聯合地塞米松應用,可發揮標準三藥方案作用的相似效果,并且作用機制相似。Hesketh等[26]將694例首次接受化療的患者作為研究對象,全部患者給予順鉑化療,劑量均超過50 mg/m2,采用隨機雙盲方法展開分組研究,其中,NEPA聯合地塞米松方案與標準方案(阿瑞匹坦、單次靜脈注射昂丹司瓊、地塞米松方案)的全程期完全緩解率分別為89.6%和86.6%,延遲期完全緩解率分別為98.5%和94.8%,差異無統計學意義。
含奧氮平三藥方案的止吐效果在延遲期惡心的控制率較好。譚立君等[27]在一項預防高度和中度致吐化療方案引起惡心嘔吐的Ⅲ期臨床試驗中,納入229例患者,研究組采用奧氮平聯合阿扎司瓊及地塞米松方案,對照組采用阿扎司瓊和地塞米松方案進行止吐治療,結果表明,在急性期兩種方案的療效比較,差異無統計學意義,但在延遲期,研究組所用方案可顯著提高惡心、嘔吐的完全緩解率(惡心完全緩解率69.64%比30.43%,P<0.05;嘔吐完全緩解率78.57%比56.52%,P<0.05)。Navari等[28]對高致吐化療方案相關的CINV進行Ⅲ期隨機對照臨床試驗(n=251),一組給予奧氮平、地塞米松與5-HT3受體拮抗劑三藥聯合方案,另外一組給予阿瑞匹坦、地塞米松與5-HT3受體拮抗劑三藥聯合方案,觀察兩組防治惡心、嘔吐的療效。結果顯示,急性期兩種方案對惡心嘔吐的控制方面比較,差異無統計學意義;而在延遲期,含奧氮平三藥方案對惡心的控制效果優于含阿瑞匹坦的三藥方案(惡心的緩解率為69%比38%)。研究提示,奧氮平對CINV延遲期惡心的控制效果較好。
綜合以上兩種三藥方案,在傳統的三藥方案基礎上加入奧氮平組合而成的四藥方案對延遲期惡心的控制效果較好。Navari等[29]針對使用順鉑或者AC方案的患者,根據止吐方案不同,分別予兩組不同方案治療,試驗組是奧氮平、NK-1受體拮抗劑、5-HT3受體拮抗劑、地塞米松四藥止吐方案,對照組為NK-1受體拮抗劑、5-HT3受體拮抗劑、地塞米松三藥止吐方案,結果發現,試驗組與對照組在4 h內惡心的急性期緩解率分別為74%和45%(P=0.002);延遲期的緩解率為42%和25%(P=0.002);全程期緩解率為37%和22%(P=0.002);兩組均無嚴重不良反應發生。該研究表明,含奧氮平、NK-1、5-HT3受體拮抗劑和地塞米松的四藥方案,與傳統的三藥方案相比很大程度上減少了惡心嘔吐的發生。
5 小 結
對于化療止吐藥物聯合方案的探索及研究已有一定進展,二代5-HT3受體拮抗劑的應用取得顯著效果,但是5-HT3受體拮抗劑、NK-1受體拮抗劑和地塞米松三藥方案防治惡心嘔吐的效果仍然有限。在相同機制條件下,NEPA的開發和應用,雖然提高了服藥的便捷性,但是未能從根本上改善嘔吐癥狀。尤其對于延遲期惡心嘔吐的控制仍是防治難點[32]。隨著對奧氮平藥物的逐步認識,其對延遲期的止吐效果逐漸被認可,且含奧氮平的三藥方案在一定程度上可改善惡心嘔吐癥狀。與此同時,在標準三藥方案上聯合應用奧氮平的四藥方案是目前止吐的全新思路,該止吐方案可明顯改善患者延遲期惡心嘔吐癥狀,但是仍然需要更多臨床實踐證實其在不同人群中的作用效果。

