轉錄因子GRHL3抑制SNX16表達促進乳腺癌細胞遷移和侵襲
周利利,曾凡軍,涂珍珍,郭立鈺,郭思佳,鄧慶梅,周海勝,2
轉錄因子GRHL3作為Grainyhead家族成員之一,在胚胎發育過程中,參與調控上皮細胞的分化和遷移[1-2]。GRHL3基因敲除小鼠因神經管閉合缺陷和皮膚表皮屏障缺少而致死[3-4]。對于GRHL3調控腫瘤細胞發生遷移和侵襲的靶基因,目前報道較少。分揀連接蛋白16(Sorting Nexin 16,SNX16)屬于SNXs蛋白家族成員,分布于胞外基質連接的粘著斑。過去研究[5]顯示增加SNX16的表達能夠 抑制乳腺癌細胞的遷移和侵襲,其機制是與SNX16調控E-cadherin的回收再利用有關。
為證實SNX16是GRHL3調控的靶基因并研究其對乳腺癌細胞遷移和侵襲能力的影響,擬利用免疫組織化學方法分析GRHL3和SNX16在乳腺癌組織中表達關系;利用低侵襲能力的乳腺癌細胞株MCF7,過量表達GRHL3后分析SNX16的表達變化及MCF7細胞遷移和侵襲變化,初步探討GRHL3調控SNX16表達的機制。
1 材料與方法
1.1材料
1.1.1組織標本 人乳腺癌組織標本由中國科學院合肥腫瘤醫院及達安醫學檢驗中心病理科提供,其中乳腺侵襲性導管癌標本18例,乳腺侵襲性導管癌癌旁組織標本10例,正常乳腺組織標本2例。
1.1.2細胞系 人乳腺癌細胞系MCF7和人胚胎腎細胞系293T由海勝實驗室保存;穩定過量表達GRHL3的MCF7細胞系由海勝實驗室構建。
1.1.3載體 真核細胞表達載體pCMV-Tag-2B、用于檢測啟動子活性的熒光素酶報告基因載體pGL3-Basic、海腎螢光素酶報告基因載體pRL-TK載體購自美國Promega公司;克隆載體pMD-18T購自大連寶生物有限公司;過量表達GRHL3的表達載體pCMV-GRHL3、過量表達SNX16的表達載體pCMV-SNX16由海勝實驗室構建。
1.1.4引物 用于PCR擴增人的SNX16 基因啟動子DNA引物:P1:5′-AGAGAATGTCGATTTCCTGCCA-3′,P2:5′-TTAACCGCAGCTTTTCGCCT- 3′;用于對GRHL3第一個結合位點(Site 1)進行定點突變的PCR引物Prom1:5′-AGAGAATGTCGAcgacttCTGCCA-3′,用于對GRHL3第二個結合位點(Site 2)定點突變的PCR引物Prom2:5′-AGAGACTatctgattCGGGGAGCAGCTGCT-3′。Prom1和Prom2的序列中小寫字母為突變位點序列。
1.1.5主要試劑 RPMI-1640培養基、高糖DMEM培養基和青霉素/鏈霉素(P/S)來自美國Hyclon公司;胎牛血清(FBS)購自美國Corning公司;轉染細胞試劑Lipofectamine 3000購自美國Invitrogen公司;兔源抗SNX16抗體購自美國Novus Biologicals公司,鼠源抗GAPDH抗體和辣根過氧化酶(horseradish peroxidase,HRP)標記的二抗購自美國Santa Cruz公司;免疫組化二抗和免疫組化DAB顯色劑試劑盒購自北京中杉金橋生物技術有限公司;BD基質膠和Boyden小室購于美國BD Biosciences公司。
1.2方法
1.2.1細胞培養 MCF7細胞使用含10%胎牛血清和含1%的P/S的RPMI-1640培養基。細胞放置于37 ℃并含5% CO2的培養箱中培養。
1.2.2SNX16基因啟動子克隆和定點突變 通過PCR克隆野生型的SNX16基因啟動子-417 bp 到 +105 bp DNA片段,并插入pMD-18T載體測序。利用KpnI和XhoI雙酶切將SNX16啟動子亞克隆到pGL3-Basic載體上,構建pGL3-SNX16 Promoter-Luc重組載體;利用突變引物按如下條件進行PCR擴增:94 ℃、2 min,98 ℃、10 s,60 ℃、30 s,68 ℃、3 min;用DpnI消化模板質粒DNA。用T4多聚核苷酸激酶和DNA連接酶處理PCR產物,以進行自身環化。環化DNA轉化感受態細菌,提取單個細菌克隆的質粒DNA進行測序。
1.2.3熒光素酶實驗 將pGL3-Basic載體、重組載體pGL3-SNX16 Promoter-Luc以及3種突變載體與pRL-TK和pCMV-GRHL3 重組載體(或pCMV-Tag-2B空載體)按照Lipofectamine 3000試劑說明書操作,共同轉染239T細胞,24 h后收集樣品進行熒光素酶活性檢測。
1.2.4Western blot實驗 根據文獻[6]方法,收集細胞總蛋白,進行聚丙烯酰胺-SDS電泳,待目的蛋白充分分離至不同位置后轉移至PVDF膜上,室溫封閉45 min,4 ℃過夜孵育一抗(1 ∶1 000)。HRP標記的二抗 室溫孵育6~8 h,加入超敏底物溶液,暗室中顯影和定影,拍照。
1.2.5Transwell遷移實驗和侵襲實驗 細胞侵襲實驗將融化BD基質膠加入Transwell小室上層,晾干,靜置過夜;細胞計數調整為2.0×105/ml,取200 μl加至上室,下室加600 μl 5% FBS培養基;甲醇固定20 min,蘇木精染色10 min,洗滌,伊紅染色2 min,沖洗后擦去上層細胞,制片,計數。細胞遷移實驗過程與細胞侵襲實驗相同,但在小室上層不添加BD基質膠。
1.2.6免疫組化 組織切片(4 μm)常規脫蠟入水后,微波熱修復抗原,使用3% H2O2消除內源性過氧化物酶,山羊血清封閉,4 ℃孵育一抗(1 ∶100)過夜。第2天依次室溫孵育通用二抗工作液聚合物,DAB顯色,蘇木精復染,最后組織經脫水透明后烘干封片。

2 結果
2.1免疫組化檢測GRHL3、SNX16在乳腺癌組織表達免疫組化結果顯示,GRHL3主要在乳腺癌組織的細胞核表達,胞質亦可見GRHL3染色;SNX16分布于正常乳腺組織導管上皮細胞質,而乳腺癌組織SNX16表達水平較低或不表達(圖1)。18例癌組織標本中,14例(77.8%)顯示GRHL3(+)、SNX16(-),10例癌旁組織有8例顯示GRHL3(+)、SNX16(-);只有2例(11.1%)癌組織標本與正常乳腺組織均顯示為GRHL3(-)、SNX16(+)(表1)。
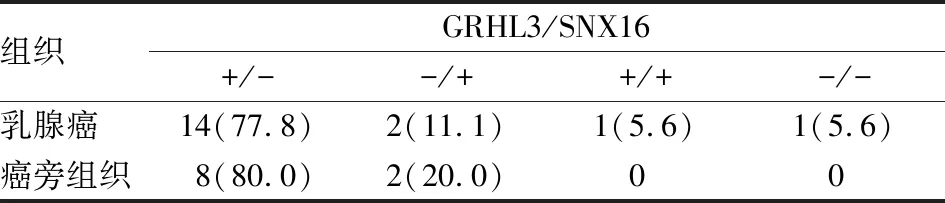
表1 GRHL3和SNX16在乳腺癌組織和
2.2MCF7細胞GRHL3和SNX16的表達變化為了在細胞水平證實GRHL3與SNX16的負調控作用,選擇低侵襲力的乳腺癌細胞株MCF7作為研究對象,建立穩定過量表達GRHL3的乳腺癌細胞株。將pCMV-GRHL3及其對應空載體pCMV-Tag-2B分別轉染MCF7細胞。通過G418篩選分別獲得過量表達GRHL3的MCF7/GRHL3細胞克隆和對照組細胞克隆MCF7/空載體。Western blot檢測結果顯示:MCF7/GRHL3細胞GRHL3的表達較對照MCF7/空載體細胞顯著增加,而SNX16的表達明顯降低(圖2A);與對照組MCF7/空載體細胞相比,MCF7/GRHL3細胞的GRHL3(P=0.022)和SNX16(P=0.002)的表達變化均具有統計學意義(圖2B)。可見,GRHL3和SNX16的表達變化與乳腺癌組織表達變化一致。
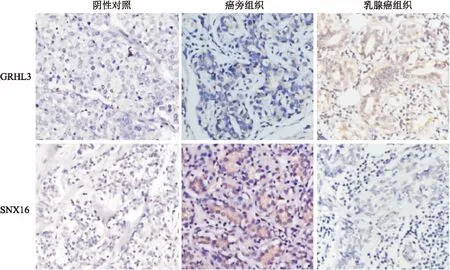
圖1 IHC檢測乳腺組織中GRHL3和SNX16表達 ×200
2.3GRHL3抑制SNX16基因啟動子活性分析已知GRHL3與靶基因啟動子區域DNA特異序列TTTCC(T)或GGCT(A)GAGG結合(圖3A),抑制靶基因表達。通過生物信息學分析SNX16基因啟動子DNA, 發現SNX16基因啟動子區有2個GRHL3潛在結合位點:一號位點(Site 1)-408~-403 bp存在TTTCC(T);二號位點(Site 2)+16 ~+23 bp存在GGCT(A)GAGG(圖3B)。利用MCF7細胞基因組DNA為模板,PCR擴增獲得SNX16基因啟動子DNA(513 bp),并亞克隆至pGL3-Basic,構建重組載體pGL3-SNX16 Promoter-Luc;利用PCR方法對一號位點和二號位點分別或同時進行定點突變。測序結果證實成功構建重組載體pGL3-SNX16 Promoter-Luc并實現定點突變(圖3C)。從而構建含有3種突變的SNX16啟動子熒光素酶報告基因的重組載體:一號位點突變的pGL3-SNX16 Promoter-Luc/m1、二號位點突變的pGL3-SNX16 Promoter-Luc/m2和兩位點突變pGL3-SNX16 Promoter-Luc/m1+2。
為了探討GRHL3對SNX16基因啟動子的調控作用,將pGL3-SNX16 Promoter-Luc重組載體及3個突變的載體,聯合pRL-TK分別與pCMV-GRHL3(或pCMV-Tag-2B)共轉染293T細胞。24 h后檢測各組相對熒光強度。結果顯示:GRHL3對野生型SNX16基因啟動子有明顯的抑制作用(F=78.43,P=0.001);一號位點(F=17.13,P=0.014)、二號位點(F=73.34,P=0.001)單突變的SNX16基因啟動子在GRHL3作用下,仍然具有明顯抑制作用;當一號位點與二號位點同時突變后,GRHL3沒有顯示SNX16基因啟動子的抑制作用,無統計學意義(F=3.09,P=0.153)(圖4)。

圖2 MCF7細胞過量表達GRHL3抑制SNX16表達

圖3 GRHL3結合DNA序列分析和SNX16基因啟動子GRHL3結合位點突變
2.4GRHL3對細胞遷移和侵襲能力的影響為了研究過量表達GRHL3抑制SNX16表達可能影響乳腺癌細胞遷移和侵襲能力,通過瞬時轉染pCMV-SNX16以回補SNX16的表達,進而進行Transwell細胞遷移和細胞侵襲實驗。建立轉染空表達載體的細胞系MCF7/空載體;轉染過量表達GRHL3的細胞系MCF7/GRHL3;共轉染過量表達GRHL3和SNX16的細胞MCF7/GRHL3+SNX16。Transwell遷移實驗結果顯示:轉染空載體MCF7細胞的遷移細胞數為(13.3±2.07),GRHL3過表達MCF7細胞的遷移細胞均數(93.17±9.56),MCF7/GRHL3細胞在瞬時轉染pCMV-SNX16以回補SNX16的表達,發生遷移的細胞數為(20.50±4.18)。經單因素方差分析三組間遷移能力,差異有統計學意義(P<0.001)。轉染空載體的MCF7對照細胞與回補SNX16表達的MCF7/GRHL3細胞相比,遷移細胞數無統計學意義(P=0.184)(圖5)。
Transwell侵襲實驗結果顯示:轉染空載體的MCF7細胞發生侵襲細胞數為(10.83±1.72),過表達GRHL3的MCF7細胞發生侵襲細胞數為(31.67±4.37),過量表達GRHL3的MCF7/GRHL3細胞轉染pCMV-SNX16后,發生侵襲的細胞數為(5.50±2.26)。經單因素方差分析三組間侵襲能力,差異有統計學意義(P<0.001)。其中過量表達GRHL3的MCF7細胞遷移能力最強,轉染空載體的MCF7細胞遷移細胞數明顯低于與過量表達GRHL3并回補SNX16的MCF7細胞侵襲細胞數,差異有統計學意義(P=0.023)(圖5)。根據Transwell的遷移實驗和侵襲實驗,說明GRHL3過量表達促進MCF7細胞遷移和侵襲,且與GRHL3抑制SNX16表達有關。

圖4 GRHL3調節SNX16基因啟動子活性分析

圖5 MCF7細胞遷移和侵襲
3 討論
Grainyhead 家族高度保守,所編碼的轉錄因子在胚胎發育過程中發揮關鍵的調控作用。GRHL3是其中的成員之一[1]。在小鼠發育過程中,GRHL3在傷口愈合、表皮形成及胚胎神經管閉合等過程中發揮重要作用[1-3]。GRHL3不僅在正常生長發育過程發揮重要作用,同時參與腫瘤發生發展過程。既往研究[7-8]表明,在早期乳腺癌中,尤其是非三陰乳腺癌中,GRHL3表達量升高,其機制是細胞對稱分裂和腫塊形成之間存在密切聯系。在果蠅和小鼠體內,GRHL3調控多種參與表皮屏障形成及終末分化的基因表達[9],近期研究[10]報道,敲除小鼠體內角質層形成細胞中GRHL3,可能誘發皮膚鱗癌的形成;基因表達譜分析顯示GRHL3的表達與E-cadherin表達有抑制作用[11];GRHL3通過直接或間接結合E-cadherin啟動子上,抑制E-cadherin的表達,促進上皮來源腫瘤細胞的遷移和侵襲[11]。
為了探尋GRHL3調控與細胞遷移和侵襲的相關基因的表達,前期的染色質免疫共沉淀測序的結果發現SNX16可能是GRHL3調控的潛在靶基因(結果未示)。乳腺癌組織的免疫組織化學分析發現,GRHL3高表達的腫瘤組織中SNX16的表達明顯降低;提示SNX16可能受到GRHL3的負調控。細胞水平研究進一步證實過量表達GRHL3時,SNX16的表達水平顯著降低。通過生物信息學分析發現,SNX16基因啟動子DNA序列存在GRHL3的潛在結合位點TTTCC(T)或GGCT(A)GAGG,與前期研究[5]發現的GRHL3結合E-cadherin基因啟動子區域的特定序列5′-CACCTG-3′或5′-CAGGTG-3′均具有高度相似性。通過克隆SNX16基因啟動子進行雙熒光素酶實驗,結果證實GRHL3對SNX16基因啟動子的活性同樣具有抑制作用,與GRHL3結合E-cadherin基因啟動子抑制靶基因表達具有一致性。當對SNX16基因啟動子區的GRHL3潛在結合位點進行突變,發現GRHL3無顯著的抑制作用。因此GRHL3可能直接或間接通過結合于SNX16基因啟動子,抑制SNX16表達。
以往研究[11]證實GRHL3過量表達可以抑制E-cadherin基因表達,進而促進腫瘤細胞的遷移和侵襲;SNX16的過量表達可以促進E-cadherin的回收再利用,而抑制乳腺癌細胞的遷移和侵襲[6-9]。在低侵襲力乳腺癌細胞MCF7中過量表達GRHL3,可以顯著增加細胞的遷移和侵襲能力;當在過量表達GRHL3的細胞中轉染SNX16 cDNA表達載體時,細胞的遷移和侵襲能力明顯降低。因此,GRHL3既能抑制E-cadherin的表達又能抑制SNX16的表達,進而影響細胞遷移和侵襲。GRHL3作為核內轉錄因子,參與調控細胞遷移和侵襲的靶基因表達,進而改變細胞的遷移和侵襲能力。除了已經鑒定的GRHL3調控的靶基因SNX16和E-cadherin外,可能還參與調控其他靶基因的表達。發現和鑒定GRHL3調控的靶基因及其信號通路,從而探討GRHL3在腫瘤細胞發生上皮-間質細胞轉分化的核心轉錄因子SNAIL、ZEB1和TWIST等發生相互作用的方式[12],為揭示GRHL3在腫瘤的遷移、侵襲和轉移的分子機制具有重要的理論意義,也為干預腫瘤細胞的遷移和侵襲尋找新的治療靶點具有應用價值。

