腦脊液腫瘤壞死因子-α和干擾素-γ對髓母細胞瘤患兒的預后評價分析
張 金 任思其 李舒婷 李 苗 龔小軍 孫艷玲 武萬水 孫黎明 杜淑旭
(首都醫科大學附屬北京世紀壇醫院兒科,北京 100038)
髓母細胞瘤(medulloblastoma, MB) 是最常見的兒童中樞神經系統惡性腫瘤,約占兒童期顱內腫瘤的20%~25%[1]。近年來由于手術治療、放射治療、化學藥物治療等多學科聯合治療的開展,5年無病生存率已由20世紀70年代的20%提高到70%~80%[2-3]。但因其易沿腦脊液或腦膜播散,仍有約30%的患兒出現早期復發或播散轉移,且復發患兒3年存活率不足20%[4],故復發播散者為難治性髓母細胞瘤。腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)和干擾素-γ(interferon-γ, IFN-γ)是體內重要的細胞因子[5-6],在腫瘤的發生、發展中發揮著重要作用。本研究通過測定MB患兒腦脊液TNF-α和IFN-γ濃度,探討TNF-α和IFN-γ對MB患兒預后的評估價值。
1 對象與方法
1.1 研究對象
將2016年11月至2018年6月期間確診髓母細胞瘤且無合并感染、無免疫、無血液系統等疾病的患兒167例作為研究對象,所有患兒均于手術后接受放射治療或化學藥物治療。其中男性113例,女性54例,中位年齡7.6(1.1~17.0)歲;經典型111例,促纖維增生/結節型37例,廣泛結節型12例,間變型4例,大細胞型3例。根據Chang’s M分期分為3組,無播散組(M0期) 66例,播散組(M+期) 54例及復發組 47例。本研究獲得首都醫科大學附屬北京世紀壇醫院倫理委員會批準(2015倫理其他第12號),患兒法律監護人簽署知情同意書。
1.2 治療原則
1)無播散組:>3歲患兒,于術后3~4周行放射治療,放射治療結束6周行維持化學藥物治療;≤3歲患兒,于術后3~4周行3個周期誘導化學藥物治療,根據危險分層及基因特點決定是否行放射治療。
2)播散組:患兒于術后3~4周行2個周期誘導化學藥物治療,之后行放射治療,放射治療結束6周行維持化學藥物治療。
3)復發組:根據個體化原則決定治療方案,加強化學藥物治療方案或靶向治療[7-8]。
1.3 檢測分析
1.3.1 標本采集
所有患兒均于化學藥物治療前常規腰椎穿刺檢查,留取腦脊液標本,其中無播散組有48例曾接受放射治療。室溫下1 000 g離心20 min,留取上清液,置于-20 ℃保存。
1.3.2 標本檢測
采用酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)法檢測腦脊液TNF-α和IFN-γ濃度,試劑盒均購自蘭博利德生物技術有限公司。所有操作均嚴格按照說明書進行。
1.4 統計學方法
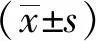
2 結果
2.1 各組間腦脊液TNF-α和IFN-γ的比較
無播散組腦脊液TNF-α和IFN-γ的濃度明顯高于播散組和復發組,差異有統計學意義(P<0.05);播散組和復發組之間TNF-α濃度差異無統計學意義 (P>0.05),IFN-γ濃度差異有統計學意義 (P<0.05),其中播散組腦脊液IFN-γ濃度高于復發組,詳見表1。同時,將無播散組根據是否接受放射治療分為2組,2組間TNF-α和IFN-γ的濃度差異無統計學意義(P>0.05),詳見表2。

表1 各組腦脊液TNF-α和IFN-γ的質量濃度Tab. 1 TNF-α and IFN-γ in CSF of the three groups [M(P25, P75),ng/L]


GroupNumber of caseTNF-αIFN-γRadiotherapy4823.47±7.40263.22±219.69Non-radiotherapy1819.67±9.90245.35±102.31t1.4790.331P0.1520.742
TNF-α:tumor necrosis factor-α;IFN-γ:interferon-γ.
2.2 TNF-α和IFN-γ對判斷預后的ROC曲線分析
本研究將播散組和復發組合并為難治組,無播散組為非難治組。ROC曲線分析結果顯示,TNF-α曲線下面積(AUC)大于IFN-γ,差異有統計學意義(P<0.05),以約登指數最大值所對應的樣本值為截斷值,TNF-α和IFN-γ截斷值分別為12.73 ng/L和136.53 ng/L,此時TNF-α的敏感度和特異度均高于IFN-γ。詳見表3和圖1。

表3 腫瘤預后的評價指標Tab. 3 Indexes for evaluating prognosis of tumor

圖1 評估腫瘤預后的ROC曲線Fig.1 ROC curves for evaluating prognosis of tumor
ROC:receiver operating characteristic;IFN-γ:interferon-γ;TNF-α:tumor necrosis factor-α.
3 討論
TNF-α和IFN-γ是人體內重要的細胞因子。TNF-α能夠誘導細胞凋亡、影響腫瘤血管系統和增強機體免疫力,具有抵抗和促進腫瘤生長的雙重作用[9]。過量的TNF-α能夠破壞機體對腫瘤免疫應答,促進腫瘤的生長和擴散,TNF-α在一定范圍內升高往往與轉移、復發、預后差和惡病質相關[10]。Jaime-Pérez 等[11]發現中樞神經系統白血病患者腦脊液中的TNF-α是明顯升高的,且在診斷中樞神經系統復發前就已檢測到TNF-α的升高。多項研究[12-13]表明,TNF-α與腦膠質瘤的發生、發展密切相關,病理分級越高,TNF-α的濃度越高。IFN-γ是最先被發現的細胞因子,具有免疫調節、誘導細胞凋亡、抑制癌基因表達等功能,文獻[14]顯示將INF-γ應用于多種腫瘤如乳腺癌、肝細胞癌、惡性淋巴瘤、宮頸癌等的治療,可降低復發,提高患者生存率。
本研究顯示無播散組腦脊液TNF-α和IFN-γ的濃度明顯高于播散組和復發組,不同于中樞神經系統白血病和腦膠質瘤,在MB中腫瘤高負荷狀態下TNF-α和IFN-γ濃度降低,與國外研究[15-16]中二者在MB患者外周血的結果一致。腦脊液TNF-α和IFN-γ濃度升高患兒預后較好,提示TNF-α和IFN-γ的表達在MB的發病過程中發揮抗腫瘤作用。而IFN-γ在播散組和復發組之間差異無統計學意義,考慮IFN-γ可能參與MB的播散復發。
本研究中根據治療效果和預后分為難治組和非難治組,TNF-α和IFN-γ的ROC曲線下面積分別為0.958和0.809(均>0.7),提示TNF-α和IFN-γ濃度對判斷MB的預后具有診斷價值,TNF-α和IFN-γ的最佳臨界值分別為12.73 ng/L和136.53 ng/L,具有很高的敏感度、特異度及準確度且TNF-α優于IFN-γ。TNF-α>12.73 ng/L提示無腫瘤轉移播散、預后較好。
TNF-α和IFN-γ參與腫瘤發病機制的研究較多,Wiegering等[15]對MB患者外周血T淋巴細胞的TH1細胞因子進行了檢測,發現在自體干細胞移植后早期TNF-α和IFN-γ的升高提示較好的預后。Sandén等[16]發現MB患者在腫瘤切除術后,外周血TNF-α和IFN-γ濃度較術前升高,接近健康對照組濃度。TNF-α和IFN-γ濃度升高預后較好,考慮機制為腫瘤細胞可被由TNF-α、IFN-γ等TH1相關因子和局部促炎因子介導的免疫效應細胞清除。
本研究中部分患兒接受了放射治療,研究顯示放射治療組患兒腦脊液中TNF-α和IFN-γ濃度高于未接受放射治療組,但差異無統計學意義(P>0.05),考慮為放射治療結束時間較長(6周),放射治療對腦脊液內細胞因子的影響趨于恢復,或樣本量偏少,不能反映總體水平,需進一步增加時間點或擴大樣本量進行研究。
盡管近年來MB的治療已經取得了很大進展,但部分患兒治療效果仍不理想,高危組患兒長期生存率較低,復發組患兒存活率則更低[17-18]。目前臨床工作中主要依據定期復查全腦全脊髓磁共振及腰椎穿刺明確腦脊液有無腫瘤細胞,來判斷有無腫瘤播散及復發,但均較疾病本身的進展滯后。本研究發現TNF-α和IFN-γ可以作為MB判斷預后的指標,采用合理的方法檢測并調控其水平,有助于臨床及早采取適當的治療措施,提高治療效果,降低復發風險。

