一種腸肌間神經叢膠質細胞無血清原代培養法的建立
權竹聲 張曉麗 朱進霞
(首都醫科大學基礎醫學院生理學與病理生理學系,北京 100069)
腸膠質細胞(enteric glial cell,EGC)是腸神經系統的重要組成部分,在維持腸道穩態中發揮重要作用。EGC主要分布于腸壁黏膜下神經叢和肌間神經叢,其中黏膜下神經叢EGC可以調節腸上皮細胞的增生、凋亡及遷移,維護腸黏膜屏障[1-2],而肌間神經叢EGC則在胃腸道動力的調節中發揮重要作用[3-4]。近年來研究顯示糖尿病、帕金森病和慢性傳輸型便秘患者結腸肌間神經叢中的EGC數量、形態和分布明顯異常[5-7],而 EGC的異常激活可能是誘導腸易激綜合征(irritable bowel syndrome, IBS)結腸動力紊亂的重要因素[8],表明結腸肌間神經叢EGC可能參與了多種疾病的發生、發展,但其具體作用機制目前仍不清楚。原代EGC培養可排除在體環境下的神經體液因素,是深入探討EGC功能特性的重要方法。目前已有腸道肌間神經叢EGC原代培養方法的報道[9-11],但關于培養過程中成纖維細胞污染的去除,現有方法尚需改進。有研究者嘗試應用無血清法去除雪旺細胞培養中成纖維細胞的污染,效果良好[12-13],但此方法尚未運用于EGC的原代培養。本實驗方法結合無血清培養改進現有的肌間神經叢EGC原代培養法,有效去除了成纖維細胞污染,獲得了純度較高,活性良好的結腸肌間神經叢EGC,現將具體方法闡述如下,供同行參考。
1 材料與方法
1.1 實驗動物
選取成年雄性C57/BL6 品系小鼠(由首都醫科大學實驗動物部提供),體質量20~22 g,許可證號:SCXK(京)2012-0001,嚴格按照實驗動物福利委員會許可操作,動物在22 ℃±1 ℃溫度條件下飼養,給予正常晝夜更替12 h/12 h光照及24 h食物與水分供應。
1.2 小鼠結腸肌間神經叢EGC的原代培養
器械經仔細清洗,75%(體積分數)乙醇浸泡30 min后烘干置于室溫備用。小鼠經頸椎脫臼處死,75%(體積分數)乙醇棉球消毒腹部皮膚,沿腹正中線剪開腹腔,迅速取出結腸組織置于通有混合氣[95%(體積分數)O2, 5%(體積分數) CO2]的4 ℃ Krebs液中。沖洗腸腔去除內容物,將結腸組織剪成約1 cm長的腸段,置于另一盛有無菌Krebs液的燒杯中重復沖洗2~3次。取一段腸管套在玻璃棒上,去除腸系膜,以精細鑷沿腸系膜附著處的腸管縱軸自上而下輕輕劃出一縱行肌缺口,用Krebs液濕潤的棉簽小心剝離縱行肌(肌間神經叢一般附著于縱行肌),置于無菌、通氣的4 ℃ Krebs液中,重復以上操作處理其余腸段。收集縱行肌組織于Krebs液中,4 ℃,356g離心30 s,棄上清,將組織移至另一無菌離心管重復以上操作3次以清洗組織。稱取Ⅱ型膠原酶13 mg,牛血清白蛋白3 mg溶于10 mL無菌 Krebs液配成消化液備用。組織置于消化液中,剪碎,37 ℃消化60 min,期間通氣并震蕩。4 ℃,356g離心8 min,入無菌操作間,棄上清,加入5 mL 0.05%(質量分數)胰蛋白酶,37 ℃消化7 min,等體積培養基(DMEM/F12)終止消化。離心,棄上清,1 mL培養基重懸,尼龍網過濾,離心,棄上清,完全培養基[含10%(體積分數)胎牛血清,1%(質量分數)雙抗的DMEM/F12]重懸,接種于24孔板中,置于37 ℃,5%(體積分數) CO2培養箱內培養。2 d后鏡下觀察可見EGC已貼壁,此外還可見呈桿狀、懸浮的肌細胞及未消化完全的組織碎屑等,以PBS清洗3次去除懸浮細胞后加入完全培養基繼續培養。若有少量肌細胞貼壁,可用0.05%(質量分數)胰蛋白酶消化3 min,即可去除肌細胞而對EGC無影響。之后每2天換液,一周后更換無血清培養基,培養5~7 d,待成纖維細胞脫落殆盡時更換完全培養基,可根據成纖維細胞污染情況重復以上操作,至細胞80%融合后傳代。待傳至第四代時神經元細胞已死亡,可得到純度較高的腸膠質細胞。每次實驗取4只小鼠結腸縱行肌-肌間神經叢組織,至傳代前細胞量可達約6.8×105。
1.3 細胞免疫熒光染色
將細胞懸液接種至預先放有蓋玻片的24孔板中,約24 h細胞貼壁良好后進行染色。細胞爬片經PBS洗滌3次×3 min,4%(質量分數)多聚甲醛室溫固定30 min,PBS 洗滌3次×3 min,滴加5%(體積分數)驢血清,室溫封閉30 min,完成后棄去封閉血清,加入一抗GFAP(04-1031,美國Millipore公司)、S100β(sc-393919,美國Santa Cruz Biotechnology公司)進行雙標記,4 ℃過夜孵育。次日取出,棄去一抗(A11055,美國Invitrogen公司),PBS 洗滌3次×10 min,滴加二抗(A21203, 美國Invitrogen公司),避光室溫孵育2 h后滴加DAPI,5 min后PBS 洗滌3次,甘油封片,在熒光顯微鏡下觀察并拍攝。共取來自3批細胞的6個隨機鏡下視野,分別統計GFAP和S100β單陽性或雙陽性細胞數在細胞總數中的比例。
1.4 探針負載細胞觀察胞內[Ca2+]i變化
細胞傳代24 h后,棄去培養基,PBS清洗3次,以5 μmol/L熒光探針fluo-4 AM(S1060,碧云天生物技術公司)負載細胞,避光37 ℃孵育40 min后棄去熒光探針,PBS清洗3次,加入HBSS液,在激光共聚焦顯微鏡(UltraVIEW Vox,美國PerkinElmer公司)下觀察。選擇貼壁良好、形態伸展、熒光強度較亮的細胞,設置掃描條件為488 nm波長激發、 39%激光強度、 PMT(790)、 Pinhole(310 μm)、每2 s采集一幅。首先掃描2 min待熒光強度穩定后加藥(ATP 10 μmol/L),待熒光強度穩定后終止實驗。共取3批細胞進行6次實驗,每次實驗對視野中細胞進行實時熒光強度數據采集,統計ATP給藥后發生胞內鈣瞬變的細胞比例及每個反應細胞最大熒光強度與基礎熒光強度的比值(Fm/F0)。
1.5 統計學方法
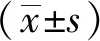
2 結果
2.1 EGC在結腸肌間神經叢的分布
膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)是目前較常用的成熟EGC標志物,小鼠結腸組織水平免疫熒光雙標記結果顯示,GFAP陽性的EGC在肌間神經叢大量分布,并與神經元標志物神經原纖維(neurofilament,NF)不共存,表明GFAP可作為結腸EGC的標志物,詳見圖1。
2.2 原代EGC純度
運用EGC標志物GFAP免疫熒光標記EGC,觀察其在原代細胞中的比例,結果顯示運用含血清培養基培養的原代細胞中,只有部分細胞表現出GFAP陽性,以平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)與GFAP雙標記染色可見,GFAP陰性的細胞多表現為α-SMA陽性,且胞核呈卵圓形,符合成纖維細胞的特征(圖2A),表明含血清培養基培養的原代細胞中存在大量的成纖維細胞污染。運用無血清培養后,可見原代細胞中絕大多數細胞均呈現GFAP陽性(圖2B),以另一種常用的EGC標志物S100β與GFAP雙標記并統計免疫陽性細胞在原代細胞中的百分比可得,GFAP陽性EGC占細胞總數的98.44%±1.07 %,95%CI為(95.70,101.2);S100β陽性EGC占93.61%±3.16%,95%CI為(85.48,101.7);GFAP與S100β雙陽性EGC占比93.09%±2.99%,95%CI為(85.4,100.8),結果來自6個鏡下視野共100個細胞,表明無血清培養成功去除了成纖維細胞污染且得到的EGC純度較高。

圖1 EGC在結腸肌間神經叢的分布Fig.1 Distribution of EGC in colonic myenteric plexus
A: double-label immunofluorescence of GFAP and NF in myenteric plexus of colon;NF:neurofilament;GFAP:glial fibrillary acidic protein;EGC:enteric glial cell.

圖2 原代EGC 細胞純度Fig.2 Purity of primary EGC
A:double-label immunofluorescence of GFAP and α-SMA in serum-containing cultured EGC;B:double-label immunofluorescence of GFAP and S100-β in serum-free cultured EGC;EGC:enteric glial cell;GFAP:glial fibrillary acidic protein;α-SMA:α-smooth muscle actin.
2.3 原代EGC活性檢測
EGC在接受ATP刺激后可表現出顯著的胞內鈣瞬變,而成纖維細胞則不具備這種特性。以Ca2+熒光探針fluo-4 AM孵育細胞,給予10 μmol/L ATP,利用熒光顯微數碼成像系統檢測探針熒光強度,動態觀察細胞內[Ca2+]i的變化。如圖3所示,靜息狀態下胞內[Ca2+]i維持在較平穩的水平,ATP給藥后,96.00%±4.00 %,95%CI為(84.89,107.1)的細胞發生胞內鈣瞬變,結果來自3批細胞共6次實驗,主要表現為胞內[Ca2+]i在短時間內快速升高(Fm/F0=1.93±0.08)隨后又迅速恢復至基線水平的周期性變化,提示原代EGC反應性良好。

圖3 ATP引起原代EGC胞內鈣瞬變Fig.3 ATP induced Ca2+ transients in primary EGC
A: representative images of primary EGC loaded with Fluo-4 at rest (left) and upon activation (right) with ATP (10 μmol/L);scalebar:70 μm;B: representative traces of ATP-induced Ca2+transients for three individual cells;EGC:enteric glial cell.
3 討論
肌間神經叢EGC原代培養過程中,成纖維細胞在操作中難以去除,在細胞培養過程中分裂增生十分迅速,因此成為制約EGC原代培養的關鍵因素。本實驗室利用成纖維細胞對血清依賴生長的特性,在現有肌間神經叢EGC原代培養方法[9]中結合無血清法,較特異地去除了成纖維細胞污染。
本實驗前期,本課題組參考了Smith等[9]建立的小鼠原代EGC分離方法,成功分離了小鼠結腸EGC,但在細胞鑒定中觀察到大量GFAP陰性而α-SMA陽性的細胞,提示原代細胞中存在成纖維細胞污染。在運用無血清法培養后,可見GFAP陰性細胞顯著減少,表明無血清培養法可有效去除成纖維細胞污染。Smith等[9]的文章中并未統計原代細胞純度,本實驗中,統計GFAP陽性細胞占比超過98%,95%CI為(95.70,101.2),表明純度較高,符合實驗要求。
多項研究表明ATP可以激發EGC胞內Ca2+濃度的顯著變化,如Gulbransen等[14]運用了組織原位Ca2+顯像技術,觀察到ATP可引起豚鼠結腸肌間神經叢中95.5% 的EGC發生鈣瞬變,而Boesmans等[15]的研究顯示,ATP可激發人十二指腸黏膜下神經叢原代EGC胞內鈣瞬變,反應細胞比例約為53%。本實驗中可以檢測到約96%,95%CI為(84.89,107.1)的無血清培養原代EGC在ATP作用下發生胞內鈣瞬變,這與Gulbransen等[14]的組織原位檢測結果相近,提示原代EGC反應性良好。而Boesmans等[15]的研究中反應細胞比例較低,原因可能在于人與嚙齒類動物的種屬差異,也可能在于原代細胞反應性差異。
針對原代EGC去除成纖維細胞的方法已有多方面嘗試,如抗有絲分裂法、差速貼壁法、流式細胞法、磁珠分選法等。其中抗有絲分裂法的原理是成纖維細胞分裂增生速率高于EGC,加入抗有絲分裂劑可顯著抑制成纖維細胞增生,但此法也存在弊端。由于EGC有一定的增生速率,會受到抗有絲分裂劑的影響,培養中若不能找到適宜的用藥劑量,將會嚴重影響EGC的增生。而成纖維細胞對血清的依賴遠高于EGC,無血清法對EGC生長的影響則相對較小。差速貼壁法利用成纖維細胞貼壁更快的特性,在反復貼壁操作中去除成纖維細胞,但由于EGC亦屬易貼壁細胞,操作中若不能把握合適的時間點,極易丟失目的細胞,相比之下無血清法能更大限度的減少EGC的丟失。流式細胞法和磁珠分選法利用免疫篩選原理分選細胞,精確度更高,但成本亦相對較高,且目前國內的流式細胞儀難以提供嚴格的無菌條件,細胞污染的概率亦較高,相比之下無血清法操作簡便、成本低廉且不會造成細胞污染。本實驗為原代EGC分離純化提供了新的參考,為EGC功能的探究提供了良好的技術基礎。

