帕金森病患者血漿增強α-突觸核蛋白細胞毒性及其機制研究
李 杰 謝秀娟 宋 煒 潘維花 楊巍巍 于 順*
(1.北京市大興區中西醫結合醫院神經內科,北京 100076; 2. 首都醫科大學宣武醫院神經生物學研究室,北京 100053)
帕金森病(Parkinson’s disease, PD)是繼阿爾茨海默病(Alzheimer’s disease, AD)之后的第二大神經系統常見退行性疾病。目前基于運動癥狀的診斷已是PD發病的晚期,此時患者黑質多巴胺 (dopamine,DA)能神經元退變率已>70%[1]。但是,以路易體病變為主要特征的PD病理變化早在多巴胺能神經元病變之前就已經出現于嗅球、脊髓、消化道的壁內神經叢以及其他外周神經節中[2]。
路易體的主要成分是聚集的α-突觸核蛋白(α-synuclein,α-Syn)。研究[3]顯示,α-Syn在絲氨酸129(serine,S129)位點的磷酸化可致其發生聚集,形成寡聚化α-Syn。其中,蛋白磷酸酶2A (protein phosphatase 2A,PP2A)是導致其去磷酸化唯一的蛋白磷酸酶,而polo樣激酶2(polo-like kinase 2,PLK2),則可以磷酸化α-Syn,并導致其毒性增加。神經酰胺是PP2A的激動劑,它的升高可間接促使磷酸化α-Syn去磷酸化。
研究[4-5]顯示,α-Syn單體和寡聚體從神經元釋放并存在于細胞外液,包括腦脊液和血漿中。體內和體外實驗[6]均表明這些分子通過內吞作用被神經元內化。筆者假設,α-Syn的聚集和毒性很可能是由于PD患者內環境發生變化,而血液是構成機體內環境的重要組成部分。為了驗證這個假設,本研究采用正常受試者(normal subject,NS)或PD患者的血漿培養大鼠原代神經元,評估α-Syn的磷酸化和其聚集與細胞活力的關系及機制。
1 對象與方法
1.1 研究對象
選擇PD患者和正常對照各28例。PD患者為2015年10月至2016年4月在首都醫科大學附屬北京天壇醫院神經內科住院的PD患者,PD患者入選標準:有進行性發展的病史,存在2種以上PD的典型癥狀——靜止性震顫、運動遲緩、僵直、姿勢不穩,并排除其他原因造成的癌。患者平均年齡為(56.68±11.42)歲,所有入選者均簽訂知情同意書。正常對照選擇年齡、性別與之匹配的健康正常人。
1.2 實驗方法
1.2.1 試劑
辣根過氧化物酶(horseradish peroxidase,HRP)標記山羊抗小鼠IgG多克隆抗體購自中杉金橋公司;生物素化的3D5由康為世紀公司標記;3D5抗α-Syn的單克隆抗體為本實驗室制備;抗S129位磷酸化α-Syn多克隆抗體(Santa Cruz公司,美國)Neurobasal培養基(Gibco公司,美國),B27 (Gibco公司,美國),Dulbecco’s modified eagle medium (DMEM)培養基(Gibco公司,美國),胎牛血清(fetal bovine serum,FBS)(Berlin公司,美國)。BCA蛋白質定量試劑盒(Pierce Biotech公司,美國)。
1.2.2 實驗動物
健康Vista大鼠,鼠齡0~12 h,由中國軍事醫學科學院動物中心提供,實驗動物許可證號:SCXK-2017-005。
1.2.3 重組人α-Syn的制備和純化
將含有α-Syn基因的pET重組質粒轉化至大腸桿菌BL21感受態細胞中,在含氨芐西林的2×YTA培養液中培養至適當密度后加入異丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)誘導蛋白表達3 h,超聲破碎,進一步用離子交換層析、疏水層析及反相層析純化后獲得α-Syn蛋白。純化后的α-Syn蛋白經BCA法定量和Western blotting法鑒定后,冷凍抽干于-80 ℃分裝保存。
1.2.4 海馬神經元原代培養
冰上斷頭去除Vista大鼠雙側海馬,剪碎后用0.25%(質量分數)胰蛋白酶37 ℃消化30 min,用DMEM培養基[90%(體積分數) DMEM + 10%(體積分數)胎牛血清]終止消化。巴斯德玻璃滴管火焰拋光后,輕柔吹打。用DMEM培養基稀釋成5×105/mm3的密度接種到直徑35 mm多聚賴氨酸包被的培養皿,置于37 ℃,5%(體積分數)CO2的培養箱內。2 h后,顯微鏡下觀察神經元貼壁后,改用Neurobasal、B27無血清培養基繼續培養箱內培養。以后每3 d換液1次,培養10~12 d左右用于實驗。
1.2.5 PD患者血漿細胞外α-Syn孵育方法
終濃度100 μmol/L α-Syn,溶于含30%(體積分數) PD血漿或正常人血漿的PBS緩沖液中,37 ℃,1 000 r/min,震蕩孵育48 h。利用親和層析純化α-Syn寡聚體,在原代神經培養基中加入終濃度為5 μmol/L的α-Syn單體及寡聚體,同時添加30%(體積分數)PD血漿、正常人血漿和胎牛血漿,37 ℃,孵育14 d。
1.2.6 Western blotting法檢測α-Syn磷酸化和寡聚化
抽提各組原代神經元,選用放射免疫沉淀(radio immunoprecipitation assay,RIPA)蛋白裂解液進行細胞裂解,BCA法測蛋白濃度,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),半濕轉法將蛋白轉移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)PVDF膜,5%(質量分數)脫脂奶粉封閉1 h,分別入3D5 (1∶5 000);或anti-S129-pS-α-Syn兔多抗 (1∶2 000)。4 ℃過夜。0.1%(質量分數) TBST洗膜3次,入相應的HRP標記的羊抗兔(或鼠)免疫球蛋白抗體中(1∶5 000)室溫孵育1 h,洗膜同前。加入化學發光液,于暗室化學發光及顯影、定影。
1.2.7 酶聯免疫吸附(enzyme linked immunosorbent assay,ELISA)檢測α-Syn寡聚化和磷酸化 參考文獻[7]已經建立的ELISA方法進行測試。用濃度為1 mg/L的3D5或者磷酸化α-Syn抗體包被96孔酶標板,2.5%(質量分數)明膠封閉2 h。加入震蕩后的α-Syn,37 ℃孵育2 h。向各孔加入100 μL堿性磷酸酶標記的親和素(1∶5 000),37 ℃孵育1 h。以上每一步驟之后用PBST洗滌各孔4次。最后加入100 μL對硝基酚磷酸顯色液(p-nitrophenol,pNPP),37 ℃顯色30 min,405 nm處測定吸光度值。
1.2.8 流式細胞技術
在25 cm2小培養瓶中培養的各組原代神經元,經過寡聚體樣品處理14 d后,棄去培養基,以0.25%(質量分數)胰酶消化懸浮;2 000 r/min,離心5 min收集細胞。預冷PBS洗滌細胞兩次;用400 μL Binding Buffer懸浮細胞,調整細胞濃度約為1×106個/mL。在細胞懸浮液中加入5 μL Annexin V-異硫氰酸熒光素,(fluorescein isothiocyanate,FITC),混勻后于4 ℃避光下孵育15 min。加入10 μL 碘化丙啶(propidium iodide,PI)后輕輕混勻于4 ℃避光孵育5 min;1 h內以FACSCalibur流式細胞儀分析檢測。
1.2.9 α-Syn細胞活性檢測
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]法檢測各組細胞活性,各組細胞按1×105個/孔接種于96孔板,每組8個孔,每孔加入20 μL 5 g/L MTT。放入5% (體積分數)CO2培養箱中孵育4 h后,每孔加入100 μL 二甲基亞砜(dimethyl sulfoxide,DMSO),混勻,490 nm波長處測定吸光度值。
1.3 統計學方法
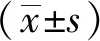
2 結果
2.1 PD血漿促進外源性α-Syn寡聚化和磷酸化
Western blotting法檢測結果顯示各組均出現不同程度的α-Syn寡聚體,相對分子質量分別是36 000、54 000、72 000、108 000和254 000;對照組無磷酸化α-Syn檢出,NS組和PD組磷酸化α-Syn寡聚體,多為54 000。Western blotting法和ELISA法檢測結果顯示,PD組的寡聚體和磷酸化均α-Syn較NS組明顯升高。與正常人血漿相比,PD血漿能夠促進α-Syn磷酸化和寡聚化(圖1)。
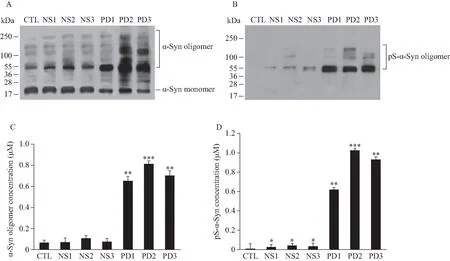
圖1 PD血漿可促進α-Syn發生寡聚化和磷酸化Fig.1 Effects of NS and PD plasma on α-Syn oligomerization and phosphorylation in neuronal culture medium
A: Oligomeric α-Syn levels were examined by Western blotting;B: pS-α-Syn levels were examined by Western blotting;C: Oligomeric α-Syn levels were examined by ELISA;D: pS-α-Syn levels were examined by ELISA. (n=5). Recombinant human α-Syn (5 μmol/L) was added to medium containing 30% NS or PD plasma for 14 days.*P<0.05,**P<0.01,***P<0.001vsCTL;PD(1-3): plasma of Parkinson’s disease (3 cases);α-Syn: α-synuclein;pS-α-syn: phosphorylation S129 α-synuclein;CTL: Control group;NS(1-3): palsma of normal sample (3 cases);ELISA:enzyme linked immunosorbent assay.
2.2 PD血漿促進α-Syn寡聚體對原代神經元的毒性
MTT法檢測顯示,加入PD患者血漿孵育的α-Syn寡聚體組(o-α-Syn-PD)細胞活力比對照組明顯降低;比正常人血漿孵育的寡聚體(o-α-Syn-NS)組的細胞活力低約30%(圖2)。向原代神經元培養基中添加o-α-Syn-PD,培養至第1、3、5、7和14天,MTT法觀察細胞活力變化,結果顯示o-α-Syn-PD組的細胞活力隨培養時間增加而降低(圖3 A)。向原代神經元培養基分別添加終濃度為1、2、4、8、10 mmol/L的寡聚體,培養14 d,寡聚體組的細胞活力均隨劑量的增加而降低(圖3 B)。流式細胞術結果顯示PD組總凋亡細胞數比對照組多約14.3%,比正常人組多約7.6%(圖4)。
2.3 PD血漿孵育寡聚體降低原代神經元內PP2A活性
o-α-Syn-PD組PP2A的活力較對照組和正常人血漿組降低(圖5 A),培養時間越長(1~14 d),PP2A活力下降越明顯(圖5 B),且隨寡聚體濃度(1~10 mmol/L)的增加而下降,具有明顯的劑量-效應關系(圖5 C)。Western blotting法檢測結果顯示,PD組神經元內的PP2A的表達水平并未異常,而C亞基酪氨酸307位磷酸化PP2A含量增加(圖5D ),這一變化是PP2A活力下降的主要原因。加入C2-ceramide后,PP2A的活力回復正常(圖5E)。
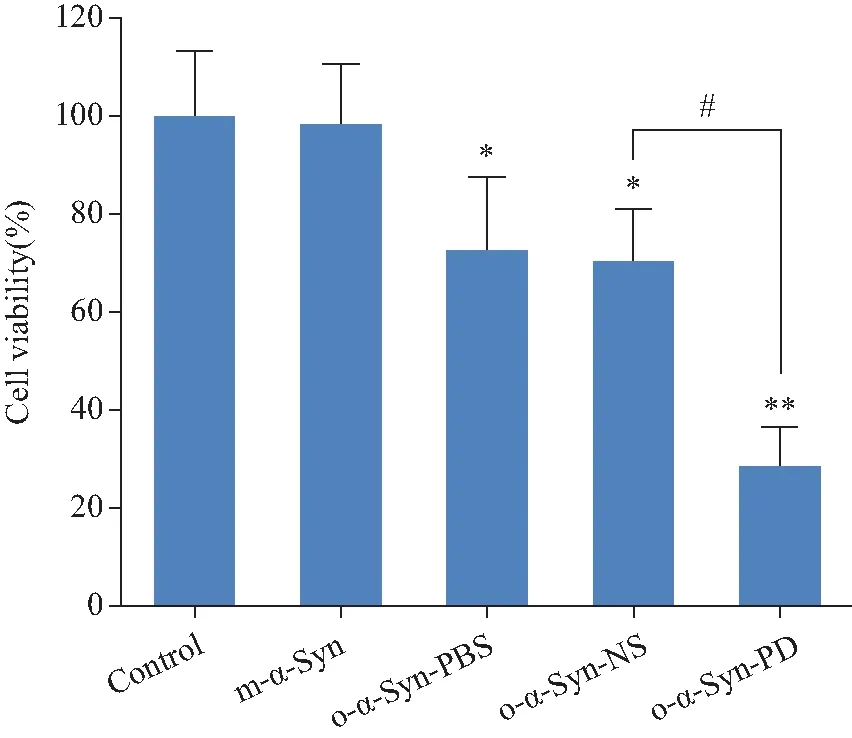
圖2 MTT法檢測PD血漿孵育的α-Syn寡聚體引起原代神經元細胞活力下降Fig.2 Cell viability decreased in the neurons after treated with o-α-Syn-PD
*P<0.05,**P<0.01vscontrol group;#P<0.05vso-α-Syn-NS group.PD: plasma of Parkinson’s disease;o-α-Syn-PD: oligomer-α-synuclein incubated in Parkinson’s disease plasma;o-α-Syn-NS: oligomer-α-synuclein incubated in normal subject plasma;m-α-Syn: monomer-α-Syn.
3 討論
帕金森病是一種常見的慢性、進行性神經變性疾病。主要的病理特征是中腦黑質致密帶DA能神經元選擇性、進行性變性,紋狀體中DA含量明顯減少,殘余的神經元內出現嗜酸性包涵體、路易小體,主要成分是α-Syn。α-Syn的多種結構形式如無定型聚集物“寡聚體”原纖維,及其磷酸化、硝基化和泛素化均有神經毒性作用。這些錯誤折疊、寡聚化α-Syn和α-Syn在神經元胞質內呈動態平衡,當平衡改變后,可溶性原纖維迅速聚集成大分子、不溶性細纖維進而形成Lewy小體[8]。
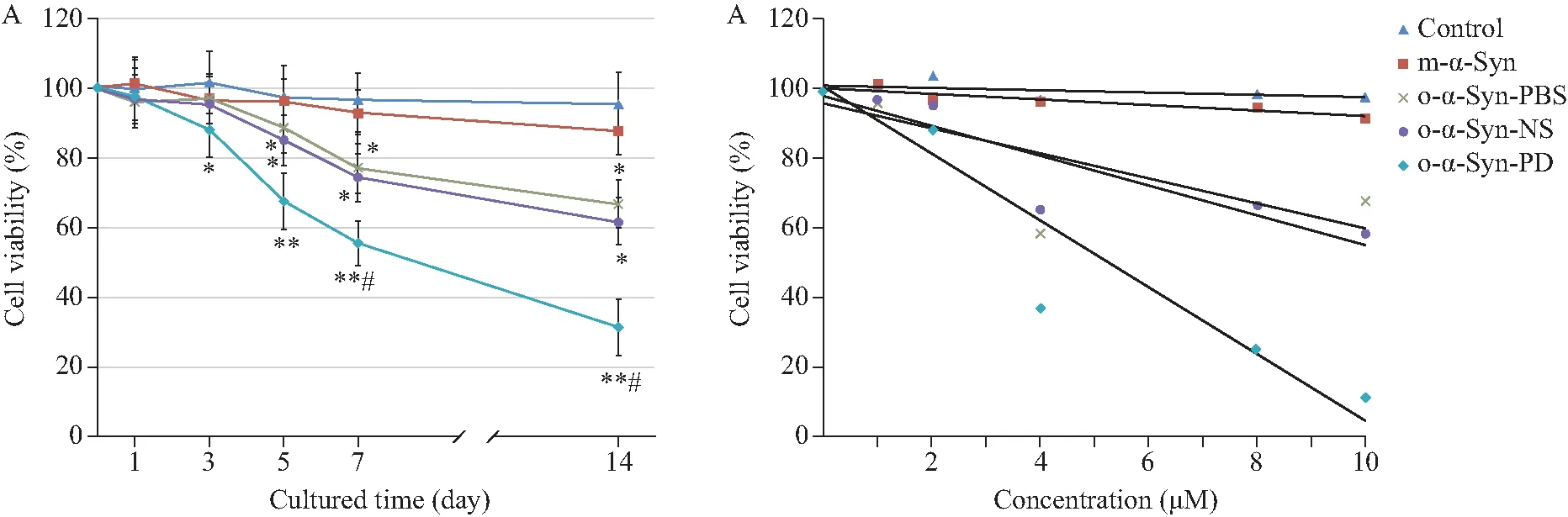
圖3 o-α-Syn-PD 對神經元活力下降的效應具有劑量和時間依賴關系Fig.3 Dose and time dependence o-α-Syn-PD deceased the neural cell viability
A: Time-dependent decrease in cell viability in primary cultured neurons treated by o-α-Syn-PD. o-α-Syn-PD were added to neurons at 5 μmol/L for DIV 14. The oligomer began to influence the cell viability from 3d after addition and the call viability lower with cultured time.n=12.*P<0.05,**P<0.01vscontrol group;#P<0.05vso-α-Syn-NS group;B:effect of o-α-Syn-PD decrease the cell viability appeared dose-dependent relation;o-α-Syn-PD: oligomer-α-synuclein incubated in Parkinson’s disease plasma;o-α-Syn-NS: oligomer-α-synuclein incubated in normal subject plasma.
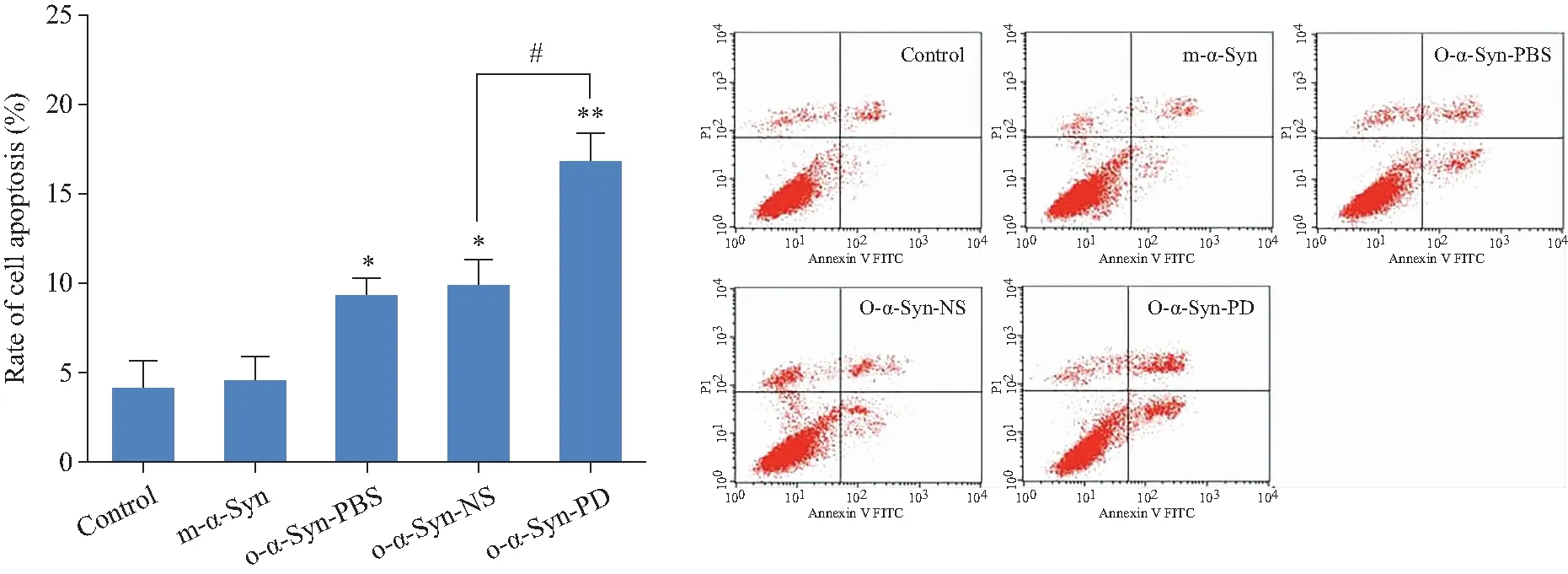
圖4 流式細胞術檢測結果Fig.4 Results of flow cytochemistry
A: Rate of apoptosis neurons in o-α-Syn-PD group was significantly increased compared with the control group, and higher than in o-α-Syn-NS by about 14.3%;B: representative images of flow cytometry in each group.n=5.*P<0.05,**P<0.01vscontrol group;#P<0.05vso-α-Syn-NS group;o-α-Syn-PD: oligomer-α-synuclein incubated in Parkinson’s disease plasma;o-α-Syn-NS: oligomer-α-synuclein incubated in normal subject plasma;m-α-Syn: monomer-α-Syn;FITC:fluorescein isothiocyanate;PI:propidium iodide.
可溶性神經毒性作用的α-Syn聚集,暫時可避免神經元受到更廣泛的損害,而最終病理性積聚導致細胞的凋亡或退行性死亡。筆者認為,作為一種廣泛累及的全身性疾病,PD患者血液環境可能成為改變細胞外α-Syn正常構象的重要場所和影響因素,并成為α-Syn病理的傳播途徑之一,加速PD的病程進展。
PD的機制研究中,影響α-Syn蛋白構型寡聚化的因素有很多,其中以磷酸化修飾受到的關注最多。α-Syn第129位絲氨酸磷酸化是PD的一個重要特征。并且在PD患者的LB中,90%的o-α-Syn的129位絲氨酸發生了磷酸化的異常修飾[9-10]。體外實驗顯示S129磷酸化后比未磷酸化能產生更多寡聚體和不溶性成分。該磷酸化主要由PLK2完成、一系列相關酶如PP2A等的調節,通過N末端的重復序列或NAC區為底物,磷酸化率>95%。
本研究在37 ℃、1 000 r/min震蕩的條件下,將α-Syn在血漿中孵育48 h。利用偶聯有α-Syn單克隆抗體的CNBr活化的瓊脂糖凝膠4B作為介質,親和層析法將PD血漿中孵育的α-Syn寡聚體純化出來。通過Western blotting法及ELISA法分析,證實經PD患者周圍血漿孵育,α-Syn會發生與在神經元內相似的S129位點的磷酸化修飾,這意味著,PD患者的周圍血漿環境存在對α-Syn進行S129磷酸化的修飾,從而打破構象平衡而出現聚集。
PP2A是α-Syn去磷酸化的唯一蛋白磷酸酶,其減少可以引起α-Syn磷酸化水平升高,且α-Syn過表達或寡聚化,可使PP2A催化亞基酪氨酸307位點發生磷酸化,降低活性,并進一步致α-Syn磷酸化水平升高發生聚集,形成惡性循環[11]。外周血中可溶性α-Syn寡聚體可以通過血-腦脊液屏障進入腦內,并對神經元產生毒性。本研究通過Western blotting法和ELISA法證實,隨著α-Syn寡聚體濃度升高和作用時間的增加,可引起細胞內的PP2A發生磷酸化水平增高和活力降低。在培養中給予神經酰胺,可使PP2A的活力升高,神經元活力也隨之升高。而PD患者血漿孵育的α-Syn寡聚體,和正常人相比,引起的PP2A等酶活性下降更明顯。本研究中所得出的結論與文獻[11]一致,這說明當PD中樞神經系統內出現病變以后,相關酶的變化可在外周血液環境中發生同步變化,而外周血液中與α-Syn磷酸化相關酶類活性的改變、導致了α-Syn磷酸化修飾水平,并促使其聚集。本實驗結果表明,細胞外α-Syn主要是以129位絲氨酸磷酸化修飾為主,在等量的α-Syn寡聚體中,PD血漿孵育的α-Syn寡聚體磷酸化水平要比正常人顯著升高。這樣的α-Syn寡聚體可由神經元培養基中,進入神經元內部,引起神經元活力的下降和死亡。
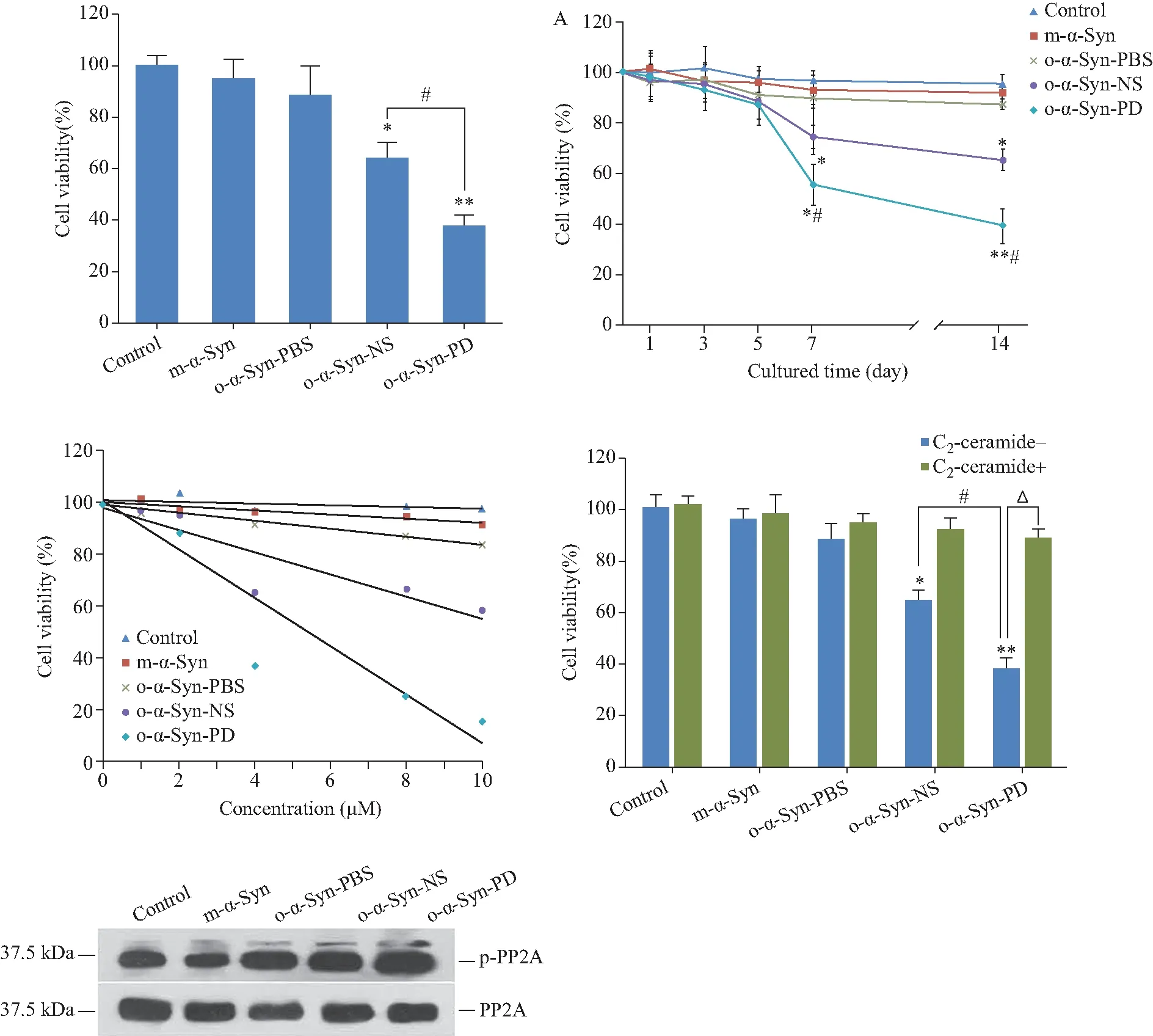
圖5 PD血漿孵育寡聚體降低細胞內PP2A活性Fig.5 Effect of o-α-Syn-PD on PP2A activity
A:PP2A activity in neurons decreased by o-α-Syn-PD;B:Time-dependent decrease in PP2A activity in primary cultured neurons treated by o-α-Syn-PD;C: effect of o-α-Syn-PD decrease the PP2A activity appeared dose-dependent relation;D: Co-IP with Western blotting result showed that the protein level of PP2A in neurons treated with oligomers for 14 days is no difference with control group, the Tyr307 phosphorated PP2A increased compared with control group and o-α-Syn-NS group;E: C2-ceramide prevented the PP2A activity downregulation induced by o-α-Syn-PD.n=5.*P<0.05,**P<0.01vscontrol group;#P<0.05vso-α-Syn-NS group;△P<0.01vso-α-Syn-PD +C2-ceramide group;o-α-Syn-PD: oligomer-α-synuclein incubated in Parkinson’s disease plasma;o-α-Syn-NS: oligomer-α-synuclein incubated in normal subject plasma;m-α-Syn: monomer-α-Syn;PP2A: protein phosphatase 2A.
這樣的具有神經毒性的α-Syn聚集體,在周圍血液中發生修飾形成對機體影響重大。因為盡管α-Syn可形成外泌體由細胞以胞吐形式分泌[12],或以寡聚體的形式存在,但細胞外游離的α-Syn單體仍占大多數。這些占大多數的α-Syn發生異常聚集后,會隨著血液傳播。并透過血-腦脊液屏障返回神經系統加劇對中樞神經系統的損傷。
筆者認為PD患者血漿環境的變化,及其對PD關鍵蛋白α-Syn磷酸化和寡聚化的修飾,很可能是Lewy體病變全身累及的關鍵因素。在血液中的α-Syn的寡聚體會隨血液循環累及周圍神經,造成內臟自主神經、脊髓和低位腦干、嗅束嗅球等部位受損時,出現早期的非運動癥狀,如便秘、體位性低血壓、嗅覺減退等;而此時腦內神經元尚處于代償狀態。隨著病程的進展,周圍血液孵育的α-Syn寡聚體不斷通過血-腦脊液屏障進入中樞神經系統,中樞神經元損傷的程度加劇,當路易體病變蔓延到海馬和皮質等部位時則引起認知功能下降、累及至中腦黑質、紋狀體等引起運動障礙,并隨著病程的進展而發展。
綜上,基因突變等原因導致的α-Syn的過表達,線粒體損傷,使得細胞內環境發生變化,α-Syn出現磷酸化水平增加,易于發生磷酸化并聚集。α-Syn寡聚體在生理環境下較穩定,不易分解,并可以進一步使胞內PP2A的活力下降,加速α-Syn的磷酸化和寡聚化。隨著病程的進展,部分死亡的神經元分解后,釋放Syn單體和磷酸化的α-Syn寡聚體進入血液中。受腦組織的釋放減少以及在血液中的α-Syn寡聚體的影響,血中PP2A活性下降。血液中的α-Syn的單體磷酸化水平增高并易于聚集。已聚集的α-Syn進一步降低PP2A的活性,并加速寡聚體的形成。在血液中孵育的α-Syn寡聚體的再次進入神經元內,一方面會直接破壞細胞穩定性,另一方面抑制PP2A的活性,同時使神經元內的α-Syn修飾環境惡化,進一步加速α-Syn的磷酸化和寡聚化,這一可能是PD病程快速進展的重要機制。

