形形色色的水解反應
河北 韓萬中

一、氯化物的水解
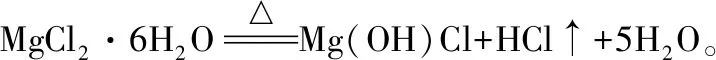

【例1】(2017·全國卷Ⅰ·27改編)Li4Ti5O12和LiFePO4都是鋰離子電池的電極材料,可利用鈦鐵礦(主要成分為FeTiO3,還含有少量MgO、SiO2等雜質)來制備,工藝流程如下:




【例2】三氯氫硅(SiHCl3)是制備硅烷、多晶硅的重要原料。
(1)(2009·廣東·23節選)三氯氫硅整個制備過程必須嚴格控制無水無氧。SiHCl3遇水劇烈反應生成H2SiO3、HCl和另一種物質,寫出配平的化學反應方程式:____________________。
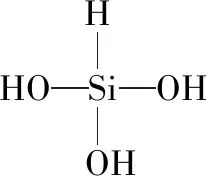
(2)(2018·全國卷Ⅲ·28節選)SiHCl3在常溫常壓下為易揮發的無色透明液體,遇潮氣時發煙生成(HSiO)2O等,寫出該反應的化學方程式:____________________。


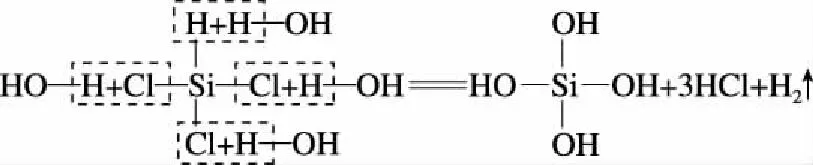

【例3】S2Cl2是工業上常用的硫化劑,有非常廣泛的應用。S2Cl2分子中各原子最外層均滿足8電子穩定結構,該分子的結構式是________。S2Cl2與水反應,有無色刺激性氣味氣體產生,并有黃色沉淀生成,該反應的化學方程式是____________________。

【解析】由價鍵理論可得S2Cl2的結構式為Cl—S—S—Cl。S2Cl2與水發生反應時,S2Cl2分子中顯負電性的Cl與H2O分子中顯正電性的H結合成HCl,兩者的殘基—OH與—S—S— 結合后根據題目信息“需要”再分解為SO2、S和H2O,最后配平得出答案。
二、硫化物的水解
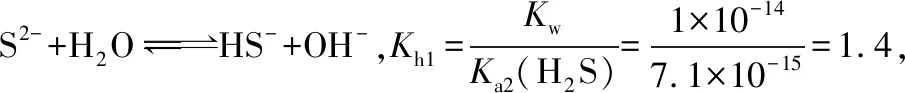

【答案】錯誤

三、氮化物的水解

【例5】制備氮化鎂的裝置示意圖如下:

回答下列問題:
(1)C的作用是________________,
D的作用是________________,
是否可以把C和D的位置對調并說明理由:________________。
(2)寫出E中發生反應的化學方程式:________________。
(3)請用化學方法確定是否有氮化鎂生成,并檢驗是否含有未反應的鎂,寫出實驗操作及現象:________________。
說明:人教版高中化學沒有關于Mg3N2和水反應的介紹,涉及它的考查可以追溯到1994年全國高考化學卷28題,該題題干中明確指出氮化鎂遇水反應生成Mg(OH)2和NH3。
【答案】(1)除去氧氣(及氮氧化物) 除去水蒸氣 不能,對調后無法除去水蒸氣
(3)取少量產物于試管中,加入少量蒸餾水,試管底部有沉淀生成,可聞到刺激性氣味(或把濕潤的紅色石蕊試紙放在管口,試紙變藍),證明產物中含有氮化鎂;棄去上清液,加入稀鹽酸,若觀察到有氣泡產生,則證明產物中含有未反應的鎂

四、碳化物的水解

五、磷化物的水解

六、金屬氫化物的水解
有些金屬氫化物如CaH2等也能和水發生反應,登山隊員常用此反應制取氫氣。CaH2中H-與水電離出的H+相結合生成H2,這是一個價態歸中型的氧化還原反應。
【例6】(2015·浙江·27節選)NaAlH4與水發生氧化還原反應的化學方程式:____________________。


綜上所述,像一些金屬氯化物如FeCl3、MgCl2等水解屬于中學意義上的鹽類的水解,其水解的逆過程是酸堿中和反應,受濃度、溫度和其他離子的影響較大,學生在認知上很少產生障礙。但由于金屬離子是分級水解、金屬離子極化能力不同或生成物的水溶性不同,所以產物類別各異,較低價態金屬的氯化物常常生成堿式鹽,較高價態則生成氫氧化物甚至是氧化物,這常常會給學生帶來理解上的困難。像SiCl4、PCl3等一些非金屬氯化物的水解,因其不屬于鹽類而略高于課本,但其水解模式遵循陰陽匹配、等量交換原則與鹽類水解相通,不同的是反應往往不可逆、產物是兩種酸,甚至可能會在“交換”后出現歸中、歧化、分解、脫水等連續的變化,體現物質的個性,需要學生靈動機智;另外,由于非金屬氫化物為共價化合物,我們可以按照有機化學中的取代反應理解它們的水解,且有利于發展學生的空間想象和類比遷移能力,提升它們的宏觀辨識和微觀探析的化學素養水平。在充分理解非金屬氯化物的水解的基礎上,再進行處理硫化物、碳化物、磷化物、金屬氫化物等水解問題上較得心應手。
既然存在水解反應,推而廣之,一些物質還可能發生酸、醇、氨等其他溶劑溶解,在高三復習模考中同學們可留心一下,在遇到相關問題時希望學生能受到水解模型的啟發進行做題。

